核酸分離・定量・精製市場の市場規模・シェア分析-成長動向と予測 (2025-2030年)
核酸分離・定量・精製市場レポートは、テクノロジー別(カラムベース精製など)、製品別(キット・試薬、機器、その他の製品)、アプリケーション別(トータルRNA分離・精製など)、エンドユーザー別(病院など)、地域別(北米、欧州、アジア太平洋など)に分類されます。市場予測は、金額(米ドル)で示されます。

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
核酸分離、定量、精製市場の概要
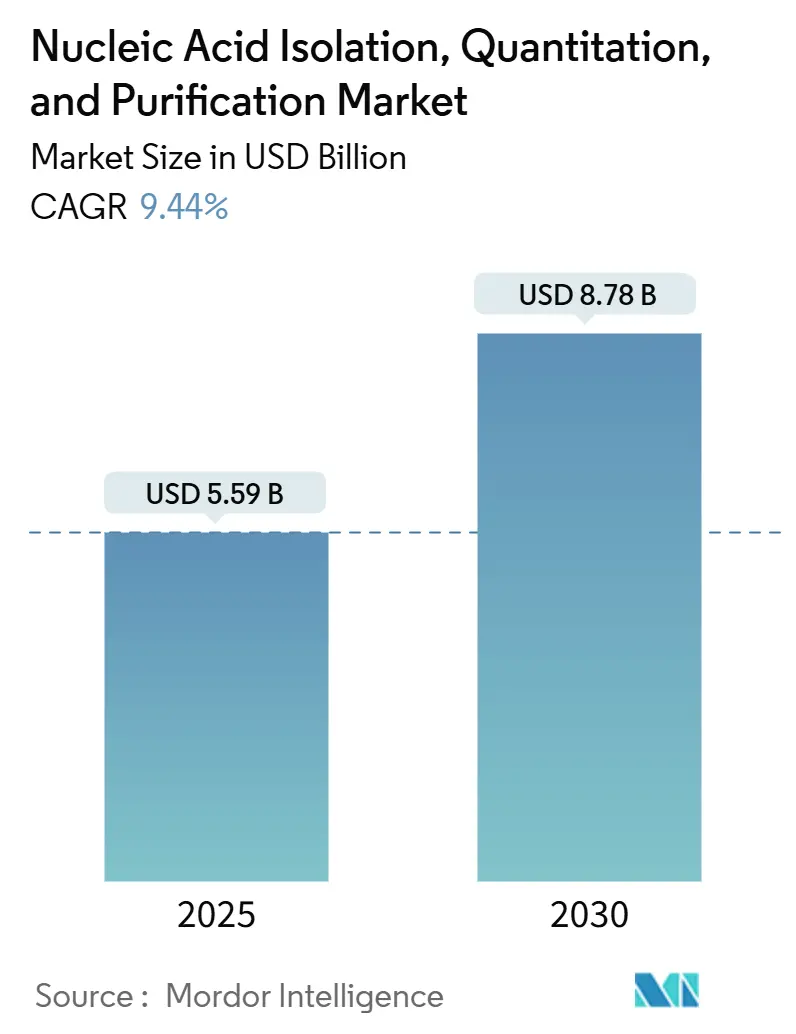
核酸分離、定量、精製市場は、2025年には55.9億米ドルと推定され、2030年までに87.8億米ドルに達すると予測されており、予測期間(2025年~2030年)中の年平均成長率(CAGR)は9.44%です。この市場の成長は、臨床検査室における次世代シーケンシング(NGS)の日常的な腫瘍学ワークフローへの組み込み、国家ゲノムプログラムによるサンプル処理能力の拡大、および自動化による人員不足の緩和によって牽引されています。
DeepMindのAlphaGenomeが1回の実行で100万塩基のDNAを読み取る能力を示したように、抽出品質は下流の分析結果に直接影響を与えます。磁気ビーズシステム、改良されたマイクロ流体技術、およびポイントオブケア(PoC)形式は、汚染を減らし、手作業時間を短縮することで、この変化をさらに強化しています。バイオ医薬品企業や公的研究機関からの資金流入は、ハイスループットプラットフォーム、キット、消耗品における製品開発を支えています。
主要なレポートのポイント
* 技術別: 磁気ビーズベース精製が2024年に52.1%の収益シェアを占め、2030年までに11.4%のCAGRで拡大すると予測されています。
* 製品別: キットと試薬が2024年の売上の48.3%を占めましたが、機器は2030年までに11.8%のCAGRで最速の成長を記録しています。
* 用途別: ゲノムDNA分離が2024年に20.6%のシェアを占めましたが、microRNA分離は2030年までに11.7%のCAGRで進展しています。
* エンドユーザー別: 製薬およびバイオテクノロジー分野が2024年の需要の43.3%を占めましたが、受託研究機関(CRO)は12.4%のCAGRで成長すると予測されています。
* 地域別: 北米が2024年に42.4%の市場シェアを維持しましたが、アジア太平洋地域は2030年までに10.4%のCAGRで成長する見込みです。
市場の動向と洞察
推進要因
* 臨床グレードNGS需要の急増: 腫瘍学におけるNGSの利用拡大は、ホルマリン固定パラフィン包埋(FFPE)組織やリキッドバイオプシーサンプルに対する抽出仕様の厳格化を促しています。Labcorpの報告によると、集束音響機器を使用することでFFPE組織からのDNA品質が3倍向上し、断片化が最小限に抑えられます。リキッドバイオプシーアッセイは、全細胞フリーDNAの1%未満を構成する循環腫瘍DNAを濃縮できる精製システムを必要とします。
* 国家ゲノムイニシアチブ: 政府のシーケンシングプログラムは、ハイスループットプロトコルを標準化することで、安定した注文量を維持しています。オーストラリアのゲノムヘルスフューチャーズミッションは、20万人以上の市民を対象に5億100万米ドルを投入しており、多様な血液および組織入力に対応できる自動ビーズプラットフォームの需要を促進しています。
* 分子生物学R&D資金の増加: 米国国立衛生研究所(NIH)はゲノム医療研究に31億米ドルを計上し、研究室が手動カラムをロボットワークフローに置き換え、再現性を向上させることを可能にしています。助成金は、DNA、RNA、タンパク質を共精製するマルチオミクス研究を優遇しており、バッチ変動を最小限に抑える統合キットの革新を促しています。
* PoCデバイス向けマイクロ流体抽出: 紙ベースおよびチップスケールモジュールは、電力消費の大きい遠心分離機なしで核酸を結合できるようになりました。PRECISEカードは、全血から血漿を分離し、ウイルスRNAを1ステップで精製します。このようなデバイスは、特に検査インフラが不足している低資源地域において、最前線の診療所で感染症アッセイを30分以内に実行することを可能にします。
阻害要因
* 高額な機器および試薬コスト: 自動抽出装置は10万~50万米ドルかかる場合があり、消耗品はサンプルあたり10~50米ドル追加されるため、小規模な研究室での導入が制限されています。フィルターペーパースピンカラムなどの低コストの代替品は、十分な純度を維持しながらサンプルあたりの費用を削減しています。
* 新興市場での浸透率の低さ: インフラのギャップは、低・中所得国における遺伝子ベース診断の普及を遅らせています。承認された32の遺伝子治療のうち、これらの地域で現在利用可能なのはわずか5つであり、周囲温度に耐える機器不要の抽出の必要性が浮き彫りになっています。
* 樹脂およびシリカサプライチェーンのリスク: 樹脂およびシリカのサプライチェーンは、アジアでの生産に集中しているため、リスクを抱えています。
* 有害廃棄物処理規制の強化: 北米および欧州を中心に、有害廃棄物処理に関する規制が厳格化されています。
セグメント分析
* 技術別:磁気ビーズの優位性
磁気ビーズ精製は、核酸分離および精製市場において最大の貢献を果たしており、2024年の収益の52.1%を占め、2030年までに11.4%の成長軌道を描いています。この形式は、カオトロピック塩の存在下でDNAまたはRNAをシリカコーティングされたビーズに結合させ、磁気アシスト洗浄によって遠心分離を回避します。Cytivaのグアニジニウムチオシアネート化学などの製剤は、ヌクレアーゼを阻害しつつ高い回収率を確保することで、ワークフローの速度をさらに向上させます。カラムベースのキットは、抽出あたりのコストが低いため、手動設定で依然として使用されていますが、ハイスループットのラボでは採用が減少しています。
* 製品別:機器の成長
キットと試薬は2024年の売上の48.3%を占めており、診断および研究における定期的な補充サイクルを反映しています。しかし、機器の収益は、研究室が標準化を強化するロボット抽出装置に投資するため、11.8%のCAGRで最速で成長しています。Beckman CoulterのOptiMATE Gradient Makerは、超遠心分離を3日から6時間に短縮し、機器がウイルスベクターワークフローをいかに改善するかを示しています。分光光度計や蛍光光度計は、臨床シーケンシングに伴うより厳格な品質管理規則に対応しています。
* 用途別:microRNA分離の加速
ゲノムDNA精製は、2024年の核酸分離および精製市場シェアの20.6%を占めました。しかし、リキッドバイオプシーアッセイの採用拡大に伴い、microRNA抽出は最高の11.7%のCAGRを記録しています。ハイスループットマイクロ流体チップは、非小細胞肺がんをスクリーニングする7マーカーパネルで90%の感度を達成しており、短い断片を保存するキットが求められています。mRNA分離はワクチン成功後も関連性を維持しており、プラスミドDNAシステムは合成生物学のクローニングや遺伝子治療のシードストックに対応しています。
* エンドユーザー別:CROの拡大
製薬およびバイオテクノロジー企業は、ゲノムバイオマーカーを取り入れたパイプラインにより、2024年の支出の43.3%を占めました。しかし、受託研究機関(CRO)は、スポンサーが固定費を管理するために高複雑度抽出を外部委託するため、12.4%のCAGRで成長するでしょう。病院は、日常的なウイルス学および腫瘍学検査の安定した採用者であり、学術機関は、後に規制環境に移行するパイロットプロトコルを主導しています。
地域分析
* 北米: NIHが資金提供するトランスレーショナルゲノミクス、密集したバイオテクノロジー集積地、およびFDAが高リスクの体外診断薬をクラスIIに再分類し、承認期間を短縮したことにより、北米は2024年に核酸分離および精製市場の42.4%を維持しました。米国が売上を牽引し、カナダおよびメキシコのラボは国境を越えた臨床試験活動により地域の処理能力を拡大しています。
* 欧州: 欧州は、多国間研究を容易にする調和された規制枠組みに続いています。ドイツ、英国、フランスは、確立された製薬製造業に牽引された機器調達を主導しています。Wellcome Trustによる人口バイオバンキングへの資金提供は、コンソーシアムサイト全体でデータ整合性を確保する自動ビーズプラットフォームの需要を維持しています。
* アジア太平洋: アジア太平洋地域は、2030年までに世界最速の10.4%のCAGRを記録すると予測されています。中国の製薬政策は、国内の核酸医薬品生産を支援し、大規模な試薬注文を促進しています。インドの費用対効果の高い遺伝子治療イニシアチブは、柔軟なマイクロ流体キットの採用を奨励しています。日本と韓国は精密医療を重視しており、高純度、多分析物精製消耗品の需要を高めています。
競争環境
業界の統合は、主要企業がポートフォリオを拡大するにつれて続いています。Thermo Fisher Scientificは、Solventumの精製およびろ過部門を41億米ドルで買収し、上流の細胞培養清澄化と核酸クリーンアップを統合しています。DanaherはCytivaとPallを75億米ドルのバイオプロセスグループに統合し、現在、遺伝子治療ワークフロー全体でビーズ樹脂、カラム、自動機器をバンドルしています。
新興企業は、コスト削減を活用して価格に敏感なセグメントに参入しています。室温で動作する紙ベースのキットは、コールドチェーンを回避する周囲安定性化学物質を適用することで、フィールド診断の新たな市場を開拓しています。QIAGENは2024年に19.7億米ドルの収益を記録し、消耗品が売上の88%を占めており、市場の経常収益構造を示しています。ベンダーは、プロトコルライブラリを通じてユーザーを囲い込むためにクラウド連携ソフトウェアを組み込んでおり、CRISPR対応キットやポイントオブケアマイクロ流体モジュールは新たな差別化ポイントを生み出しています。
主要企業:
Thermo Fisher Scientific, Inc.、F. Hoffmann-La Roche AG、Agilent Technologies、Bio-Rad Laboratories Inc.、Merck KGaAなどが挙げられます。
最近の業界動向:
* 2025年6月: IlluminaがSomaLogicを3.5億米ドルで買収し、プロテオミクスを拡大し、マルチオミクスシーケンシングソリューションを統合。
* 2025年4月: QIAGENがQIAmini、QIAsymphony Connect、QIAsprint Connectの3つのサンプル前処理機器の計画を発表。
* 2025年4月: Beckman Coulter Life SciencesがOptiMATE Gradient Makerをリリースし、AAV精製を3日から6時間に短縮。
* 2025年3月: Beckman CoulterがRarity Bioscienceと提携し、リキッドバイオプシーワークフローにおける高感度変異検出のためのsuperRCAアッセイを販売。
* 2025年2月: Thermo Fisher ScientificがSolventumを41億米ドルで買収し、ろ過および精製資産を追加。
本レポートは、核酸の分離、定量、精製市場に関する詳細な調査結果をまとめたものです。
市場の定義と範囲
本調査における核酸分離、定量、精製市場は、スピンカラムキット、磁気ビーズプラットフォーム、専用試薬、小型分光光度計や蛍光光度計など、生体材料からDNAやRNAを抽出し、その収量や純度を確認し、臨床、研究、産業ラボでの下流作業にクリーンな分子を提供する製品およびサービスによって生み出される収益を対象としています。タンパク質やペプチドの精製消耗品、スタンドアロンシーケンサー、PCRサーマルサイクラー、サービス料金は含まれません。
エグゼクティブサマリー
市場規模は、2025年に55.9億米ドルに達し、2030年までに9.4%の年平均成長率(CAGR)で成長し、87.8億米ドルに達すると予測されています。技術別では、磁気ビーズベースの精製が2024年の収益の52.1%を占め、ラボの自動化との互換性から最も急速に拡大しています。用途別では、腫瘍学におけるリキッドバイオプシーの採用増加に伴う高感度なmicroRNA抽出の需要により、microRNA分離が2030年まで11.7%のCAGRで最も急速に成長しています。地域別では、中国、インド、日本、オーストラリアが精密医療プログラムを拡大していることから、アジア太平洋地域が10.4%のCAGRで最も急速な成長を遂げると予測されています。自動化は、ハンズオン時間とエラーを削減するため、磁気ビーズキットとソフトウェアガイドプロトコルを統合した機器への設備投資を促しています。
市場の推進要因
市場の成長を牽引する主な要因としては、臨床グレードの次世代シーケンシング(NGS)需要の急増、各国のゲノミクスイニシアチブ、分子生物学における研究開発資金の増加、ワークフローの自動化とハイスループットプラットフォームの普及、PoC(Point-of-Care)デバイス向けマイクロ流体抽出技術の進展、合成生物学およびCRISPRスクリーニングの活況が挙げられます。
市場の阻害要因
一方、市場の成長を阻害する要因としては、機器および試薬の高コスト、新興市場における普及率の低さ、樹脂およびシリカのサプライチェーンリスク、有害廃棄物処理規制の厳格化が挙げられます。特に新興市場では、高額な初期投資と限られたラボインフラが導入の障壁となっていますが、費用対効果の高い紙ベースや室温プロトコルがこれらの障壁を緩和しつつあります。
市場のセグメンテーション
本レポートでは、市場を以下の主要なセグメントに分けて詳細に分析しています。
* 技術別: カラムベース精製、磁気ビーズベース精製、試薬ベース精製。
* 製品別: キット&試薬(核酸分離・精製キット、核酸定量キット)、機器(核酸分離・精製装置、核酸定量装置:分光光度計、蛍光光度計)、その他の製品。
* 用途別: 全RNA分離・精製、mRNA分離・精製、microRNA分離・精製、プラスミドDNA分離・精製、ゲノムDNA分離・精製、血液DNA分離・精製、PCRクリーンアップ、バイオバンキング、臨床研究、法医学、医薬品開発、その他の用途。
* エンドユーザー別: 病院、学術機関、製薬・バイオテクノロジー産業、CRO(医薬品開発業務受託機関)。
* 地域別: 北米(米国、カナダ、メキシコ)、欧州(ドイツ、英国、フランス、イタリア、スペイン、その他欧州)、アジア太平洋(中国、日本、インド、オーストラリア、韓国、その他アジア太平洋)、中東・アフリカ(GCC、南アフリカ、その他中東・アフリカ)、南米(ブラジル、アルゼンチン、その他南米)。
競争環境
競争環境については、市場集中度、市場シェア分析、主要企業のプロファイル(Agilent Technologies、Illumina Inc.、QIAGEN、Bio-Rad Laboratories Inc.、Danaher Corp. (Beckman Coulter)、GE HealthCare、F. Hoffmann-La Roche Ltd、Merck KGaA、Thermo Fisher Scientific Inc.、Takara Holdings、Promega Corp.、Revvity (PerkinElmer)など20社)が含まれており、各社の概要、主要事業セグメント、財務状況、製品・サービス、最近の動向などが詳述されています。
調査方法
調査は、一次調査(ラボマネージャー、バイオファーマ調達責任者、主任研究者へのインタビュー)と二次調査(WHOゲノムサーベイランスダッシュボード、OECDバイオテクノロジー支出表、UN Comtrade HS-3002出荷記録、AACCおよびBIOのホワイトペーパー、Questel経由のビーズ化学特許ファミリー、PubMedメタ分析、D&B HooversおよびDow Jones Factiva経由のサプライヤー10-Kなど)を組み合わせたハイブリッド型のアプローチを採用しています。市場規模の算出と予測は、トップダウンとボトムアップの両ロジックを適用し、主要な推進要因、導入ベースの拡大、シーケンシングスループット、国家ゲノミクス資金、機器の平均販売価格(ASP)の進展などを考慮した多変量回帰分析に基づいています。データは二重分析レビュー、外部指標との差異チェック、四半期ごとの通貨監査を経て検証され、毎年更新されます。
市場の機会と将来の展望
市場の機会と将来の展望についても、未開拓分野や満たされていないニーズの評価を通じて分析されています。
1. はじめに
- 1.1 調査の前提と市場の定義
- 1.2 調査範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場概況
- 4.1 市場概要
- 4.2 市場の推進要因
- 4.2.1 臨床グレードNGS需要の急増
- 4.2.2 国家ゲノムイニシアチブ
- 4.2.3 分子生物学における研究開発資金の増加
- 4.2.4 ワークフロー自動化とハイスループットプラットフォーム
- 4.2.5 PoCデバイス向けマイクロ流体抽出
- 4.2.6 合成生物学とCRISPRスクリーニングのブーム
- 4.3 市場の阻害要因
- 4.3.1 高い機器と試薬のコスト
- 4.3.2 新興市場での低い浸透率
- 4.3.3 樹脂とシリカのサプライチェーンリスク
- 4.3.4 有害廃棄物処理規制の厳格化
- 4.4 規制環境
- 4.5 ポーターの5つの力分析
- 4.5.1 新規参入者の脅威
- 4.5.1.1 買い手の交渉力
- 4.5.1.2 供給者の交渉力
- 4.5.1.3 代替品の脅威
- 4.5.1.4 競争の激しさ
5. 市場規模と成長予測 (金額、米ドル)
- 5.1 技術別
- 5.1.1 カラムベース精製
- 5.1.2 磁気ビーズベース精製
- 5.1.3 試薬ベース精製
- 5.2 製品別
- 5.2.1 キット&試薬
- 5.2.1.1 核酸分離&精製キット
- 5.2.1.2 核酸定量キット
- 5.2.1.2.1 DNA定量キット
- 5.2.1.2.2 RNA定量キット
- 5.2.2 機器
- 5.2.2.1 核酸分離&精製装置
- 5.2.2.2 核酸定量装置
- 5.2.2.2.1 分光光度計
- 5.2.2.2.2 蛍光光度計
- 5.2.3 その他の製品
- 5.3 用途別
- 5.3.1 全RNA分離&精製
- 5.3.2 mRNA分離&精製
- 5.3.3 microRNA分離&精製
- 5.3.4 プラスミドDNA分離&精製
- 5.3.5 ゲノムDNA分離&精製
- 5.3.6 血液DNA分離&精製
- 5.3.7 PCRクリーンアップ
- 5.3.8 バイオバンキング
- 5.3.9 臨床研究
- 5.3.10 法医学
- 5.3.11 医薬品開発
- 5.3.12 その他の用途
- 5.4 エンドユーザー別
- 5.4.1 病院
- 5.4.2 学術機関
- 5.4.3 製薬・バイオテクノロジー産業
- 5.4.4 CRO
- 5.5 地域
- 5.5.1 北米
- 5.5.1.1 米国
- 5.5.1.2 カナダ
- 5.5.1.3 メキシコ
- 5.5.2 欧州
- 5.5.2.1 ドイツ
- 5.5.2.2 英国
- 5.5.2.3 フランス
- 5.5.2.4 イタリア
- 5.5.2.5 スペイン
- 5.5.2.6 その他の欧州
- 5.5.3 アジア太平洋
- 5.5.3.1 中国
- 5.5.3.2 日本
- 5.5.3.3 インド
- 5.5.3.4 オーストラリア
- 5.5.3.5 韓国
- 5.5.3.6 その他のアジア太平洋
- 5.5.4 中東&アフリカ
- 5.5.4.1 GCC
- 5.5.4.2 南アフリカ
- 5.5.4.3 その他の中東&アフリカ
- 5.5.5 南米
- 5.5.5.1 ブラジル
- 5.5.5.2 アルゼンチン
- 5.5.5.3 その他の南米
6. 競合情勢
- 6.1 市場集中度
- 6.2 市場シェア分析
- 6.3 企業プロファイル(グローバル概要、市場概要、主要事業セグメント、財務、従業員数、主要情報、市場順位、市場シェア、製品とサービス、および最近の動向の分析を含む)
- 6.3.1 Agilent Technologies
- 6.3.2 Illumina Inc.
- 6.3.3 QIAGEN
- 6.3.4 Bio-Rad Laboratories Inc.
- 6.3.5 Danaher Corp. (Beckman Coulter)
- 6.3.6 GE HealthCare
- 6.3.7 F. Hoffmann-La Roche Ltd
- 6.3.8 Merck KGaA
- 6.3.9 Thermo Fisher Scientific Inc.
- 6.3.10 Takara Holdings
- 6.3.11 Promega Corp.
- 6.3.12 Revvity (PerkinElmer)
- 6.3.13 BioVision Inc.
- 6.3.14 Zymo Research
- 6.3.15 New England Biolabs
- 6.3.16 Norgen Biotek Corp.
- 6.3.17 Omega Bio-tek
- 6.3.18 Analytik Jena
- 6.3.19 Sartorius AG
- 6.3.20 Aurora Biomed Inc.
7. 市場機会と将来展望
*** 本調査レポートに関するお問い合わせ ***

核酸分離・定量・精製は、生命科学研究や臨床診断の基盤となる技術であり、細胞や組織からデオキシリボ核酸(DNA)やリボ核酸(RNA)といった核酸分子を抽出し、その量や純度を測定し、さらに不純物を取り除いて高純度化する一連のプロセスを指します。「分離」は目的の核酸を他の成分(タンパク質、脂質など)から分けること、「定量」は分離された核酸の濃度や品質を測定すること、「精製」は残存する夾雑物を除去し、高純度な状態にすることを目的とします。これらの技術は、遺伝子解析、診断、創薬など、多岐にわたる分野で不可欠です。
核酸の分離・定量・精製には、目的に応じて様々な手法が用いられます。
核酸分離・抽出の主な方法には、有機溶媒抽出法(フェノール・クロロホルム法)、シリカゲル膜吸着法、磁気ビーズ法、アニオン交換樹脂法などがあります。有機溶媒抽出法は高純度な核酸が得られますが、シリカゲル膜吸着法や磁気ビーズ法は簡便性と効率性に優れ、全自動核酸抽出装置にも応用されています。
核酸定量の手法としては、核酸が260nmの紫外線に吸光する性質を利用する吸光度測定法、核酸に特異的な蛍光色素を用いる蛍光定量法などがあります。吸光度測定法は簡便ですが、タンパク質などの夾雑物も280nm付近に吸光するため、純度評価には260nm/280nm比や260nm/230nm比を用いる必要があります。一方、蛍光定量法は核酸に特異的に結合する色素を用いるため、夾雑物の影響を受けにくく、吸光度測定法よりも高感度で微量な核酸の定量に適しています。
核酸精製の方法としては、エタノール沈殿法、ゲルろ過法、アニオン交換クロマトグラフィーなどが挙げられます。エタノール沈殿法は、核酸を濃縮・脱塩する一般的な方法で、特にPCR後のプライマーダイマー除去やシーケンス反応前の精製によく用いられます。ゲルろ過法は、分子量に基づいて核酸を分離し、低分子の夾雑物(塩、未反応の試薬など)を除去するのに有効です。アニオン交換クロマトグラフィーは、核酸のリン酸骨格が持つ負電荷を利用して、高純度な核酸を得るために用いられ、特にプラスミドDNAの精製などで高い効果を発揮します。
これらの核酸分離・定量・精製技術は、PCR(ポリメラーゼ連鎖反応)、リアルタイムPCR、次世代シーケンシング(NGS)、マイクロアレイ解析、遺伝子クローニング、遺伝子編集(CRISPR/Cas9など)といった、現代の生命科学研究やバイオテクノロジーにおいて不可欠な前処理ステップとなります。正確で信頼性の高い実験結果を得るためには、高品質な核酸サンプルを準備することが極めて重要であり、目的に応じた適切な分離・定量・精製法の選択と実施が求められます。