バイオプロセスバリデーション市場 規模・シェア分析 – 成長トレンドと予測 (2025年~2030年)
バイオプロセスバリデーション市場レポートは、テストタイプ(溶出物試験サービス、微生物試験サービスなど)、プロセスコンポーネント(フィルターエレメントなど)、エンドユーザー(製薬・バイオテクノロジー企業など)、地域(北米、欧州、アジア太平洋、中東およびアフリカ、南米)によってセグメント化されています。市場予測は、金額(米ドル)で提供されます。

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
バイオプロセスバリデーション市場の概要
本報告書は、「バイオプロセスバリデーション市場規模およびシェア分析 – 成長トレンドと予測(2025年~2030年)」と題し、バイオプロセスバリデーション市場の現状と将来予測について詳細に分析しています。
市場規模と成長予測
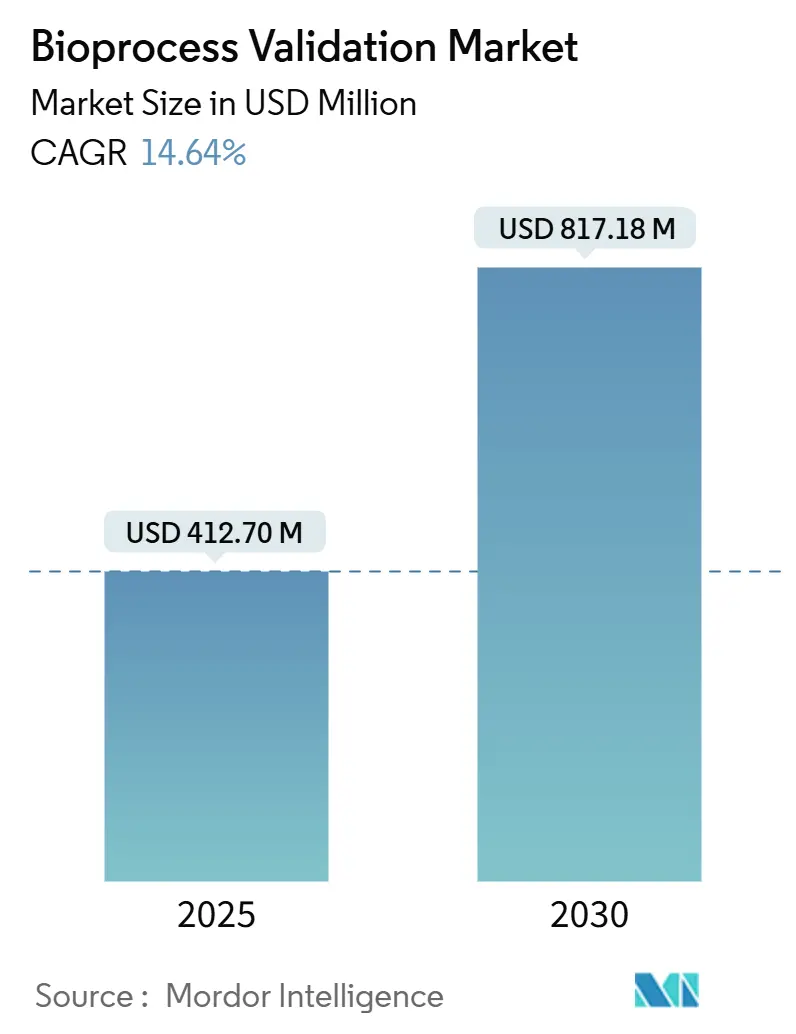
バイオプロセスバリデーション市場は、2025年には4億1,270万米ドルに達し、2030年には8億1,718万米ドルに成長すると予測されています。この期間における年平均成長率(CAGR)は14.64%と見込まれており、堅調な拡大が期待されます。
市場成長の主要因
市場の成長は、主に以下の3つの相互に関連する要因によって牽引されています。
1. 世界的に厳格化する規制ガイドライン: 米国食品医薬品局(FDA)や欧州医薬品庁(EMA)などの規制当局による、ウイルス安全性、分析手順、汚染管理に関する期待値の更新が、新たなコンプライアンス要件を生み出しています。
2. 商業用および臨床用バイオ医薬品の生産量増加: バイオ医薬品が全医薬品候補の約50%を占めるようになり、バリデーションが必要な施設、プロセス、分析手順の数が増加しています。
3. バリデーション作業のCDMO(医薬品開発製造受託機関)への着実な移行: コスト管理と専門知識へのアクセスを理由に、多くのバイオ医薬品メーカーがバリデーション活動の一部またはすべてをCDMOにアウトソーシングしています。
また、電子バッチ記録、データインテグリティチェックポイント、監査対応可能なデータトレイルを中心としたデジタルバリデーションフレームワークが、検査サイクルの短縮とコンプライアンス違反リスクの低減に貢献し、主要な差別化要因となっています。
主要な市場動向
本報告書における主要な分析結果は以下の通りです。
* テストタイプ別: 2024年には抽出物試験がバイオプロセスバリデーション市場シェアの38.43%を占め、最も大きな割合を占めました。一方、完全性試験は2030年まで16.45%のCAGRで拡大すると予測されています。
* プロセスコンポーネント別: 2024年にはフィルターエレメントがバイオプロセスバリデーション市場規模の26.53%を占めました。バイオリアクターは2025年から2030年の間に14.45%のCAGRで成長すると予測されています。
* エンドユーザー別: 2024年には製薬・バイオテクノロジー企業がバイオプロセスバリデーション市場シェアの57.54%を占めました。CDMOは2030年まで17.43%のCAGRで成長すると予測されています。
* 地域別: 2024年には北米がバイオプロセスバリデーション市場規模の48.65%を占めました。アジア太平洋地域は2030年まで15.76%のCAGRで最も速く成長する地域となる見込みです。
市場成長の推進要因の詳細
1. 世界的なバイオ医薬品生産量の拡大:
製造規模の拡大は、バイオプロセスバリデーション市場を牽引する重要な要因です。新しい生産ライン、施設、プロセス変更のたびに再認定が必要となります。例えば、Lonzaが2024年10月にRocheのVacaville工場を12億米ドルで買収し、生産能力を大幅に拡大したことは、バイオ医薬品製造におけるバリデーションの必要性を高める一例です。このような大規模な施設買収や新規建設は、プロセス、設備、洗浄、分析方法など、あらゆる側面での厳格なバリデーションを必要とします。これにより、製品の安全性、品質、有効性が保証され、規制要件が満たされるため、バイオプロセスバリデーション市場の成長を促進します。
2. 厳格化する規制要件と品質基準:
バイオ医薬品の製造には、患者の安全を確保するために極めて高い品質基準が求められます。FDA(米国食品医薬品局)、EMA(欧州医薬品庁)、PMDA(医薬品医療機器総合機構)などの規制当局は、製造プロセスの各段階におけるバリデーションを義務付けています。例えば、FDAのcGMP(現行の適正製造基準)ガイドラインは、製造プロセスの設計、実施、文書化、および変更管理において、厳格なバリデーションの実施を求めています。これらの規制要件は、バイオ医薬品メーカーが製品の品質と安全性を保証するために、継続的にバリデーション活動に投資することを促し、市場の成長を後押ししています。
3. バイオシミラーおよびバイオ後続品の台頭:
特許切れを迎えるオリジナルバイオ医薬品が増加するにつれて、バイオシミラーおよびバイオ後続品の開発と製造が活発化しています。これらの製品は、参照製品と同等の品質、安全性、有効性を持つことを証明するために、広範な比較バリデーション研究を必要とします。例えば、参照製品との同等性を示すためには、製造プロセスの堅牢性、不純物プロファイル、安定性などを詳細に評価し、バリデーションを行う必要があります。この需要の増加は、バイオプロセスバリデーション市場に新たな機会をもたらしています。
市場成長の抑制要因の詳細
1. 高コストと時間のかかるプロセス:
バイオプロセスバリデーションは、専門的な知識、高度な技術、および多大なリソースを必要とするため、非常に高コストで時間のかかるプロセスです。バリデーション計画の策定、試験の実施、データの収集と分析、文書化には、熟練した人材と専用の設備が必要です。特に中小規模のバイオテクノロジー企業やスタートアップ企業にとって、これらのコストは大きな負担となり、市場参入の障壁となる可能性があります。また、バリデーションプロセスの遅延は、製品の上市を遅らせ、収益機会を逸失するリスクも伴います。
2. 熟練した専門家の不足:
バイオプロセスバリデーションは、微生物学、化学、工学、統計学、規制科学など、多岐にわたる専門知識を必要とします。しかし、これらの分野を横断的に理解し、バリデーションプロセス全体を管理できる熟練した専門家は限られています。特に、新しい技術や複雑なバイオ医薬品のバリデーションに対応できる人材の不足は深刻です。この人材不足は、バリデーション活動の効率性を低下させ、品質管理上の課題を引き起こす可能性があり、市場の成長を抑制する要因となっています。
市場機会の詳細
1. シングルユース技術の採用拡大:
シングルユース(使い捨て)技術は、バイオ医薬品製造において、洗浄・滅菌プロセスの必要性を排除し、クロスコンタミネーションのリスクを低減することで、効率性と柔軟性を向上させます。バイオリアクター、ミキシングバッグ、フィルターなどのシングルユースコンポーネントの採用が拡大するにつれて、これらの製品のバリデーションに対する需要も増加しています。シングルユースシステムは、従来の再利用可能なシステムとは異なるバリデーションアプローチを必要とし、特に抽出物・溶出物(E&L)試験や完全性試験が重要となります。この技術革新は、バイオプロセスバリデーション市場に新たな成長機会をもたらしています。
2. 細胞・遺伝子治療薬の台頭:
細胞治療薬や遺伝子治療薬といった先進医療製品(ATMP)は、個別化医療の進展とともに急速に発展しています。これらの治療薬は、従来のバイオ医薬品とは異なる複雑な製造プロセスを持ち、独自のバリデーション課題を抱えています。例えば、生細胞やウイルスベクターの取り扱い、小規模バッチ生産、迅速な製造サイクルなどに対応するための特殊なバリデーション戦略が求められます。ATMP市場の拡大は、これらの革新的な治療法に特化したバイオプロセスバリデーションサービスおよびソリューションに対する新たな需要を生み出し、市場の大きな成長ドライバーとなるでしょう。
3. デジタル化と自動化の進展:
インダストリー4.0の概念が製造業全体に浸透する中で、バイオ医薬品製造においてもデジタル化と自動化が進んでいます。データインテグリティ、電子記録、プロセス分析技術(PAT)、リアルタイムモニタリングなどの導入は、バリデーションプロセスの効率化と信頼性向上に貢献します。例えば、センサー技術とデータ分析を組み合わせることで、製造プロセスの重要なパラメータを継続的に監視し、バリデーションデータを自動的に収集・解析することが可能になります。これにより、手作業によるエラーを減らし、バリデーションサイクルを短縮できるため、デジタルソリューションを提供する企業にとって新たな市場機会が生まれています。
市場の課題の詳細
1. 規制環境の複雑さと変化:
バイオ医薬品の規制環境は、地域や製品の種類によって異なり、常に進化しています。新しい技術や治療法が登場するたびに、規制当局は新たなガイドラインや要件を導入するため、企業はこれらの変化に継続的に対応する必要があります。例えば、細胞・遺伝子治療薬のような革新的な製品に対する規制はまだ発展途上にあり、バリデーション戦略を策定する上で不確実性が伴います。この複雑で変化の激しい規制環境は、企業がバリデーションプロセスを計画・実行する上での大きな課題となり、専門知識とリソースの追加的な投資を必要とします。
2. サプライチェーンの複雑性:
バイオ医薬品の製造には、多様な原材料、中間体、コンポーネントが世界中のサプライヤーから調達されます。これらのサプライチェーンは複雑であり、各サプライヤーの品質管理システムや製造プロセスのバリデーション状況を評価・管理することは大きな課題です。原材料の品質変動やサプライヤーの変更は、最終製品の品質に影響を与える可能性があり、追加的なバリデーション作業を必要とします。特に、グローバルなサプライチェーンにおけるトレーサビリティの確保と、各段階での品質保証は、バイオプロセスバリデーション市場における重要な課題の一つです。
バイオプロセスバリデーション市場レポート概要
本レポートは、バイオプロセスバリデーション市場に関する詳細な分析を提供しています。バイオプロセスバリデーションとは、バイオ医薬品製造ラインが安全で規制に準拠したバッチを繰り返し生産できることを確認するための、文書化された試験および認定サービスや製品を指します。これには、フィルターの完全性チェックからウイルス除去レポートまで幅広い活動が含まれますが、パイロットスケールでの学術研究やソフトウェアのみの品質保証ツールは対象外です。
調査方法論
調査は、北米、欧州、アジアの製薬会社、CDMO(医薬品受託開発製造機関)、規制当局、シングルユース機器サプライヤーへのインタビューを含む一次調査と、FDA、EMA、PMDAなどの公的規制文書、WHO、BioProcess Internationalの記事、企業財務報告書などの二次調査を組み合わせて実施されました。市場規模の算出と予測は、生物製剤の生産量、規制検査数、1リットルあたりの平均バリデーション費用に基づいたトップダウンアプローチと、主要サービスプロバイダーのボトムアップ集計を照合することで行われました。データは毎年更新され、厳格な検証プロセスを経て信頼性を確保しています。
市場概要と予測
バイオプロセスバリデーション市場は、2025年には4億1,270万米ドルの価値があり、2030年までに8億1,718万米ドルに成長すると予測されています。これは、年平均成長率(CAGR)で堅調な拡大を示すものです。
市場の推進要因
市場成長の主な推進要因としては、以下の点が挙げられます。
1. 世界的なバイオ医薬品生産量の拡大。
2. 厳格な規制遵守要件の増加。
3. CDMOへのバリデーションサービスのアウトソーシングの増加。
4. 統合された連続生産ラインへの移行。
5. 高度なプロセス分析技術(PAT)ツールの採用。
6. データ駆動型ライフサイクルバリデーションフレームワークの登場。
市場の抑制要因
一方で、市場の成長を抑制する要因も存在します。
1. バリデーション試験の高額な設備投資および運用コスト。
2. 抽出物および溶出物(E&L)評価の複雑さ。
3. 熟練したバリデーション人材の不足。
4. デジタルバリデーションにおけるデータ整合性およびサイバーセキュリティの課題。
セグメンテーション別の主要トレンド
* 試験タイプ別: 抽出物試験サービスが2024年の収益の38.43%を占め、最大のシェアを保持しています。これは、シングルユースシステムの採用と患者の安全性に対する規制の焦点によって推進されています。その他、微生物試験、物理化学試験、完全性試験、適合性試験などが含まれます。
* プロセスコンポーネント別: フィルターエレメント、培地コンテナ&バッグ、凍結・解凍プロセスバッグ、混合システム、バイオリアクター、移送システムなどが分析対象です。
* エンドユーザー別: CDMOは、製薬会社がコスト削減と専門知識を求めてバリデーションをアウトソーシングする傾向にあるため、2030年までに17.43%のCAGRで最も速い成長を遂げると予測されています。製薬・バイオテクノロジー企業も主要なエンドユーザーです。
* 地域別: アジア太平洋地域は、中国とインドにおける生産能力の増強と、グローバルなGMP基準への適合が進んでいることから、15.76%のCAGRで最も急速に拡大しています。北米と欧州も主要な市場です。
規制および技術的影響
FDAおよびEMAの更新されたガイダンスは、ウイルス安全性、分析方法、汚染管理に関するより厳格な要件を追加し、バリデーション研究の量と複雑さを増大させています。また、リアルタイム分光法、デジタルツイン、機械学習モデルなどのプロセス分析技術(PAT)ツールは、継続的なモニタリングを可能にし、製品リリースまでの時間を短縮するなど、バリデーション手法を変革しています。
競争環境
市場には、Merck KGaA、SGS S.A.、Eurofins Scientific、Sartorius AG、Pall Corporation、Thermo Fisher Scientific、Lonza Group、Charles River Laboratories、Catalent Inc.、Cytiva、Intertek Groupなど、多数の主要企業が存在し、市場集中度と市場シェア分析が行われています。
市場機会と将来展望
レポートでは、未開拓の領域や満たされていないニーズの評価を通じて、将来の市場機会についても言及されています。
1. はじめに
- 1.1 調査の前提と市場の定義
- 1.2 調査範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場の状況
- 4.1 市場概要
- 4.2 市場の推進要因
- 4.2.1 世界的なバイオ医薬品生産量の拡大
- 4.2.2 厳格な規制遵守要件
- 4.2.3 CDMOへのバリデーションサービスのアウトソーシングの増加
- 4.2.4 統合された連続生産ラインへの移行
- 4.2.5 高度なプロセス分析技術ツールの採用
- 4.2.6 データ駆動型ライフサイクルバリデーションフレームワークの出現
- 4.3 市場の阻害要因
- 4.3.1 バリデーションテストの高い設備投資および運用コスト
- 4.3.2 抽出物および溶出物評価の複雑さ
- 4.3.3 熟練したバリデーション人材の不足
- 4.3.4 デジタルバリデーションにおけるデータインテグリティとサイバーセキュリティの課題
- 4.4 規制環境
- 4.5 ポーターの5つの力分析
- 4.5.1 新規参入者の脅威
- 4.5.2 買い手の交渉力
- 4.5.3 供給者の交渉力
- 4.5.4 代替品の脅威
- 4.5.5 競争の激しさ
5. 市場規模と成長予測 (金額、米ドル)
- 5.1 テストタイプ別
- 5.1.1 抽出物試験サービス
- 5.1.2 微生物試験サービス
- 5.1.3 物理化学試験サービス
- 5.1.4 完全性試験サービス
- 5.1.5 適合性試験サービス
- 5.1.6 その他の試験サービス
- 5.2 プロセスコンポーネント別
- 5.2.1 フィルターエレメント
- 5.2.2 培地容器およびバッグ
- 5.2.3 凍結・解凍プロセスバッグ
- 5.2.4 混合システム
- 5.2.5 バイオリアクター
- 5.2.6 移送システム
- 5.2.7 その他のプロセスコンポーネント
- 5.3 エンドユーザー別
- 5.3.1 製薬・バイオテクノロジー企業
- 5.3.2 医薬品開発製造受託機関
- 5.3.3 その他のエンドユーザー
- 5.4 地域
- 5.4.1 北米
- 5.4.1.1 米国
- 5.4.1.2 カナダ
- 5.4.1.3 メキシコ
- 5.4.2 ヨーロッパ
- 5.4.2.1 ドイツ
- 5.4.2.2 イギリス
- 5.4.2.3 フランス
- 5.4.2.4 イタリア
- 5.4.2.5 スペイン
- 5.4.2.6 その他のヨーロッパ
- 5.4.3 アジア太平洋
- 5.4.3.1 中国
- 5.4.3.2 日本
- 5.4.3.3 インド
- 5.4.3.4 オーストラリア
- 5.4.3.5 韓国
- 5.4.3.6 その他のアジア太平洋
- 5.4.4 中東およびアフリカ
- 5.4.4.1 GCC
- 5.4.4.2 南アフリカ
- 5.4.4.3 その他の中東およびアフリカ
- 5.4.5 南米
- 5.4.5.1 ブラジル
- 5.4.5.2 アルゼンチン
- 5.4.5.3 その他の南米
6. 競合状況
- 6.1 市場集中度
- 6.2 市場シェア分析
- 6.3 企業プロファイル(グローバル概要、市場概要、主要事業セグメント、財務、従業員数、主要情報、市場順位、市場シェア、製品およびサービス、最近の動向分析を含む)
- 6.3.1 Merck KGaA
- 6.3.2 SGS S.A.
- 6.3.3 Eurofins Scientific
- 6.3.4 Sartorius AG
- 6.3.5 Pall Corporation
- 6.3.6 Thermo Fisher Scientific
- 6.3.7 Lonza Group
- 6.3.8 Charles River Laboratories
- 6.3.9 Catalent Inc.
- 6.3.10 Cytiva
- 6.3.11 Intertek Group
- 6.3.12 Element (VR Analytical)
- 6.3.13 Aizon
- 6.3.14 ValGenesis
- 6.3.15 Cobetter Filtration Equipments
- 6.3.16 DOC S.r.l
- 6.3.17 Meissner Filtration Products
- 6.3.18 Almac Group
- 6.3.19 Labcorp
- 6.3.20 Cytiva Fast-Trak Services
- 6.3.21 US Validation
7. 市場機会 & 将来展望
*** 本調査レポートに関するお問い合わせ ***

バイオプロセスバリデーションとは、医薬品、特にバイオ医薬品の製造プロセスが、常に意図した品質基準を満たす製品を一貫して生産できることを、科学的かつ文書的に証明する体系的な活動でございます。これは、医薬品の品質、安全性、有効性を保証するために不可欠であり、各国の規制当局が定めるGMP(Good Manufacturing Practice:医薬品の製造管理および品質管理に関する基準)要件の中核をなすものでございます。単に製造工程を検証するだけでなく、プロセス設計の段階からリスク評価を行い、適切な管理戦略を確立し、その有効性を継続的に監視・評価する包括的なアプローチを指します。患者様への安全な医薬品の提供、そして企業の信頼性維持のために、極めて重要な役割を担っております。
バイオプロセスバリデーションには、その目的と対象に応じていくつかの種類がございます。まず、最も広範な「プロセスバリデーション」は、製造プロセス全体が意図した通りに機能し、一貫して高品質な製品を生産できることを確認するもので、通常、製造開始前に実施される「予測的バリデーション」が主流でございます。製造と並行して実施する「同時バリデーション」や、過去のデータに基づいて評価する「回顧的バリデーション」も存在しますが、後者は現在では限定的な適用に留まります。次に、「洗浄バリデーション」は、製造設備が適切に洗浄され、前バッチの残留物や洗浄剤が許容レベル以下であることを証明し、交差汚染のリスクを排除するために行われます。「滅菌バリデーション」は、無菌製品の製造において、滅菌プロセスが微生物を確実に除去または不活性化できることを検証するもので、無菌性の保証に不可欠です。また、製品の品質管理に使用される分析法が、目的とする用途に適していることを確認する「分析法バリデーション」も重要であり、特異性、直線性、正確性、真度、検出限界、定量限界などの項目が評価されます。さらに、製造、品質管理、データ管理に使用されるコンピュータシステムが、意図した通りに機能し、データの完全性を保証することを確認する「コンピュータシステムバリデーション(CSV)」も、現代の医薬品製造においては欠かせない要素でございます。これらに加え、製造設備が適切に設計、設置、稼働し、性能を発揮することを確認する「設備適格性評価(DQ, IQ, OQ, PQ)」も、バリデーション活動の重要な一部でございます。
バイオプロセスバリデーションの用途と重要性は多岐にわたります。最も重要なのは、患者様の安全確保でございます。不純物、微生物汚染、有効成分の不足といったリスクを排除し、安全で有効な医薬品を安定的に供給することを可能にします。これにより、製品の品質が保証され、一貫した品質の製品を市場に提供することができます。また、各国の規制当局が定めるGMP要件への適合は、医薬品の承認取得および維持のために不可欠であり、バリデーションはその主要な要件の一つでございます。適切にバリデーションされたプロセスは、製造効率の向上とコスト削減にも寄与します。プロセスの最適化により不良品率が低減し、再作業や製品リコールといった事態を回避できるため、結果として経済的なメリットも生まれます。さらに、製造プロセスにおける潜在的なリスクを特定し、適切な管理策を導入することで、リスク管理体制を強化することも可能でございます。これらの活動を通じて、企業は高品質な製品を提供し、市場における競争力を強化し、信頼性を高めることができるのです。
バイオプロセスバリデーションは、様々な関連技術や概念と密接に連携しております。その一つが「品質バイデザイン(Quality by Design, QbD)」でございます。これは、製品とプロセスの理解を深め、品質を設計段階から組み込むアプローチであり、バリデーションの基盤となります。QbDの導入により、より科学的根拠に基づいた効率的なバリデーションが可能になります。また、「プロセス分析技術(Process Analytical Technology, PAT)」は、製造プロセスをリアルタイムで監視・制御する技術であり、バリデーションの継続的な検証に大きく貢献します。PATにより、プロセスの変動を早期に検知し、品質への影響を最小限に抑えることが可能になります。「リスクベースドアプローチ」は、リスク評価に基づいてバリデーションの範囲と深度を決定する手法であり、限られたリソースの中で効率的かつ効果的なバリデーションを実現します。データの正確性、完全性、一貫性、信頼性を確保する「データインテグリティ」は、特にコンピュータシステムバリデーションと密接に関連し、規制当局が近年特に重視している概念でございます。バイオ医薬品製造で普及が進む「シングルユース技術」は、使い捨て機器の利用により洗浄バリデーションの負担を軽減しますが、一方で抽出物・溶出物(E&L)の評価が新たなバリデーション課題となります。さらに、バッチ生産から「連続生産」への移行は、バリデーションのアプローチを大きく変化させ、リアルタイムリリース試験などとの連携が求められます。
市場背景としましては、バイオ医薬品市場の急速な拡大が挙げられます。モノクローナル抗体、遺伝子治療薬、細胞治療薬といった新しいモダリティの登場と成長により、バイオプロセスバリデーションの重要性はかつてないほど高まっております。バイオ医薬品の製造プロセスは、化学合成医薬品に比べて複雑で、微生物培養や細胞培養といった生物学的プロセスを含むため、変動要因が多く、より厳格なバリデーションが求められます。また、各国の規制当局は、バイオ医薬品の品質と安全に対する要求を年々厳しくしており、これに対応するためのバリデーション活動は、製薬企業にとって大きな課題となっております。医薬品のグローバル化が進む中で、世界中で製品を流通させるためには、国際的な規制調和と各国の要件への対応が不可欠です。近年では、多くの製薬企業が製造を外部の専門機関であるCDMO(Contract Development and Manufacturing Organization)に委託する傾向にあり、CDMOにおける高度なバリデーション能力が、企業選定の重要な要素となっております。
将来展望としましては、バイオプロセスバリデーションは、より高度化、効率化、そして継続的なアプローチへと進化していくことが予想されます。その中心となるのが「継続的プロセス検証(Continuous Process Verification, CPV)」でございます。これは、バリデーションを一度きりの活動ではなく、製品ライフサイクル全体にわたる継続的な監視と評価へと移行させるもので、QbDやPATとの連携が鍵となります。これにより、プロセスの状態を常に最適に保ち、リアルタイムでの品質保証を目指します。また、ビッグデータ解析、AI(人工知能)、機械学習の活用が、プロセスデータの解析、リスク予測、最適化に導入され、バリデーションの効率と精度を飛躍的に向上させることが期待されます。バリデーション文書の電子化、自動データ収集、電子署名といった「デジタル化と自動化」も進み、作業の効率化とデータインテグリティの強化に貢献するでしょう。さらに、遺伝子治療、細胞治療、再生医療製品といった「新しいモダリティへの対応」は、従来のバイオ医薬品とは異なる特性を持つため、これらに特化したバリデーション手法の確立が喫緊の課題でございます。環境負荷の低いプロセス設計や、資源効率の良いバリデーション手法の導入といった「サステナビリティへの貢献」も、今後の重要なテーマとなるでしょう。これらの進化を支えるためには、高度な専門知識と経験を持つバリデーション専門家の育成が不可欠であり、人材育成も重要な課題として認識されております。