癌ワクチン市場 規模・シェア分析、成長動向と予測 (2025年~2030年)
がんワクチン市場は、技術(組み換えワクチンなど)、治療法(予防ワクチン、治療用ワクチン)、がんの種類(子宮頸がん(HPV)、メラノーマなど)、投与経路(筋肉内、静脈内など)、および地域(北米、欧州、アジア太平洋など)によってセグメント化されています。市場規模と予測は金額(米ドル)で提供されます。

| 予防ワクチンは、健康な人々に対してがんを予防することを目的としたもので、感染因子を防ぐことで機能します。これらのワクチンは、ポリオや麻疹などの感染症予防に使用される従来のワクチンと似た仕組みを持ち、抗体を生成して感染を防ぎます。また、早期診断の重要性も市場の成長を促進しており、中国では子宮頸がんの検診率を向上させ、ヒトパピローマウイルス(HPV)ワクチンの普及を目指しています。このような背景から、予防ワクチン市場は今後大きな成長が見込まれています。 日本では、がん患者数の増加、がんワクチンの臨床試験の開始、早期診断に対する関心の高まりなどにより、高成長が期待されています。Globocan社のデータによれば、2025年には日本におけるがん患者数が107万8,000人に達し、2030年には110万人、2040年には112万8,000人に増加する見込みです。さらに、新たなワクチン開発が市場の成長を促進すると期待されています。 アジア太平洋地域のがんワクチン市場は激しい競争が展開されており、多くの企業が参入しています。主要な企業には、Astellas Pharma、AstraZeneca、GlaxoSmithKline、Daiichi Sankyo、Serum Institute、Eli Lilly、Merck、Pfizer、Sanofi、Bristol-Myers Squibbなどがあります。これらの企業は新製品を発表し、市場の発展に寄与しています。 近年のニュースとしては、2023年に韓国のGenexine社が進行子宮頸がん治療のための新規DNAワクチンGX-188Eを開発し、ファストトラック指定を受けたことや、2022年にインド政府が4価HPVワクチンを発売したことが挙げられます。これにより、がんワクチンの普及が進むことが期待されています。 アジア太平洋地域のがんワクチン市場は、技術別(遺伝子組換え、全細胞、ウイルスベクターおよびDNAワクチンなど)、治療法別(予防ワクチン、治療用ワクチン)、用途別(前立腺がん、子宮頸がんなど)、地域別(中国、日本、インド、オーストラリア、韓国など)に分類されており、今後の成長が見込まれます。 市場の規模は2025年に26.1億米ドルに達し、2030年には45.1億米ドルに成長すると予測されており、主要なプレーヤーとしてはGlaxoSmithKline、Bristol-Myers Squibb、Sanofi、Eli Lilly、AstraZenecaが挙げられます。今後の動向としては、技術革新と新薬の開発が市場拡大に寄与することが期待されています。 |
*** 本調査レポートに関するお問い合わせ ***
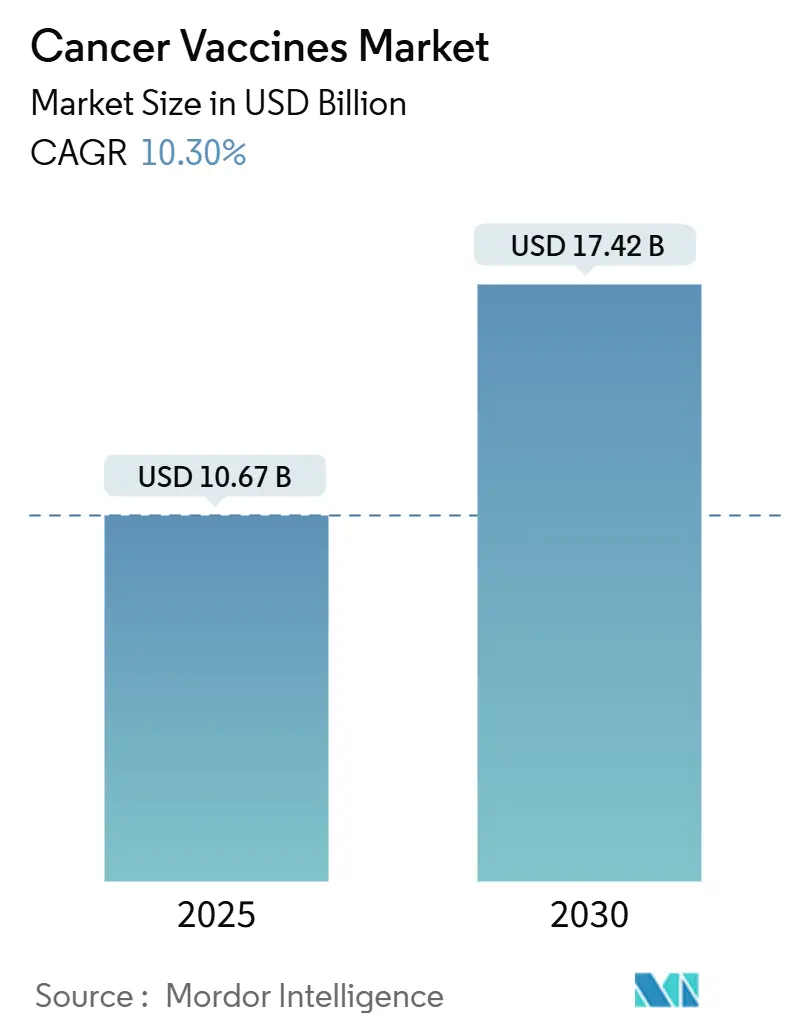
がんワクチン市場は、2025年には106.7億米ドルに達し、2030年までに174.2億米ドルに成長すると予測されており、2025年から2030年の予測期間中に年平均成長率(CAGR)10.30%で拡大する見込みです。この加速的な成長は、従来の予防法から、患者固有のネオアンチゲンをコードする個別化されたmRNAベースの免疫療法への転換を反映しています。これは、人工知能(AI)による抗原予測と、スケールアップサイクルを短縮するモジュール式マイクロファクトリー製造によって支えられています。FDAの画期的な医薬品指定やEMAのPRIME承認に見られる規制の調和は、国境を越えた治験の摩擦を軽減し、パートナーシップを重視したビジネスモデルは、単独製品ではなくプラットフォームの差別化に資本を集中させています。北米が引き続き市場をリードしていますが、アジア太平洋地域は中国の開発者が欧米の99%低いコストでmRNAワクチンを提供しているため、最も急速な成長を示しています。
市場概要
* 調査期間:2019年~2030年
* 市場規模(2025年):106.7億米ドル
* 市場規模(2030年):174.2億米ドル
* 成長率(2025年~2030年):CAGR 10.30%
* 最も急速に成長する市場:アジア太平洋
* 最大の市場:北米
* 市場集中度:高い
主要なレポートのポイント
* 技術別: 2024年には組換えワクチンが収益シェアの43.33%を占めましたが、mRNA/ネオアンチゲンプラットフォームは2030年までにCAGR 11.21%で拡大すると予測されています。
* 治療法別: 2024年には予防ワクチンががんワクチン市場シェアの90.23%を占めましたが、治療用ワクチンは2030年までにCAGR 11.43%で最も高い成長率を記録すると予測されています。
* がん種別: 2024年には子宮頸がんががんワクチン市場規模の72.21%を占めましたが、メラノーマは2030年までにCAGR 11.02%で成長しています。
* 投与経路別: 2024年には筋肉内投与ががんワクチン市場規模の65.78%を占めましたが、静脈内投与は2030年までにCAGR 11.12%で成長しています。
* 地域別: 2024年には北米ががんワクチン市場シェアの46.21%を占めましたが、アジア太平洋地域は2030年までにCAGR 11.38%で成長すると予測されています。
世界のがんワクチン市場のトレンドと洞察
市場の成長要因
* 世界的ながん罹患率の増加: 2020年から2040年の間にがん診断数は47%増加すると予測されており、特に包括的な腫瘍学インフラが不足している地域で急増が見込まれます。高齢化社会はより高い変異負荷をもたらし、早期診断の実践は個別化された免疫療法の対象となる患者プールを拡大します。外来患者に優しいワクチン療法は、入院による腫瘍治療からの移行と一致し、高所得市場で患者一人当たり15万米ドルを超える可能性のあるシステムコストを削減します。保険者は、長期にわたる全身療法と比較して、ワクチンをコスト抑制ツールと見なしています。
* 研究開発投資と政府資金の増加: 官民パートナーシップの構造は、従来の助成金に取って代わり、リスクを共有し、タイムラインを短縮しています。CEPIのCMCフレームワークは、がんワクチン製造の品質基準を指導し、多国籍での申請を円滑にしています。欧州でのがん技術に関する特許申請は70%以上増加し、大学が占める割合も増加しており、共同イノベーションの勢いを示しています。英国のBioNTechプログラムは、2030年までに1万人の患者に個別化ワクチンを提供することを約束しており、国家医療システムが商業化経路に直接投資する方法を示しています。
* mRNAおよびネオアンチゲンプラットフォームの進歩: 産業規模のmRNA製造は、従来の技術で18ヶ月かかっていた患者固有のロットを、腫瘍シーケンシングから6~8週間以内に生産できるようになりました。脂質ナノ粒子は80%以上の正確なHLAクラスI提示を達成し、AI対応のネオアンチゲンマッピングは偽陽性を60%削減します。自己増幅型mRNAは必要用量を10分の1に減らし、供給制約とコールドチェーンの負担を軽減します。共有ネオアンチゲンアトラスは現在、15のSNVと55のInDelホットスポットをカバーしており、いくつかの固形腫瘍に対する既製のワクチンへの道を開いています。
* AI駆動型抗原予測によるコスト削減: 自動化されたパイプラインは、HLA結合予測の精度を90%以上に高めながら、発見費用を75%削減します。AIネイティブなバイオテクノロジー企業への資金流入は、高精度免疫ゲノミクスの民主化を示しています。下流では、AI最適化されたmRNA配列は精製ステップを減らし、保存期間を延ばし、物流コストを削減します。統合されたプロテオゲノミクスワークフローは、全腫瘍抗原マップを提供し、臨床試験の中止率を低減します。
市場の抑制要因
* 厳格な規制のタイムラインと複雑さ: 個別化されたバッチリリースプロトコルとAIアルゴリズムの検証は、標準的なバイオ医薬品よりも承認サイクルを18~24ヶ月延長します。グローバルな規制チームを持たない中小企業は、EMAのPRIMEが臨床データが成熟すれば迅速な承認を与えるにもかかわらず、不均衡な負担に直面します。AIモデルの透明性に関する共通基準の欠如は、審査プロセスをさらに不明瞭にし、利益を侵食するコンプライアンスコストを増加させます。
* 代替免疫療法の利用可能性: ブロックバスターのチェックポイント阻害剤は2024年に250億米ドルの売上を記録し、新しいワクチンが補完または凌駕しなければならない確立された臨床経路を作り出しています。二重特異性抗体や次世代CAR-Tソリューションは、迅速な腫瘍縮小をもたらし、腫瘍医に即座に測定可能な反応を示す治療法を優先するよう促します。固形腫瘍におけるCAR-Tの安全性プロファイルが改善するにつれて、治療用ワクチンは、保険者や臨床医を納得させるために、持続性と低い毒性に関する主張を確立する必要があります。
セグメント分析
* 技術別* mRNAワクチン: COVID-19パンデミックでその有効性と迅速な開発能力が実証されたmRNA技術は、治療用ワクチン市場において最も有望なセグメントの一つとして浮上しています。その柔軟性により、複数の抗原を標的とすることが可能であり、個別化されたがんワクチンや、変異株に対応する感染症ワクチンへの応用が期待されています。主要な製薬会社やバイオテクノロジー企業が、がん、自己免疫疾患、慢性感染症に対するmRNA治療用ワクチンの臨床開発に多額の投資を行っており、今後数年間で市場シェアを大幅に拡大すると予測されます。
* ウイルスベクターワクチン: アデノウイルス、MVA(改変ワクシニアアンカラ)、レンチウイルスなどのウイルスベクターを利用したワクチンは、強力な細胞性免疫応答を誘導する能力で知られています。これらは、がん治療やHIV、マラリアなどの慢性感染症に対する治療用ワクチンにおいて、長年にわたり研究されてきました。既存の承認されたがん治療薬(例:オンコリティックウイルス)や、エボラ出血熱ワクチンでの成功事例があり、安定した市場基盤を維持しています。しかし、既存の免疫や製造の複雑さが課題となる場合があります。
* ペプチド/タンパク質ベースワクチン: 伝統的なアプローチであるペプチドおよびタンパク質ベースのワクチンは、特定の腫瘍関連抗原(TAA)や病原体抗原を標的とします。これらは一般的に良好な安全性プロファイルを示しますが、強力で持続的な免疫応答を誘導するためには、適切なアジュバントとの併用が不可欠です。製造が比較的容易であるため、コスト効率の良い選択肢となり得ますが、免疫原性の最適化と、多様な患者集団における有効性の確保が継続的な課題です。
* 樹状細胞(DC)ワクチン: 患者自身の樹状細胞を体外で活性化・抗原提示させ、体内に戻す個別化された細胞療法です。前立腺がん治療薬Sipuleucel-Tが唯一の承認例であり、その概念実証を示しました。非常に個別化されたアプローチであるため、高い特異性を持つ一方で、製造プロセスが複雑で高コストであるため、広範な普及には限界があります。しかし、難治性のがん種に対する可能性は依然として高く、製造効率の改善とコスト削減が今後の鍵となります。
* DNAワクチン: プラスミドDNAを用いて抗原遺伝子を直接細胞に導入し、体内で抗原タンパク質を発現させることで免疫応答を誘導します。安定性が高く、製造が比較的容易であるという利点がありますが、ヒトにおける免疫原性が低いという課題に直面してきました。エレクトロポレーションなどの送達技術の進歩により、その有効性が向上する可能性があり、特に長期的な免疫応答が必要な慢性感染症やがん治療において研究が続けられています。
* 適応症別
* がん: 治療用ワクチン市場の最大のセグメントであり、今後も最も急速に成長すると予測されています。個別化医療の進展、免疫チェックポイント阻害剤との併用療法の研究、および新規抗原(ネオアンチゲン)を標的とする技術の進化が、このセグメントを牽引しています。固形腫瘍(メラノーマ、肺がん、乳がんなど)および血液がんの両方で、多様な臨床試験が進行中です。
* 感染症: HIV、B型肝炎、C型肝炎、ヒトパピローマウイルス(HPV)、結核、およびその他の慢性ウイルス感染症に対する治療用ワクチンが含まれます。これらのワクチンは、既存の抗ウイルス薬では根絶が困難な病原体を排除し、患者の免疫系を強化することを目的としています。特に、薬剤耐性菌や新興感染症に対する治療選択肢としての期待が高まっています。
* 自己免疫疾患: 多発性硬化症、関節リウマチ、1型糖尿病などの自己免疫疾患に対する治療用ワクチンは、疾患特異的な免疫応答を誘導し、自己反応性T細胞を抑制することで、疾患の進行を遅らせたり、症状を軽減したりすることを目指しています。この分野はまだ初期段階にありますが、大きな未充足ニーズが存在するため、長期的な成長潜在力を持っています。
* エンドユーザー別
* 病院: 治療用ワクチンは、主に病院の腫瘍科、感染症科、免疫科などの専門部門で投与されます。複雑な投与プロトコル、厳格なモニタリング要件、および高度な医療インフラが必要とされるため、病院が主要なエンドユーザーとなります。
* 専門クリニック: 特定のがん治療や慢性感染症管理に特化したクリニックでも、治療用ワクチンが利用されることがあります。これらのクリニックは、患者へのアクセスを向上させ、より個別化されたケアを提供します。
* 研究機関: 臨床試験や基礎研究の段階で、治療用ワクチンの開発と評価のために研究機関が重要な役割を果たします。
* 地域別
* 北米: 世界最大の市場であり、主要な製薬会社、バイオテクノロジー企業、および研究機関が集中しています。強力な研究開発投資、有利な規制環境、および高度な医療インフラが市場成長を促進しています。特に米国は、がん治療用ワクチンの開発と商業化において主導的な役割を担っています。
* 欧州: 厳格な規制基準と多様な医療システムを持つ欧州は、治療用ワクチン市場において重要な地域です。EMAのPRIMEスキームのような迅速承認経路は、革新的な治療法の導入を促進しています。ドイツ、英国、フランスが主要な市場貢献国です。
* アジア太平洋: 最も急速に成長している市場であり、中国、日本、インドが主要な成長エンジンです。医療費の増加、慢性疾患の有病率の上昇、および政府による医療投資の拡大が市場拡大を後押ししています。特に中国は、バイオ医薬品開発への大規模な投資と、巨大な患者プールにより、将来的に重要な市場となるでしょう。
* ラテンアメリカ、中東、アフリカ (LAMEA): これらの地域は、医療インフラの発展途上にあるものの、未充足の医療ニーズと政府による医療アクセス改善への取り組みにより、長期的な成長潜在力を持っています。国際的な協力と投資が、これらの地域での治療用ワクチンの普及を促進する鍵となります。
主要市場プレーヤー
治療用ワクチン市場は、確立された製薬大手と革新的なバイオテクノロジー企業の両方を含む、競争の激しい環境です。主要な市場プレーヤーには、以下のような企業が含まれます。
* BioNTech SE
* Moderna, Inc.
* Merck & Co., Inc.
* Pfizer Inc.
* Gilead Sciences, Inc.
* Bristol Myers Squibb Company
* Novartis AG
* Sanofi S.A.
* GlaxoSmithKline plc (GSK)
* AstraZeneca plc
* Johnson & Johnson
* CureVac N.V.
* Gritstone bio, Inc.
* Transgene SA
* Immunocore Holdings plc
* Genentech (Roche Group)
* Amgen Inc.
* Dendreon Pharmaceuticals LLC (Sipuleucel-Tの開発元)
これらの企業は、研究開発への多額の投資、戦略的提携、買収、および多様なパイプラインを通じて、市場での競争力を維持しようとしています。特に、個別化医療、AIを活用した抗原特定、および併用療法に焦点を当てたイノベーションが、今後の市場動向を形成するでしょう。
このレポートは、がんワクチン市場に関する詳細な分析を提供しています。
1. 調査の範囲と市場定義
本調査では、悪性細胞に対する免疫反応を刺激する予防ワクチンおよび治療ワクチンから生じる累積収益を、がんワクチン市場として定義しています。対象となる技術には、組換えワクチン、ウイルスベクター・DNAワクチン、mRNA/ネオアンチゲン個別化ワクチン、全細胞・樹状細胞ワクチンなどが含まれます。収益は、病院、公的予防接種プログラム、専門クリニックに販売された完成品・表示済み用量から算出されます。ただし、第I相/第II相治験段階にある候補品や併用チェックポイント阻害剤は対象外です。
市場は、技術別(組換え、ウイルスベクター・DNA、mRNA/ネオアンチゲン個別化、全細胞・樹状細胞、その他)、治療法別(予防、治療)、がん種別(子宮頸がん(HPV)、前立腺がん、悪性黒色腫、その他)、投与経路別(筋肉内、皮内/皮下、静脈内)、および地域別(北米、欧州、アジア太平洋、中東・アフリカ、南米)に細分化されています。
2. 調査方法論の信頼性
Mordor Intelligenceの調査は、明確に定義された商業チャネルで販売された用量に焦点を当て、パイプライン製品の売上予測を含めず、現実的な市場投入ペースを反映することで、信頼性の高いベースラインを提供しています。一次調査として、腫瘍専門医、予防接種プログラム管理者、製造責任者へのインタビューを実施し、二次調査では、CDC、ECDC、PMDAなどの規制機関からの出荷・価格データ、GLOBOCAN、WHOからの罹患率・接種率統計、企業財務情報などを活用しています。市場規模の算出と予測は、国レベルのがん罹患率からワクチン適格人口を導き出し、年齢別接種率と加重平均販売価格を乗じるトップダウンモデルと、サプライヤーの販売データによるボトムアップアプローチを組み合わせて行われています。
3. 市場の動向と成長予測
がんワクチン市場は、2030年までに174.2億米ドルに達すると予測されており、年平均成長率(CAGR)は10.30%です。
3.1. 市場の推進要因
* 世界的ながん罹患率の増加。
* 研究開発投資と政府資金の増加。
* mRNAおよびネオアンチゲンプラットフォームの進歩。
* AIを活用した抗原予測によるコスト削減。
* モジュール式マイクロファクトリー製造ハブの登場。
* CPI(免疫チェックポイント阻害剤)との併用療法による治験リスクの低減。
3.2. 市場の阻害要因
* 厳格な規制承認プロセスと複雑性。
* 代替免疫療法の利用可能性。
* 個別化ロジスティクスにおけるコールドチェーンの課題。
* ネオアンチゲン関連IPの集中による新規参入の制限。
4. 主要なセグメント別洞察
* 技術別: mRNA/ネオアンチゲンプラットフォームが最も急速に成長しており、年平均成長率は11.21%です。これは、迅速なカスタマイズ性と強力な臨床的有効性シグナルによるものです。
* 治療法別: 予防ワクチンが2024年の収益の90.23%を占めていますが、治療ワクチンは11.43%のCAGRでより速い成長を示しています。
* 投与経路別: 静脈内投与は、転移性腫瘍に不可欠な優れた全身性免疫活性化を提供し、製剤のバイオアベイラビリティ改善により11.12%のCAGRで牽引力を増しています。
* 地域別: アジア太平洋地域は、費用対効果の高いmRNA製造と大規模な患者プールに支えられ、11.38%のCAGRで最も急速に成長しています。
5. 競争環境
主要企業間の競争戦略は、単独での競争から、AI分析、製造、臨床アクセスにおける強みを結集するパートナーシップベースのエコシステム構築へと移行しています。BioNTechの提携などがその例です。主要企業には、Merck & Co., Inc.、GlaxoSmithKline plc、Moderna Inc.、Bristol Myers Squibb Co.、AstraZeneca plc、F. Hoffmann-La Roche AG (Genentech)、BioNTech SEなどが挙げられます。
6. 市場機会と将来展望
レポートでは、未開拓の領域や満たされていないニーズの評価を通じて、将来の市場機会についても分析しています。
最終更新日:2025年6月16日具体的には、自己免疫疾患や希少疾患への応用拡大、個別化医療の進展、およびmRNAワクチンの安定性向上と製造コスト削減に向けた技術革新が、今後の成長を牽引すると予測されています。
最終更新日:2025年6月16日7. 課題とリスク
しかしながら、mRNA技術の急速な進展には、いくつかの課題も伴います。規制当局による承認プロセスは、特に新規の疾患領域や個別化医療への応用において、依然として複雑で時間を要する可能性があります。また、大規模な製造能力の確保と、個別化された治療法におけるコスト効率の改善は、市場拡大のための重要な障壁となり得ます。さらに、mRNAワクチンのコールドチェーン要件は改善されつつあるものの、グローバルな流通における課題は依然として存在します。長期的な安全性データや、予期せぬ副作用のリスク評価も、今後の技術普及において継続的に監視されるべき点です。
8. 結論
mRNA技術は、感染症予防からがん治療、自己免疫疾患に至るまで、広範な医療分野に革命をもたらす可能性を秘めています。技術革新、戦略的パートナーシップ、そして未開拓の市場機会が、この市場の持続的な成長を後押しするでしょう。課題は存在するものの、それらを克服するための研究開発と投資が活発に行われており、将来的に医療のあり方を大きく変えることが期待されます。

1. はじめに
- 1.1 調査の前提と市場の定義
- 1.2 調査範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場概況
- 4.1 市場概要
-
4.2 市場の推進要因
- 4.2.1 世界的な癌発生率の増加
- 4.2.2 研究開発投資と政府資金の増加
- 4.2.3 mRNAおよびネオ抗原プラットフォームの進歩
- 4.2.4 AI駆動型抗原予測によるコスト削減
- 4.2.5 モジュール式マイクロファクトリー製造ハブ
- 4.2.6 CPIとの併用療法による試験のリスク低減(過小報告)
-
4.3 市場の阻害要因
- 4.3.1 厳格な規制のタイムラインと複雑さ
- 4.3.2 代替免疫療法の利用可能性
- 4.3.3 個別化されたロジスティクスにおけるコールドチェーンのギャップ
- 4.3.4 ネオ抗原IPの集中による新規参入の制限
- 4.4 規制環境
- 4.5 技術的展望
-
4.6 ポーターの5つの力分析
- 4.6.1 買い手の交渉力
- 4.6.2 供給者の交渉力
- 4.6.3 新規参入の脅威
- 4.6.4 代替品の脅威
- 4.6.5 競争上の対抗関係
5. 市場規模と成長予測(金額、米ドル)
-
5.1 技術別
- 5.1.1 組み換えワクチン
- 5.1.2 ウイルスベクター&DNAワクチン
- 5.1.3 mRNA/ネオアンチゲン個別化ワクチン
- 5.1.4 全細胞&樹状細胞ワクチン
- 5.1.5 その他の技術
-
5.2 治療法別
- 5.2.1 予防ワクチン
- 5.2.2 治療用ワクチン
-
5.3 癌の種類別
- 5.3.1 子宮頸がん (HPV)
- 5.3.2 前立腺がん
- 5.3.3 メラノーマ
- 5.3.4 その他の癌
-
5.4 投与経路別
- 5.4.1 筋肉内
- 5.4.2 皮内 / 皮下
- 5.4.3 静脈内
-
5.5 地域別
- 5.5.1 北米
- 5.5.1.1 米国
- 5.5.1.2 カナダ
- 5.5.1.3 メキシコ
- 5.5.2 欧州
- 5.5.2.1 ドイツ
- 5.5.2.2 英国
- 5.5.2.3 フランス
- 5.5.2.4 イタリア
- 5.5.2.5 スペイン
- 5.5.2.6 ロシア
- 5.5.2.7 その他の欧州
- 5.5.3 アジア太平洋
- 5.5.3.1 中国
- 5.5.3.2 日本
- 5.5.3.3 インド
- 5.5.3.4 オーストラリア
- 5.5.3.5 韓国
- 5.5.3.6 その他のアジア太平洋
- 5.5.4 中東およびアフリカ
- 5.5.4.1 GCC
- 5.5.4.2 南アフリカ
- 5.5.4.3 その他の中東およびアフリカ
- 5.5.5 南米
- 5.5.5.1 ブラジル
- 5.5.5.2 アルゼンチン
- 5.5.5.3 その他の南米
6. 競合情勢
- 6.1 市場集中度
- 6.2 市場シェア分析
-
6.3 企業プロファイル(グローバルレベルの概要、市場レベルの概要、主要セグメント、利用可能な財務情報、戦略情報、主要企業の市場ランク/シェア、製品&サービス、および最近の動向を含む)
- 6.3.1 Merck & Co., Inc.
- 6.3.2 GlaxoSmithKline plc
- 6.3.3 Moderna Inc.
- 6.3.4 Bristol Myers Squibb Co.
- 6.3.5 AstraZeneca plc
- 6.3.6 F. Hoffmann-La Roche AG (Genentech)
- 6.3.7 BioNTech SE
- 6.3.8 Gritstone bio, Inc.
- 6.3.9 Vaccitech plc
- 6.3.10 OSE Immunotherapeutics SA
- 6.3.11 Anixa Biosciences Inc.
- 6.3.12 Dendreon Pharmaceuticals LLC
- 6.3.13 Providence Therapeutics Holdings
- 6.3.14 eTheRNA Immunotherapies NV
- 6.3.15 Imugene Ltd.
- 6.3.16 Transgene SA
- 6.3.17 OncoSec Medical Incorporated
- 6.3.18 NantKwest Inc.
- 6.3.19 Ultimovacs ASA
- 6.3.20 ISA Pharmaceuticals BV
7. 市場機会&将来展望
*** 本調査レポートに関するお問い合わせ ***

癌ワクチンは、私たちの体にもともと備わっている免疫の力を利用して、癌細胞を攻撃・排除する治療法、あるいは癌の発生を予防する薬剤の総称でございます。従来の癌治療である手術、化学療法、放射線療法が癌細胞を直接除去したり殺傷したりするのに対し、癌ワクチンは患者様ご自身の免疫系を活性化させ、癌細胞を「異物」として認識させて排除へと導くという点で、根本的に異なるアプローチを取ります。大きく分けて、癌の発生を未然に防ぐ「予防的癌ワクチン」と、既に発生した癌の治療を目指す「治療的癌ワクチン」の二種類が存在いたします。
予防的癌ワクチンは、特定のウイルス感染が原因で発症する癌を対象とします。最も代表的なものに、子宮頸癌の主要な原因であるヒトパピローマウイルス(HPV)に対するHPVワクチンや、肝癌の原因となるB型肝炎ウイルス(HBV)に対するHBVワクチンがございます。これらはウイルス感染そのものを防ぐことで、結果的に癌の発生を予防するというメカニズムで機能し、その高い有効性は世界的に確立されており、公衆衛生上極めて重要な役割を担っております。
一方、治療的癌ワクチンは、既に体内に存在する癌細胞を標的とし、免疫応答を誘導することで癌の進行を抑制したり、再発を防いだりすることを目指します。そのアプローチは多岐にわたります。
一つは、癌細胞に特異的に、あるいは高頻度に発現するタンパク質(腫瘍抗原)を免疫系に提示することで、その抗原を標的とする免疫細胞を活性化させる「腫瘍抗原ワクチン」です。これには、特定の腫瘍抗原の一部である短いアミノ酸配列(ペプチド)を投与する「ペプチドワクチン」や、腫瘍抗原全体またはその一部のタンパク質を投与する「タンパク質ワクチン」がございます。また、患者様ご自身の樹状細胞を体外に取り出し、腫瘍抗原と接触させて活性化させた後、体内に戻すことで強力な免疫応答を誘導する「樹状細胞ワクチン」もこの範疇に入ります。米国で承認された前立腺癌治療薬「プロベンジ(Sipuleucel-T)」がこのタイプでございます。近年特に注目されているのは、癌細胞の遺伝子変異によって生じる、患者様固有の新しい抗原(ネオアンチゲン)を標的とする「ネオアンチゲンワクチン」です。これは正常細胞には存在しないため、免疫系が強く反応し、副作用が少ないと期待されており、次世代シーケンシング技術の進歩により個別化医療の最前線として開発が進められております。
次に、「遺伝子改変ウイルスワクチン」は、癌抗原の遺伝子を組み込んだウイルスをベクターとして利用し、体内で癌抗原を発現させることで免疫応答を誘導します。アデノウイルスやワクシニアウイルスなどが用いられます。
また、「全細胞ワクチン」は、患者様ご自身の癌細胞、または培養した癌細胞を不活化処理し、アジュバント(免疫賦活剤)と共に投与するもので、癌細胞全体を抗原として利用するため、多様な抗原を提示できる利点がございます。
そして、COVID-19ワクチンでその有効性が広く認識された「mRNAワクチン」は、癌治療においても大きな期待が寄せられております。特定の腫瘍抗原やネオアンチゲンをコードするmRNAを投与することで、体内の細胞がその抗原タンパク質を産生し、免疫応答を誘導します。迅速な製造が可能であり、個別化ネオアンチゲンワクチンへの応用が進んでおります。
癌ワクチンの用途は多岐にわたります。癌の治療においては、既存の癌の進行を遅らせる、腫瘍を縮小させる、再発を抑制する、患者様の生活の質(QOL)を向上させることを目的とします。特に、手術や化学療法、放射線療法では効果が限定的な進行癌や転移癌に対して、新たな治療選択肢となることが期待されております。予防的癌ワクチンは、特定のウイルス感染による癌の発生を未然に防ぎ、癌の一次予防として極めて重要な役割を担います。
癌ワクチン単独での効果には限界がある場合も多いため、他の治療法との併用が積極的に研究されております。特に、免疫チェックポイント阻害剤との併用は、癌ワクチンによって誘導された免疫細胞の働きを阻害するブレーキを解除することで、相乗的な治療効果が期待されております。また、化学療法や放射線療法と組み合わせることで、癌細胞が免疫系に認識されやすくなる効果(免疫原性細胞死)を利用するアプローチも進められております。患者様一人ひとりの癌の遺伝子変異や免疫状態に合わせて、最適なワクチンを設計・製造する個別化医療への応用が、治療的癌ワクチンの主要な方向性となっております。
癌ワクチンの開発を支え、その効果を最大化する関連技術も進化を続けております。
「免疫チェックポイント阻害剤」は、癌細胞が免疫細胞の攻撃から逃れるために利用する「免疫チェックポイント」を阻害することで、免疫細胞の活性化を促す薬剤です。癌ワクチンとの併用により、免疫応答の誘導と、その応答の持続・強化の両面から癌を攻撃する戦略が確立されつつあります。
「次世代シーケンシング(NGS)」は、癌細胞のゲノムやRNAを高速かつ網羅的に解析する技術で、これにより患者様固有のネオアンチゲンを効率的に同定することが可能となり、個別化ネオアンチゲンワクチンの開発に不可欠な基盤技術となっております。
「AI・機械学習」は、膨大なゲノムデータや臨床データから、ネオアンチゲンの予測精度を高めたり、治療効果を予測するバイオマーカーを探索したり、ワクチンの設計を最適化したりするために活用されております。
「遺伝子編集技術(CRISPR/Cas9など)」は、免疫細胞(T細胞など)の機能を強化したり、ワクチンベクターの設計を改良したりする研究に応用されております。
「ナノテクノロジー」は、ワクチン抗原やアジュバントを効率的に免疫細胞に送達するためのナノ粒子キャリアの開発が進められており、これによりワクチンの免疫原性を高め、副作用を低減することが期待されております。
市場背景としましては、予防的癌ワクチンは、HPVワクチンやHBVワクチンが世界的に広く普及し、その有効性が確立されております。一方、治療的癌ワクチンは、一部の製品が承認されているものの、その有効性や奏効率には課題があり、まだ広く普及しているとは言えません。しかし、免疫チェックポイント阻害剤の成功により、癌免疫療法全体への関心が高まり、治療的癌ワクチンの開発も再び活発化しております。
主な課題としては、癌細胞の多様性や複雑な免疫回避メカニズムにより、有効性のばらつきや奏効率の低さが挙げられます。また、癌組織の微小環境は免疫抑制的な因子に富んでおり、ワクチンによって誘導された免疫細胞が十分に機能しにくい場合があります。ネオアンチゲンワクチンなどの個別化ワクチンは、患者様ごとに製造する必要があるため、製造コストが高く、時間もかかるという課題もございます。さらに、癌ワクチンの効果を評価するには長期的な追跡が必要であり、開発コストも高額になります。
しかし、これらの課題を克服する大きな機会も存在します。免疫チェックポイント阻害剤との併用により、治療効果が飛躍的に向上する可能性が示されており、新たな市場を創出しています。NGSやAI技術の発展により、個別化ネオアンチゲンワクチンの開発が加速しており、高い有効性が期待されております。mRNA技術は、迅速な製造と高い免疫原性を持つことから、個別化医療の課題解決に貢献する可能性を秘めております。難治性癌や再発癌に対する新たな治療法へのニーズは依然として高く、癌ワクチンはその有力な候補でございます。
将来展望としましては、癌ワクチンは、今後、癌治療の重要な柱の一つとして確立される可能性を秘めております。特に、個別化ネオアンチゲンワクチンとmRNA技術の融合は、治療的癌ワクチンの有効性を大きく向上させると期待されております。免疫チェックポイント阻害剤をはじめとする他の免疫療法や、従来の化学療法、放射線療法との併用が標準的な治療戦略となり、より多くの患者様が恩恵を受けられるようになるでしょう。AIやビッグデータ解析の進化は、ネオアンチゲンの同定、ワクチンの設計、治療効果の予測をさらに精密化し、開発期間の短縮と成功率の向上に貢献します。製造技術の革新により、個別化ワクチンのコストが低減され、より多くの医療機関で利用可能になることが期待されます。将来的には、癌の早期段階での治療や、再発予防のための維持療法として、癌ワクチンが広く用いられるようになることで、癌がより管理しやすい慢性疾患へと変化していくことに貢献するでしょう。