パイロジェン試験市場の規模と展望、2025年から2033年

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
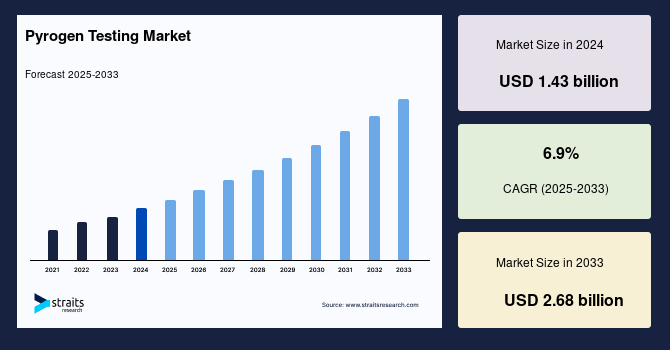
世界の発熱物質検査市場の規模は、2024年に14億3000万米ドルと評価され、2025年には15億7000万米ドルから2033年までに26億8000万米ドルに成長すると予測されており、予測期間中(2025-2033年)のCAGRは6.9%を示しています。発熱物質検査は、体内に入った際に発熱を引き起こす可能性のある発熱物質を検出し測定するための重要なプロセスです。これらの発熱物質は、しばしば細菌エンドトキシンであり、薬品、ワクチン、医療機器などの医療製品によく含まれています。発熱物質検査は、これらの製品が発熱を引き起こす汚染物質から無害であることを確認し、患者の健康を守る役割を果たします。一般的な発熱物質検査の方法には、LAL(Limulus Amebocyte Lysate)試験やウサギ発熱物質試験(RPT)があり、両者はエンドトキシンやその他の有害化合物の検出に重点を置いています。
市場は急速に拡大しており、生物製剤、注射剤、医療機器の生産が増加していることが主な要因です。これらは正確なエンドトキシンの検出を必要としています。また、FDA、EMA、USPなどの機関による規制の義務化により、先進的な発熱物質検査方法の採用が推進されています。これには、従来の動物ベースの試験、例えばウサギ発熱物質試験(RPT)から、単球活性化試験(MAT)や組換え因子C(rFC)アッセイなどのin vitro代替法への移行が含まれます。感染症の蔓延とバイオ医薬品製造の拡大は、効率的な発熱物質検出ソリューションの需要を著しく押し上げています。
技術の進歩により、自動化されたエンドトキシン検出システムやAI駆動のデータ分析が、検査の正確性と運用効率を向上させています。さらに、in vitro検査キットのコスト効率的な開発や、小規模・中規模の製薬会社を支援する契約検査サービスの拡大に新たなチャンスが存在しています。
発熱物質検査市場は、倫理的懸念とFDAやEMAなどの機関からの規制支援の増加により、ウサギ発熱物質試験(RPT)などの伝統的な動物ベースの方法から、より倫理的で効率的なin vitro技術、例えば単球活性化試験(MAT)に移行しています。この進化は、検査の正確性を高め、規制の遵守を改善し、発熱物質検査市場を世界的に拡大させることが期待されています。
また、検出技術の継続的な進歩が、正確性、感度、効率を高め、発熱物質検査を革新しています。組換え因子C(rFC)ベースのアッセイ、自動化されたエンドトキシン検出システム、AI駆動のデータ分析などの新技術が、プロセスを合理化し結果を改善しています。これらの技術進歩は、持続可能で正確かつスケーラブルな検出ソリューションの採用を促進し、進化する規制への対応を確実にし、全体的な製品安全性を向上させています。
医療機器産業の拡大は、インプラント機器や外科用器具の生産が増加する中で、発熱物質検査の需要を高めています。規制機関は、安全基準の遵守と患者の健康保護を確保するために、厳格な発熱物質およびエンドトキシン検査を義務付けています。こうした投資と医療機器製造セクターの継続的な拡大は、信頼性の高い発熱物質検査ソリューションの世界的な需要を推進することが期待されています。
がん、糖尿病、心血管疾患などの慢性病の発生率の増加により、生物製剤、ワクチン、注射療法の需要が大幅に増加しています。これらの治療法は、安全性を確保し規制要件を満たすために、厳格な発熱物質およびエンドトキシン検査を必要とします。その結果、安全で高品質な治療が求められる中、発熱物質検査市場は成長を続けると予想されます。
世界の発熱物質検査市場における主な制約要因の一つは、複雑で厳格な規制承認プロセスです。製造業者は、FDA、EMA、USPなどの機関が定める厳格なガイドラインに従わなければならず、これには試験方法の安全性と有効性を確保するための広範な検証、文書化、および品質管理が要求されます。これらのプロセスは、重大な遅延を引き起こし、運用コストを増加させ、新製品の市場参入を妨げる可能性があります。さらに、進化する規制基準への適応と試験プロトコルの頻繁な更新の必要性が複雑さを増し、革新的な発熱物質検査ソリューションの迅速な採用をさらに制限しています。
バイオ医薬品製造の急速な拡大は、市場にとって大きな機会を提供しています。モノクローナル抗体、遺伝子治療、バイオシミラーなどの生物製剤の生産の増加は、信頼性の高い発熱物質検出方法を含む厳格な品質管理を必要とします。特に新興市場でのバイオ医薬品製造施設の拡大は、先進的な発熱物質検査ソリューションのさらなる需要を促進し、バイオ医薬品製品の安全性、コンプライアンス、品質を確保することが期待されています。
北アメリカは、FDAとUSPによって施行される厳格な規制フレームワークと、高いLALアッセイの採用により、世界の発熱物質検査市場でリーダー的な地位を持っています。この地域は、広範な製薬研究開発、先進的なバイオ医薬品生産、主要なバイオテクノロジー企業の存在から恩恵を受けています。さらに、単球活性化試験(MAT)などのin vitro試験方法の使用が増加しており、規制承認を受けて市場の成長をさらに後押ししています。
アジア太平洋地域は、製薬製造の増加、政府の医療投資の増加、バイオテクノロジー研究の拡大により、最も速いCAGRを記録すると予想されています。中国やインドなどの新興経済国では、生物製剤の生産が急増しており、厳格な発熱物質検査プロトコルが必要とされています。この地域はまた、規制意識の向上と動物ベースの試験に替わるin vitro代替法の採用の増加から利益を受けています。
ヨーロッパは、発熱物質検査にとって重要な市場であり、ヨーロッパ薬局方(EP)ガイドラインの遵守に重きを置き、動物ベースの試験からin vitro代替法への移行に焦点を当てています。バイオテクノロジー研究への資金提供の増加と、バイオ医薬品生産の増加が、発熱物質検査の需要をさらに促進しています。また、動物試験に対する倫理的懸念から、単球活性化試験(MAT)への移行が徐々に進んでいます。
Limulus Amebocyte Lysate(LAL)アッセイは、その高い感度、信頼性、広範な規制承認により、世界市場をリードしています。この方法は、迅速な結果と使いやすさから、製薬業界とバイオテクノロジー業界で好まれています。最近の技術的進歩には、組換え因子C(rFC)代替品が含まれ、カブトガニの血液への依存を減らすことで、より持続可能で効率的な発熱物質検査プロセスを確保しています。
消耗品は市場を支配しており、Limulus Amebocyte Lysate試薬、エンドトキシン検出キット、および検査手順に使用される培地の継続的な需要によって駆動されています。これらの消耗品は、製薬および医療機器の製造における日常的な品質管理に不可欠です。先進的な技術、例えばMATや組換え法の採用の増加は、特化した消耗品の需要を促しています。さらに、バイオ医薬品製造の増加と厳格な規制基準は、一貫した高品質の消耗品の必要性をさらに強化し、製品の安全性を維持しています。
製薬会社およびバイオテクノロジー企業は、生物製剤、バイオシミラー、注射薬の生産が増加しているため、市場で最大のエンドユーザーです。これらの企業は、製品の安全性を確保し、規制の遵守を満たすために発熱物質検査に依存しています。臨床試験の増加、医薬品開発、個別化医療および遺伝子治療の採用の増加は、信頼性のあるエンドトキシン検出および発熱物質管理の必要性をさらに強め、これらのセクターにおける発熱物質検査サービスの需要を促進しています。
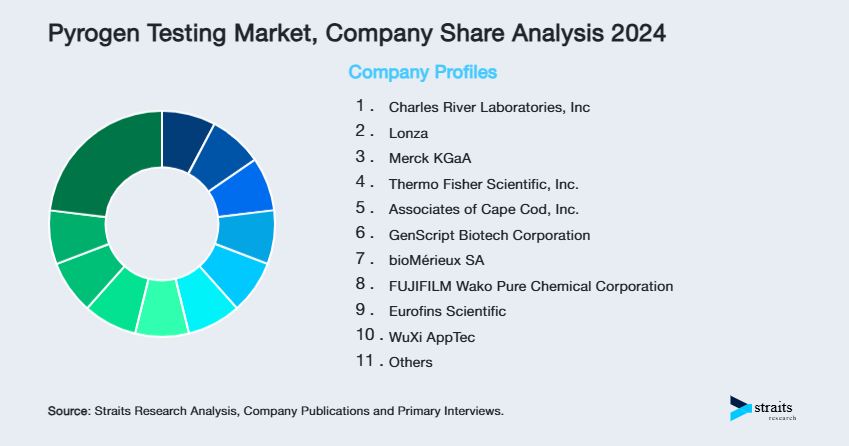
市場は中程度に分散しており、主要なプレーヤーは、イノベーション、規制の遵守、および戦略的パートナーシップを優先して市場の存在感を高めることに焦点を当てています。主要企業は、rFCやMATベースの検査ソリューションを導入し、ポートフォリオの拡大に努め、市場のリーチを広げています。また、自動化、動物フリーの試験方法、そして新興技術への重要な投資が、効率的で倫理的な発熱物質検査の需要を満たすためにこれらのプレーヤーを位置づけています。
Lonzaは、契約製造および開発サービスを提供する主要なライフサイエンス企業です。市場では、LALおよびTALアッセイ、およびNebula吸光度リーダーなどの先進的なエンドトキシンおよび発熱物質検出ソリューションを提供し、製薬製造における正確な品質管理を確保しています。
私たちのアナリストによれば、世界の発熱物質検査市場は、製薬および生物製剤の生産の増加と厳格な規制要件によって大幅な成長を遂げる準備が整っています。in vitro試験方法、例えば単球活性化試験(MAT)の採用の増加は、より信頼性が高く倫理的な代替案を提供し、市場の風景を変えています。しかし、これらのポジティブなトレンドにもかかわらず、市場は、規制承認プロセスの複雑さや先進的な試験方法に関連する高コストといった課題に直面しています。さらに、従来の試験方法、例えばLimulus Amebocyte Lysate(LAL)から、組換え因子C(rFC)ベースのアッセイへの移行は、技術的な課題を呈し、新技術への多額の投資を必要とします。
それにもかかわらず、組換え技術と自動化の進歩、特にアジア太平洋のような新興市場でのバイオ医薬品インフラの拡大は、大きな成長の機会を提供しています。薬品製造における品質管理に対する政府の注力の増加は、発熱物質検査の需要をさらに促進し、これらの地域を市場の将来の拡大における主要なプレーヤーとして位置付けることが期待されています。
Report Coverage & Structure
レポートの構造概要
このレポートは市場分析に関する詳細な情報を提供しており、様々なセクションに分かれています。以下にセクションごとの概要を示します。
1. はじめに
- 市場のセグメンテーションと調査手法について説明しています。
- サンプル取得と目次が含まれています。
2. 市場概要
- エグゼクティブサマリーが提供され、市場の全体像が示されています。
- 調査範囲とセグメンテーション、調査目的、制限事項、仮定、通貨と価格について説明されています。
3. 市場機会評価
- 新興地域や国、新興企業、新興アプリケーションやエンドユースに関する分析が含まれています。
4. 市場動向
- 市場の推進要因、警告要因、最新のマクロ経済指標、地政学的影響、技術要因について説明されています。
5. 市場評価
- ポーターの5つの力分析とバリューチェーン分析が含まれています。
6. 規制の枠組み
- 地域別(北米、ヨーロッパ、アジア太平洋、中東およびアフリカ、LATAM)の規制フレームワークが説明されています。
7. ESGトレンド
ESG(環境・社会・ガバナンス)に関するトレンドについて言及されています。
8. グローバルパイロゲンテスト市場サイズ分析
- 市場のタイプ別、製品別、エンドユーザー別の詳細な分析が行われています。
- 主要なテスト方法(ラビットパイロゲンテスト、リムルスアメボサイト溶解テスト、単球活性化テスト)および製品、消耗品、機器、サービスに関する情報が含まれています。
9. 地域別市場分析
- 北米、ヨーロッパ、アジア太平洋、中東およびアフリカの各地域での詳細な市場分析が行われています。
- 各地域内での国別(例:米国、カナダ、英国、ドイツ、中国、日本)分析が含まれています。
このレポートは、パイロゲンテスト市場の現在の状況と将来の可能性を理解するための情報を提供しています。市場の動向や規制の枠組み、地域別の市場分析に基づいて、投資や事業戦略の策定に役立つ内容となっています。
*** 本調査レポートに関するお問い合わせ ***

パイロジェン試験とは、医薬品や医療機器において、発熱性物質であるパイロジェンの存在を検出するための試験です。パイロジェンは、体内に入ると発熱反応を引き起こす可能性のある物質であり、主に細菌の細胞壁成分であるエンドトキシンが含まれます。この試験は、医薬品の安全性を確保するために非常に重要です。
パイロジェン試験にはいくつかの種類があります。伝統的な方法としては、ウサギを用いた試験があります。この方法では、試験対象の物質をウサギに注射し、その後の体温の変化を観察します。ウサギの体温が上昇した場合、その物質にはパイロジェンが含まれていると判断されます。しかし、この方法は動物を用いるため倫理的な問題があり、また時間と手間がかかるという欠点があります。
そのため、近年ではより迅速で動物を用いない方法が開発されています。代表的なものに、LAL試験(Limulus Amebocyte Lysate試験)があります。これはカブトガニの血液成分を利用した試験で、エンドトキシンに対して非常に感度が高いのが特徴です。試験対象の物質をLAL試薬と混ぜ、ゲル化するかどうかを確認することで、エンドトキシンの有無を判定します。この方法は動物を使用せず、短時間で結果が得られるため、広く利用されています。
また、最新の技術としては、重合酵素連鎖反応(PCR)を用いたパイロジェン検出法も開発されています。この方法では、エンドトキシンの遺伝子を増幅することで、非常に低濃度のパイロジェンも検出することが可能です。このように、技術の進歩により、パイロジェン試験はますます精度が高く、効率的になってきています。
パイロジェン試験は、医薬品の品質管理において不可欠な工程であり、特に注射剤や点滴用製剤など直接体内に投与される製剤においては、その重要性が一層高まります。医薬品の製造過程においては、パイロジェンの混入を防ぐための対策が講じられ、最終製品においても厳密な試験が実施されています。これにより、患者の安全性が確保され、医療の現場での信頼性が維持されています。
関連技術としては、環境モニタリングや無菌製造技術があります。これらもパイロジェンの混入を防ぐための重要な要素です。環境モニタリングでは、製造環境の微生物レベルを監視し、適切な対策を講じることで、パイロジェンの発生を最小限に抑えます。無菌製造技術は、製品が外部環境からの汚染を受けないようにするための技術であり、クリーンルームの使用や無菌操作の徹底などが含まれます。これらの技術と試験が組み合わさることで、安全で有効な医薬品の提供が可能となります。