オルガノイド市場規模と展望、2025-2033年

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
## オルガノイド市場に関する詳細な市場調査レポート要約
### 1. 市場概況
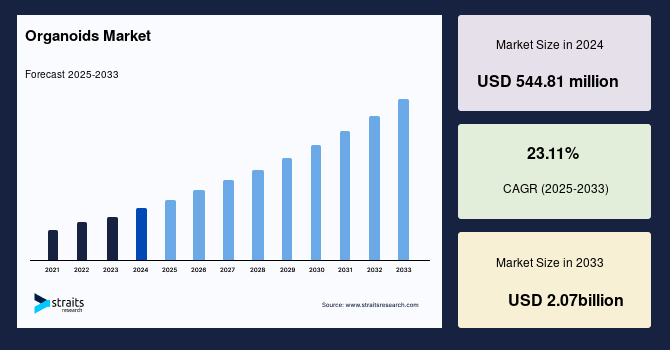
グローバルなオルガノイド市場は、2024年に5億4,481万米ドルと評価され、2025年には7億1,489万米ドルに達し、2033年までには20.7億米ドルに成長すると予測されています。予測期間(2025年~2033年)中の年平均成長率(CAGR)は23.11%という驚異的な伸びが期待されています。
オルガノイドは、幹細胞から分化・自己組織化によって作られる高度な三次元(3D)構造体であり、生体内の臓器の主要な特徴を試験管内で再現するように設計されています。これらは、単なる細胞の塊ではなく、実際の臓器の微細な構造と機能を極めて忠実に模倣する能力を持つため、従来の二次元(2D)細胞培養モデルでは再現が困難であった複雑な生物学的プロセスや疾患メカニズムの研究において、画期的なツールとして注目されています。特に、結腸がん、肺がん、慢性腎臓病といった疾患の研究において、その重要性は増すばかりです。
オルガノイド技術の導入は急速に進んでおり、ClinicalTrials.govのデータによると、2024年2月時点で、オルガノイド技術を活用した臨床試験が106件進行中であることが示されています。この数字は、オルガノイドが基礎研究の領域を超え、臨床応用への道を着実に歩んでいることを明確に示唆しています。
近年、オルガノイドは製薬研究、特に創薬と個別化医療の分野でその役割を大きく拡大しています。オルガノイドを用いることで、薬剤のスクリーニングと試験を大幅に加速させ、その精度を飛躍的に向上させることが可能になりました。さらに、オルガノイドは「臓器チップ(Organ-on-chip: OoC)」システムとの統合が進んでおり、これにより、より複雑なヒトの生物学的システムを模倣する能力が強化されています。この統合されたアプローチは、疾患メカニズムのより深い理解、薬剤試験の洗練、そして個別化された治療のための予測モデルの改善に新たな機会をもたらしています。
オルガノイド技術の台頭は、患者固有の疾患モデルの開発と、それに基づいた個別化された治療戦略の実現を可能にすることで、個別化医療のあり方を根本から変革しつつあります。例えば、2024年5月にCell Pressに掲載された記事では、オルガノイドがin vitroでの遺伝子編集療法の新たなプラットフォームとして注目されていることが強調されました。CRISPR-Cas9などの遺伝子編集ツールを活用することで、研究者は遺伝性疾患のモデルを構築し、様々な治療戦略を試験することができ、患者固有の精密な治療を可能にすることで個別化医療を大きく前進させています。このような革新は、個別化された治療のアクセシビリティと効率性を高め、市場の成長を著しく促進するとともに、オルガノイド分野におけるさらなる進歩を牽引しています。
また、オルガノイドとマイクロ流体技術の統合は、グローバルオルガノイド市場における主要なトレンドとして浮上しています。この組み合わせは、薬剤試験、疾患モデリング、および個別化医療におけるオルガノイドの可能性を飛躍的に高めます。これらのプラットフォームがオルガノイドと結合することで、より現実的なヒト臓器モデルが構築され、前臨床試験の精度が向上し、動物モデルへの依存度を低減させることができます。例えば、2024年3月には、CEA-Letiおよび共同研究者らが、マイクロ流体チップ上のオルガノイドの完全な血管化に成功し、血液のような流速を達成することで、オルガノイドの成長と機能的成熟を著しく改善したことを発表しました。この血管化は、栄養素と酸素の交換に不可欠であり、オルガノイドの効果的な発達を促進します。この革新的なアプローチは、薬剤発見、毒性スクリーニング、および治療開発を推進し、ヒトの治療反応をより効率的かつスケーラブルに予測する方法を提供することで、オルガノイド市場のさらなる成長を牽引すると期待されています。
### 2. 市場の推進要因 (Drivers)
オルガノイド市場の成長を牽引する主要な要因は多岐にわたりますが、特に以下の点が挙げられます。
**2.1. 製薬研究におけるオルガノイドの採用増加**
オルガノイドは、生体内の生理学的状況により近いモデルを提供することで、薬剤試験の精度を大幅に向上させ、動物モデルへの依存を低減し、結果として薬剤開発プロセスを加速させます。従来の2D細胞培養や動物モデルでは捉えきれなかった、ヒト特有の薬剤反応や毒性メカニズムをオルガノイドが再現できるため、臨床試験での失敗率を減少させる可能性を秘めています。これは、新薬開発にかかる時間とコストを削減し、より安全で効果的な薬剤を市場に投入するための重要な鍵となります。
例えば、2024年2月には、Danaher CorporationがCincinnati Children’s Hospital Medical Centerと提携し、臨床試験失敗の主要因に対処することで患者の安全性を高める取り組みを発表しました。Danaher Beaconsプログラムを通じたこの複数年にわたる共同研究は、肝臓オルガノイド技術を薬剤毒性スクリーニングに応用し、治療開発を加速させ、年間数十億ドルの研究開発費を節約することを目指しています。このように、オルガノイドの製薬研究における採用拡大は、薬剤開発を効率化するだけでなく、治療法の発見における革新を促進し、市場の大幅な成長を後押ししています。
**2.2. 個別化医療の進展とオルガノイドの貢献**
個別化医療は、患者一人ひとりの遺伝的特性や疾患プロファイルに基づいて、最適な治療法を提供するアプローチです。オルガノイドは、患者由来の幹細胞から作製することで、患者固有の疾患モデルをin vitroで構築することを可能にします。これにより、特定の患者の薬剤応答を予測したり、個別化された治療戦略を開発したりする上で、比類のないツールとなります。
2024年5月にCell Pressに掲載された記事が強調するように、オルガノイドはin vitroでの遺伝子編集療法の新たなプラットフォームとして注目されています。CRISPR-Cas9をはじめとする先進的な遺伝子編集ツールを活用することで、研究者はオルガノイド内で遺伝性疾患の分子メカニズムをモデル化し、患者固有の遺伝子異常を修正するための治療戦略を試験することができます。これは、遺伝子治療の個別化を劇的に進め、より精密で効果的な治療法の開発を可能にします。オルガノイドは、患者の病態を反映した環境で薬剤の有効性や副作用を評価できるため、治療法の選択肢を最適化し、副作用のリスクを最小限に抑えることにも貢献します。
**2.3. マイクロ流体技術との統合によるモデルの高度化**
オルガノイドとマイクロ流体技術、すなわち「オルガンチップ」システムの統合は、オルガノイドモデルの生理学的関連性をさらに高める重要なトレンドです。マイクロ流体デバイスは、生体内の微小環境を模倣し、細胞への栄養供給、代謝産物の除去、機械的刺激の印加などを精密に制御することを可能にします。この統合により、オルガノイドはより長期にわたって機能的に成熟し、生体内の血流や組織間相互作用を再現できるようになります。
例えば、2024年3月にはCEA-Letiおよび共同研究者らが、マイクロ流体チップ上でオルガノイドの完全な血管化に成功したことを実証しました。この技術では、血液と類似した流速で栄養素や酸素を供給することが可能となり、オルガノイドの成長と機能的成熟が著しく改善されました。血管網の形成は、大型化されたオルガノイドの維持や、薬剤の体内動態(吸収、分布、代謝、排泄)の研究において不可欠です。この革新的なアプローチは、薬剤発見、毒性スクリーニング、治療開発において、ヒトの反応をより効率的かつスケーラブルに予測する手段を提供し、前臨床試験の精度を向上させるとともに、動物実験の必要性をさらに低減させることで、オルガノイド市場の成長を強力に後押ししています。
### 3. 市場の阻害要因 (Restraints)
オルガノイド市場の急速な成長にもかかわらず、いくつかの重要な課題がその普及と発展を妨げています。
**3.1. マトリックスのバッチ間変動性**
オルガノイドの培養において、マトリックス(例えば、マトリゲルや基底膜抽出物)は、細胞の足場を提供し、分化と自己組織化を誘導するために不可欠な役割を果たします。しかし、これらの天然由来のマトリックスは、バッチ間で組成や物理的特性に一貫性がないという重大な問題を抱えています。
2024年6月にACS Publicationsに掲載された記事によると、これらのマトリックスのバッチ間変動性は、実験結果の再現性を損なう可能性があります。この一貫性の欠如は、研究結果の検証を複雑にするだけでなく、オルガノイドを治療応用(例えば、再生医療や移植)に使用する際に、免疫応答に影響を与える可能性も指摘されています。結果として、研究者は信頼性のある、比較可能な結果を得ることに困難を伴い、これが創薬や個別化医療におけるオルガノイド応用の進展を阻害しています。この変動性は、オルガノイドベースの製品に対する信頼を損ない、最終的には市場の成長を妨げ、これらの技術の臨床現場への採用を遅らせる要因となっています。これらの課題に対処することは、研究とヘルスケアにおけるオルガノイド技術の信頼を醸成し、より広範な実装を促進するために不可欠です。合成マトリックスの開発や、より厳密な品質管理基準の導入が、この問題解決に向けた重要なステップとなるでしょう。
### 4. 市場の機会 (Opportunities)
オルガノイド市場には、その成長をさらに加速させる大きな機会が潜在しています。
**4.1. 幹細胞技術の最近の進歩**
幹細胞技術の目覚ましい進歩は、グローバルオルガノイド産業に計り知れない機会をもたらしています。幹細胞(特にiPS細胞やES細胞)を分離・培養し、特定の細胞型へと分化させる能力の向上は、オルガノイド開発のための堅固な基盤を確立しました。これにより、より洗練され、多様なオルガノイドモデルの作製が可能となっています。
研究者がこれらの幹細胞由来オルガノイドを活用して複雑な疾患をモデル化し、薬剤応答を試験するにつれて、個別化医療における画期的な進歩の可能性が拡大しています。例えば、患者由来のiPS細胞から作製されたオルガノイドは、その患者特有の遺伝的背景や疾患の病態を反映するため、薬剤の有効性や毒性を予測する上で非常に有用です。これにより、個別化された薬剤スクリーニングや治療法の最適化が可能になります。
最先端の幹細胞技術をオルガノイド技術と統合することで、より効果的な治療戦略への道が開かれるため、これはオルガノイド市場における極めて重要な成長分野となっています。幹細胞の分化プロトコルの最適化や、遺伝子編集技術との組み合わせにより、より高機能で生理学的に関連性の高いオルガノイドを開発する能力は、再生医療、疾患モデリング、創薬といった幅広い応用分野において、革新的なソリューションを提供する可能性を秘めています。
### 5. セグメント分析
グローバルオルガノイド市場は、様々な側面に基づいて詳細にセグメント化されています。
**5.1. オルガノイドの種類別**
市場は、神経オルガノイド、肝臓オルガノイド、腸オルガノイド、その他に二分されます。
**腸オルガノイド**セグメントがオルガノイド産業において支配的な地位を占めています。これは、薬剤試験、疾患モデリング、および消化器系疾患の理解におけるその極めて重要な役割に起因します。腸オルガノイドは、複雑な生物学的プロセス、特に腸管上皮のバリア機能、栄養吸収、微生物との相互作用などを研究する上で特に価値が高く、研究および製薬応用における有用性を高めています。
例えば、2024年1月には、HUB Organoidsが新たな「IntegriGut Screen」を立ち上げました。このスクリーニングは、炎症性腸疾患(IBD)患者由来のオルガノイド単層培養を利用して、上皮バリア機能に関する高品質なヒトデータを提供し、これにより新規IBD治療法の開発を加速させるものです。この革新は、腸オルガノイドの重要性を示すだけでなく、標的治療法の開発における投資と関心を喚起しています。神経オルガノイドは神経変性疾患や脳の発達研究に、肝臓オルガノイドは薬物代謝や肝疾患研究にそれぞれ重要な役割を果たしていますが、幅広い応用性と確立された培養プロトコルにより、腸オルガノイドが市場をリードしています。
**5.2. 培養方法別**
市場は、一般的な浸漬培養法、クリプトオルガノイド培養技術、気液界面(ALI)培養法、Lgr5+細胞からのクローンオルガノイド、脳および網膜オルガノイド形成プロトコル、その他に二分されます。
**一般的な浸漬培養法**がオルガノイド市場において支配的なアプローチとなっています。これは、その広範な応用性と有効性に大きく起因しています。この方法は、様々な種類のオルガノイドを効率的に増殖・維持することを可能にし、研究者の間で好まれる選択肢となっています。異なる細胞タイプに対応するその汎用性や、疾患モデリングおよび薬剤試験における応用が、市場におけるその主導的な地位をさらに強化しています。
さらに、浸漬培養技術における継続的な進歩は、オルガノイドモデルの品質と再現性を向上させており、多様な研究分野での採用を推進しています。これらの改善は、実験結果の信頼性を高めるだけでなく、ヒトの生理機能と疾患のより正確なモデリングを促進し、オルガノイド研究を進める上での浸漬培養法の重要な役割を再確認させています。気液界面培養法は肺や皮膚などのオルガノイドに特化していますが、浸漬培養法はより幅広いオルガノイドの培養に適用できるため、その優位性を維持しています。
**5.3. 細胞源別**
市場は、初代組織と幹細胞に二分されます。幹細胞はさらに、人工多能性幹細胞(iPS細胞)とその他に細分化されます。
**幹細胞**セグメントが市場を支配しています。その理由は、様々な細胞タイプに分化する能力があり、多様なオルガノイドモデルの作製を可能にするためです。この汎用性は、疾患モデリング、創薬、再生医療といった応用において特に価値があります。特にiPS細胞は、患者自身の体細胞から作製できるため、倫理的な問題が少なく、患者特異的な疾患モデルを構築する上で非常に有利です。
例えば、2023年3月には、MIMETASがOrganoReady製品ラインの一環として、アッセイ対応形式の成人幹細胞(ASC)由来管状オルガノイドを発売しました。これは、ASC由来の結腸オルガノイド管と腎臓オルガノイド管という2種類のオルガノイドベース製品を提供します。この進歩は、幹細胞由来オルガノイドの使いやすさを向上させ、研究開発におけるさらなる採用を促進しています。初代組織は生体に近い状態を反映しますが、その入手性や培養寿命に限りがあるのに対し、幹細胞は無限に近い増殖能力と分化多能性を持つため、大規模な研究やスクリーニングに適しています。
**5.4. 用途別**
市場は、発生生物学、個別化医療、再生医療、疾患病理研究、薬物毒性・有効性試験に分かれています。
**発生生物学**セグメントが市場を支配しています。これは、ヒトの発生を研究するためのオルガノイド培養システムの利用が増加しているためです。従来のin vivo研究や2D培養方法とは異なり、これらのシステムは、ヒトの発生生物学の基礎的な側面、例えば臓器形成のメカニズムや細胞の運命決定などを、より制御された環境で探求するユニークな機会を提供します。
例えば、2024年2月には、Cell MicrosystemsがOMNI Life Scienceとの戦略的パートナーシップを発表しました。この提携は、米国およびカナダ市場に3つの革新的な発生生物学製品(CERO、CASY、TIGR)を導入することを目的としています。特にCERO 3Dは、幹細胞、スフェロイド、オルガノイド、さらには組織を含む特殊な3D細胞培養モデルの生産に最適な細胞培養環境を作り出す、画期的な新しい装置です。これにより、発生過程における複雑な細胞相互作用や形態形成のメカニズムを詳細に解明することが可能となり、先天性疾患や発生異常の原因究明にも貢献します。
**5.5. エンドユーザー別**
市場は、製薬・バイオテクノロジー企業、学術・研究機関、病院・診断ラボ、その他に分かれています。
**製薬・バイオテクノロジー企業**セグメントが市場において支配的な勢力となっています。これは主に、創薬と個別化医療に焦点を当てた研究開発への多大な投資に牽引されています。オルガノイドの有望な臨床応用は、数多くの製薬スタートアップ企業をこの革新的な分野の探求へと駆り立てています。これらの企業における前臨床創薬におけるオルガノイドの高い利用率は、セグメントの成長をさらに加速させ、市場におけるその主導的な地位を強化すると予想されます。
これらの企業が疾患のモデリングや治療反応の試験にオルガノイド技術をますます採用するにつれて、このセグメントの影響力は拡大し続け、精密医療と革新的な治療戦略の進歩への道を開くでしょう。学術・研究機関は基礎研究と技術開発を担い、病院・診断ラボは臨床応用や診断への橋渡しを行いますが、市場の規模と成長を牽引するのは、やはり大規模な研究開発投資を行う製薬・バイオテクノロジー企業です。
### 6. 地域分析
グローバルオルガノイド市場は、地域によって異なる成長パターンと動向を示しています。
**6.1. 北米**
北米のオルガノイド市場は急速な進展を遂げています。これは、学術界と産業界の間の協力関係が活発化し、オルガノイドの研究開発における革新を促進していることに大きく起因しています。主要なバイオテクノロジー企業と研究機関の強固なネットワークに加え、政府による科学研究への強力な支援と資金提供が、この成長の基盤を形成しています。また、この地域が個別化医療に重点を置いていることが、オルガノイド技術への需要をさらに推進し、北米をこの分野における革新の重要なハブとして確立しています。高度な研究インフラ、豊富な資金、そして熟練した研究者の存在が、北米市場のリーダーシップを確固たるものにしています。
**6.2. アジア太平洋**
アジア太平洋地域のオルガノイド産業は、幹細胞研究の進展と、創薬、個別化医療、疾患モデリングにおける応用が急増していることにより、急速な成長を経験しています。日本、中国、インドなどの国々がこの分野のリーダーとして台頭しており、研究開発への多大な投資によって支えられています。この勢いは、今後数年間で研究者や機関間の協力を強化し、市場の拡大をさらに推進すると予想されます。
**日本**においては、オルガノイド技術の最近の革新が神経科学研究の進歩を牽引しています。東京大学の研究者らは、軸索束を用いて研究室で培養した神経オルガノイドを接続する技術を開発し、脳の回路を模倣することに成功しました。この革新的なアプローチにより、より複雑で生理学的に関連性の高い脳様組織の作製が可能となり、脳ネットワークの形成と可塑性に対する理解が深まります。神経学的および精神医学的疾患の研究を強化することにより、この発展は日本をオルガノイド技術の最前線に位置付けています。
**6.3. ヨーロッパ**
ヨーロッパ市場もオルガノイド技術の採用と革新において顕著な進歩を見せています。
**英国**では、オルガノイド技術の最近の進歩ががん研究と治療を変革しており、2022年11月にオックスフォード大学とバーミンガム大学の研究者によって開発された骨髄オルガノイドが、英国市場の主要な推進要因となっています。この革新的なアプローチは、抗がん剤の同時スクリーニングと、患者固有のがん細胞を用いた個別化治療試験を可能にします。この進歩は、研究能力を向上させ、オルガノイド技術への需要を高めることで、市場全体の成長を牽引しています。
**ドイツ**では、政府による資金提供イニシアティブを通じた支援が重要な推進要因となっています。ドイツ研究振興協会(DFG)は、疾患モデリング、創薬、再生医療などの分野に焦点を当てたプロジェクトに資金を提供しています。同時に、フラウンホーファー細胞治療免疫学研究所のような研究センターは、科学者間の協力を促進しています。この戦略的な投資は、研究能力を進歩させるだけでなく、オルガノイド技術の開発と応用を強化し、ドイツの市場全体の成長を牽引しています。
**フランス**は、バイオテクノロジー研究開発への強力な支援により、市場における著名なプレイヤーとしての地位を確立しています。2023年には、フランス政府が健康とバイオテクノロジーに20億ユーロの投資を発表し、革新的なヘルスケアソリューションの重要性を強調しました。Insermのような研究機関は、がん治療と薬剤試験への応用を中心に、オルガノイド研究に積極的に関与しています。この協力的な環境はオルガノイド技術の進歩を促進し、フランスをこの分野のリーダーとして位置付けています。
### 7. 主要プレイヤーと戦略
オルガノイド市場の主要プレイヤーは、競争力を高め、市場の成長を推進するために、様々な戦略を採用しています。これらの戦略には、先進技術を用いた革新的な製品やサービスの開発、他社との協業、販売網の拡大、企業投資などが含まれます。
**7.1. FinalSpark:オルガノイド市場の新興プレイヤー**
FinalSparkは、細胞・遺伝子治療応用向けの革新的なソリューション開発に注力するバイオテクノロジー企業です。バイオプロセシングにおける高度な技術と専門知識を活用することで、FinalSparkは治療薬生産の効率とスケーラビリティを高め、個別化医療の進歩と再生医療における患者アウトカムの改善に貢献することを目指しています。
2024年5月、スイスのバイオコンピューティングスタートアップであるFinalSparkは、16個のヒト脳オルガノイドを使用して、いわゆる世界初の「生きたプロセッサ」、別名バイオプロセッサを開発するプロジェクト「Neuroplatform」を立ち上げました。これは、オルガノイドが単なる疾患モデルとしての役割を超え、コンピューティングや人工知能といった全く新しい分野に応用される可能性を示唆しており、市場のイノベーションの最先端を象徴するものです。
### 8. アナリストの展望
アナリストによると、グローバルオルガノイド市場は今後数年間で大幅な成長が見込まれています。この成長は、個別化医療への需要の増加と継続的な技術進歩によって推進されるでしょう。オルガノイドがヒト組織を忠実に再現する独自の能力は、創薬、疾患モデリング、再生医療において計り知れない機会を切り開きます。
より精密でスケーラブルなオルガノイドシステムの開発に向けた投資が増加していることから、市場は急速に拡大すると予想されます。さらに、進行中の臨床試験と戦略的パートナーシップは革新を推進し、オルガノイドが生物医学研究と治療開発における極めて重要な構成要素としての地位を確固たるものにするでしょう。
市場の状況が進化するにつれて、オルガノイドはより効果的で個別化された治療戦略を可能にすることにより、ヘルスケアを変革する上で不可欠な役割を果たすと私たちは予測しています。オルガノイド技術は、未来の医療を形作る上で中核的な存在となり、難病に苦しむ患者に新たな希望をもたらす可能性を秘めていると言えるでしょう。
Report Coverage & Structure
- 目次
- セグメンテーション
- 調査方法論
- 無料サンプルを入手
- 目次
- エグゼクティブサマリー
- 調査範囲とセグメンテーション
- 調査目的
- 制限と仮定
- 市場範囲とセグメンテーション
- 考慮される通貨と価格設定
- 市場機会評価
- 新興地域/国
- 新興企業
- 新興アプリケーション/最終用途
- 市場トレンド
- 推進要因
- 市場の警戒要因
- 最新のマクロ経済指標
- 地政学的影響
- 技術的要因
- 市場評価
- ポーターの5フォース分析
- バリューチェーン分析
- 規制の枠組み
- 北米
- 欧州
- アジア太平洋
- 中東およびアフリカ
- ラテンアメリカ
- ESGトレンド
- グローバル オルガノイド市場規模分析
- グローバル オルガノイド市場概要
- タイプ別
- 概要
- タイプ別金額
- 神経オルガノイド
- 金額別
- 肝臓オルガノイド
- 金額別
- 腸オルガノイド
- 金額別
- その他のオルガノイド
- 金額別
- 方法別
- 概要
- 方法別金額
- オルガノイド培養のための一般的な浸漬法
- 金額別
- 陰窩オルガノイド培養技術
- 金額別
- オルガノイド培養のための気液界面 (ALI) 法
- 金額別
- Lgr5+細胞由来のクローンオルガノイド
- 金額別
- 脳および網膜オルガノイド形成プロトコル
- 金額別
- その他
- 金額別
- ソース別
- 概要
- ソース別金額
- 一次組織
- 金額別
- 幹細胞
- 金額別
- 人工多能性幹細胞 (iPSC)
- 人工多能性幹細胞 (iPSC) 別金額
- その他
- その他別金額
- アプリケーション別
- 概要
- アプリケーション別金額
- 発生生物学
- 金額別
- 個別化医療
- 金額別
- 再生医療
- 金額別
- 疾患病理学研究
- 金額別
- 薬物毒性および有効性試験
- 金額別
- エンドユーザー別
- 概要
- エンドユーザー別金額
- 製薬およびバイオテクノロジー企業
- 金額別
- 学術および研究機関
- 金額別
- 病院および診断ラボ
- 金額別
- その他
- 金額別
- 北米市場分析
- 概要
- タイプ別
- 概要
- タイプ別金額
- 神経オルガノイド
- 金額別
- 肝臓オルガノイド
- 金額別
- 腸オルガノイド
- 金額別
- その他のオルガノイド
- 金額別
- 方法別
- 概要
- 方法別金額
- オルガノイド培養のための一般的な浸漬法
- 金額別
- 陰窩オルガノイド培養技術
- 金額別
- オルガノイド培養のための気液界面 (ALI) 法
- 金額別
- Lgr5+細胞由来のクローンオルガノイド
- 金額別
- 脳および網膜オルガノイド形成プロトコル
- 金額別
- その他
- 金額別
- ソース別
- 概要
- ソース別金額
- 一次組織
- 金額別
- 幹細胞
- 金額別
- 人工多能性幹細胞 (iPSC)
- 人工多能性幹細胞 (iPSC) 別金額
- その他
- その他別金額
- アプリケーション別
- 概要
- アプリケーション別金額
- 発生生物学
- 金額別
- 個別化医療
- 金額別
- 再生医療
- 金額別
- 疾患病理学研究
- 金額別
- 薬物毒性および有効性試験
- 金額別
- エンドユーザー別
- 概要
- エンドユーザー別金額
- 製薬およびバイオテクノロジー企業
- 金額別
- 学術および研究機関
- 金額別
- 病院および診断ラボ
- 金額別
- その他
- 金額別
- 米国
- タイプ別
- 概要
- タイプ別金額
- 神経オルガノイド
- 金額別
- 肝臓オルガノイド
- 金額別
- 腸オルガノイド
- 金額別
- その他のオルガノイド
- 金額別
- 方法別
- 概要
- 方法別金額
- オルガノイド培養のための一般的な浸漬法
- 金額別
- 陰窩オルガノイド培養技術
- 金額別
- オルガノイド培養のための気液界面 (ALI) 法
- 金額別
- Lgr5+細胞由来のクローンオルガノイド
- 金額別
- 脳および網膜オルガノイド形成プロトコル
- 金額別
- その他
- 金額別
- ソース別
- 概要
- ソース別金額
- 一次組織
- 金額別
- 幹細胞
- 金額別
- 人工多能性幹細胞 (iPSC)
- 人工多能性幹細胞 (iPSC) 別金額
- その他
- その他別金額
- アプリケーション別
- 概要
- アプリケーション別金額
- 発生生物学
- 金額別
- 個別化医療
- 金額別
- 再生医療
- 金額別
- 疾患病理学研究
- 金額別
- 薬物毒性および有効性試験
- 金額別
- エンドユーザー別
- 概要
- エンドユーザー別金額
- 製薬およびバイオテクノロジー企業
- 金額別
- 学術および研究機関
- 金額別
- 病院および診断ラボ
- 金額別
- その他
- 金額別
- カナダ
- 欧州市場分析
- 概要
- タイプ別
- 概要
- タイプ別金額
- 神経オルガノイド
- 金額別
- 肝臓オルガノイド
- 金額別
- 腸オルガノイド
- 金額別
- その他のオルガノイド
- 金額別
- 方法別
- 概要
- 方法別金額
- オルガノイド培養のための一般的な浸漬法
- 金額別
- 陰窩オルガノイド培養技術
- 金額別
- オルガノイド培養のための気液界面 (ALI) 法
- 金額別
- Lgr5+細胞由来のクローンオルガノイド
- 金額別
- 脳および網膜オルガノイド形成プロトコル
- 金額別
- その他
- 金額別
- ソース別
- 概要
- ソース別金額
- 一次組織
- 金額別
- 幹細胞
- 金額別
- 人工多能性幹細胞 (iPSC)
- 人工多能性幹細胞 (iPSC) 別金額
- その他
- その他別金額
- アプリケーション別
- 概要
- アプリケーション別金額
- 発生生物学
- 金額別
- 個別化医療
- 金額別
- 再生医療
- 金額別
- 疾患病理学研究
- 金額別
- 薬物毒性および有効性試験
- 金額別
- エンドユーザー別
- 概要
- エンドユーザー別金額
- 製薬およびバイオテクノロジー企業
- 金額別
- 学術および研究機関
- 金額別
- 病院および診断ラボ
- 金額別
- その他
- 金額別
- 英国
- タイプ別
- 概要
- タイプ別金額
- 神経オルガノイド
- 金額別
- 肝臓オルガノイド
- 金額別
- 腸オルガノイド
- 金額別
- その他のオルガノイド
- 金額別
- 方法別
- 概要
- 方法別金額
- オルガノイド培養のための一般的な浸漬法
- 金額別
- 陰窩オルガノイド培養技術
- 金額別
- オルガノイド培養のための気液界面 (ALI) 法
- 金額別
- Lgr5+細胞由来のクローンオルガノイド
- 金額別
- 脳および網膜オルガノイド形成プロトコル
- 金額別
- その他
- 金額別
- ソース別
- 概要
- ソース別金額
- 一次組織
- 金額別
- 幹細胞
- 金額別
- 人工多能性幹細胞 (iPSC)
- 人工多能性幹細胞 (iPSC) 別金額
- その他
- その他別金額
- アプリケーション別
- 概要
- アプリケーション別金額
- 発生生物学
- 金額別
- 個別化医療
- 金額別
- 再生医療
- 金額別
- 疾患病理学研究
- 金額別
- 薬物毒性および有効性試験
- 金額別
- エンドユーザー別
- 概要
- エンドユーザー別金額
- 製薬およびバイオテクノロジー企業
- 金額別
- 学術および研究機関
- 金額別
- 病院および診断ラボ
- 金額別
- その他
- 金額別
- ドイツ
- フランス
- スペイン
- イタリア
- ロシア
- 北欧
- ベネルクス
- その他の欧州
- アジア太平洋市場分析
- 概要
- タイプ別
- 概要
- タイプ別金額
- 神経オルガノイド
- 金額別
- 肝臓オルガノイド
- 金額別
- 腸オルガノイド
- 金額別
- その他のオルガノイド
- 金額別
- 方法別
- 概要
- 方法別金額
- オルガノイド培養のための一般的な浸漬法
- 金額別
- 陰窩オルガノイド培養技術
- 金額別
- オルガノイド培養のための気液界面 (ALI) 法
- 金額別
- Lgr5+細胞由来のクローンオルガノイド
- 金額別
- 脳および網膜オルガノイド形成プロトコル
- 金額別
- その他
- 金額別
- ソース別
- 概要
- ソース別金額
- 一次組織
- 金額別
- 幹細胞
- 金額別
- 人工多能性幹細胞 (iPSC)
- 人工多能性幹細胞 (iPSC) 別金額
- その他
- その他別金額
- アプリケーション別
- 概要
- アプリケーション別金額
- 発生生物学
- 金額別
- 個別化医療
- 金額別
- 再生医療
- 金額別
- 疾患病理学研究
- 金額別
- 薬物毒性および有効性試験
- 金額別
- エンドユーザー別
- 概要
- エンドユーザー別金額
- 製薬およびバイオテクノロジー企業
- 金額別
- 学術および研究機関
- 金額別
- 病院および診断ラボ
- 金額別
- その他
- 金額別
- 中国
- タイプ別
- 概要
- タイプ別金額
- 神経オルガノイド
- 金額別
- 肝臓オルガノイド
- 金額別
- 腸オルガノイド
- 金額別
- その他のオルガノイド
- 金額別
- 方法別
- 概要
- 方法別金額
- オルガノイド培養のための一般的な浸漬法
- 金額別
- 陰窩オルガノイド培養技術
- 金額別
- オルガノイド培養のための気液界面 (ALI) 法
- 金額別
- Lgr5+細胞由来のクローンオルガノイド
- 金額別
- 脳および網膜オルガノイド形成プロトコル
- 金額別
- その他
- 金額別
- ソース別
- 概要
- ソース別金額
- 一次組織
- 金額別
- 幹細胞
- 金額別
- 人工多能性幹細胞 (iPSC)
- 人工多能性幹細胞 (iPSC) 別金額
- その他
- その他別金額
- アプリケーション別
- 概要
- アプリケーション別金額
- 発生生物学
- 金額別
- 個別化医療
- 金額別
- 再生医療
- 金額別
- 疾患病理学研究
- 金額別
- 薬物毒性および有効性試験
- 金額別
- エンドユーザー別
- 概要
- エンドユーザー別金額
- 製薬およびバイオテクノロジー企業
- 金額別
- 学術および研究機関
- 金額別
- 病院および診断ラボ
- 金額別
- その他
- 金額別
- 韓国
- 日本
- インド
- オーストラリア
- 台湾
- 東南アジア
- その他のアジア太平洋
- 中東およびアフリカ市場分析
- 概要
- タイプ別
- 概要
- タイプ別金額
- 神経オルガノイド
- 金額別
- 肝臓オルガノイド
- 金額別
- 腸オルガノイド
- 金額別
- その他のオルガノイド
- 金額別
- 方法別
- 概要
- 方法別金額
- オルガノイド培養のための一般的な浸漬法
- 金額別
- 陰窩オルガノイド培養技術
- 金額別
- オルガノイド培養のための気液界面 (ALI) 法
- 金額別
- Lgr5+細胞由来のクローンオルガノイド
- 金額別
- 脳および網膜オルガノイド形成プロトコル
- 金額別
- その他
- 金額別
- ソース別
- 概要
- ソース別金額
- 一次組織
- 金額別
- 幹細胞
- 金額別
- 人工多能性幹細胞 (iPSC)
- 人工多能性幹細胞 (iPSC) 別金額
- その他
- その他別金額
- アプリケーション別
- 概要
- アプリケーション別金額
- 発生生物学
- 金額別
- 個別化医療
- 金額別
- 再生医療
- 金額別
- 疾患病理学研究
- 金額別
- 薬物毒性および有効性試験
- 金額別
- エンドユーザー別
- 概要
- エンドユーザー別金額
- 製薬およびバイオテクノロジー企業
- 金額別
- 学術および研究機関
- 金額別
- 病院および診断ラボ
- 金額別
- その他
- 金額別
- アラブ首長国連邦
- タイプ別
- 概要
- タイプ別金額
- 神経オルガノイド
- 金額別
- 肝臓オルガノイド
- 金額別
- 腸オルガノイド
- 金額別
- その他のオルガノイド
- 金額別
- 方法別
- 概要
- 方法別金額
- オルガノイド培養のための一般的な浸漬法
- 金額別
- 陰窩オルガノイド培養技術
- 金額別
- オルガノイド培養のための気液界面 (ALI) 法
- 金額別
- Lgr5+細胞由来のクローンオルガノイド
- 金額別
- 脳および網膜オルガノイド形成プロトコル
- 金額別
- その他
- 金額別
- ソース別
- 概要
- ソース別金額
- 一次組織
- 金額別
- 幹細胞
- 金額別
- 人工多能性幹細胞 (iPSC)
- 人工多能性幹細胞 (iPSC) 別金額
- その他
- その他別金額
- アプリケーション別
- 概要
- アプリケーション別金額
- 発生生物学
- 金額別
- 個別化医療
- 金額別
- 再生医療
- 金額別
- 疾患病理学研究
- 金額別
- 薬物毒性および有効性試験
- 金額別
- エンドユーザー別
- 概要
- エンドユーザー別金額
- 製薬およびバイオテクノロジー企業
- 金額別
- 学術および研究機関
- 金額別
- 病院および診断ラボ
- 金額別
- その他
- 金額別
- トルコ
- サウジアラビア
- 南アフリカ
- エジプト
- ナイジェリア
- その他のMEA
- ラテンアメリカ市場分析
- 概要
- タイプ別
- 概要
- タイプ別金額
- 神経オルガノイド
- 金額別
- 肝臓オルガノイド
- 金額別
- 腸オルガノイド
- 金額別
- その他のオルガノイド
- 金額別
- 方法別
- 概要
- 方法別金額
- オルガノイド培養のための一般的な浸漬法
- 金額別
- 陰窩オルガノイド培養技術
- 金額別
- オルガノイド培養のための気液界面 (ALI) 法
- 金額別
- Lgr5+細胞由来のクローンオルガノイド
- 金額別
- 脳および網膜オルガノイド形成プロトコル
- 金額別
- その他
- 金額別
- ソース別
- 概要
- ソース別金額
- 一次組織
- 金額別
- 幹細胞
- 金額別
- 人工多能性幹細胞 (iPSC)
- 人工多能性幹細胞 (iPSC) 別金額
- その他
- その他別金額
- アプリケーション別
- 概要
- アプリケーション別金額
- 発生生物学
- 金額別
- 個別化医療
- 金額別
- 再生医療
- 金額別
- 疾患病理学研究
- 金額別
- 薬物毒性および有効性試験
- 金額別
- エンドユーザー別
- 概要
- エンドユーザー別金額
- 製薬およびバイオテクノロジー企業
- 金額別
- 学術および研究機関
- 金額別
- 病院および診断ラボ
- 金額別
- その他
- 金額別
- ブラジル
- タイプ別
- 概要
- タイプ別金額
- 神経オルガノイド
- 金額別
- 肝臓オルガノイド
- 金額別
- 腸オルガノイド
- 金額別
- その他のオルガノイド
- 金額別
- 方法別
- 概要
- 方法別金額
- オルガノイド培養のための一般的な浸漬法
- 金額別
- 陰窩オルガノイド培養技術
- 金額別
- オルガノイド培養のための気液界面 (ALI) 法
- 金額別
- Lgr5+細胞由来のクローンオルガノイド
- 金額別
- 脳および網膜オルガノイド形成プロトコル
- 金額別
- その他
- 金額別
- ソース別
- 概要
- ソース別金額
- 一次組織
- 金額別
- 幹細胞
- 金額別
- 人工多能性幹細胞 (iPSC)
- 人工多能性幹細胞 (iPSC) 別金額
- その他
- その他別金額
- アプリケーション別
- 概要
- アプリケーション別金額
- 発生生物学
- 金額別
- 個別化医療
- 金額別
- 再生医療
- 金額別
- 疾患病理学研究
- 金額別
- 薬物毒性および有効性試験
- 金額別
- エンドユーザー別
- 概要
- エンドユーザー別金額
- 製薬およびバイオテクノロジー企業
- 金額別
- 学術および研究機関
- 金額別
- 病院および診断ラボ
- 金額別
- その他
- 金額別
- メキシコ
- アルゼンチン
- チリ
- コロンビア
- その他のラテンアメリカ
- 競争環境
- オルガノイド市場のプレイヤー別シェア
- M&A契約および協業分析
- 市場プレイヤー評価
- Mimetas
- 概要
- 事業情報
- 収益
- ASP
- SWOT分析
- 最近の動向
- DefiniGen
- PreComb
- Axol Biosciences
- Danaher Corporation (Cellesce & Molecular Devices)
- Newcells
- Crown Biosciences
- Ncardia
- Cell Microsystems
- Corning Incorporated
- AMS Biotechnology (Europe) Limited
- Greiner Bio-One
- Hubrecht Organoid Technology (HUB)
- Organovo, Inc.
- InSphero
- 調査方法論
- 調査データ
- 二次データ
- 主要な二次情報源
- 二次情報源からの主要データ
- 一次データ
- 一次情報源からの主要データ
- 一次情報の内訳
- 二次および一次調査
- 主要な業界インサイト
- 市場規模推定
- ボトムアップアプローチ
- トップダウンアプローチ
- 市場予測
- 調査の仮定
- 仮定
- 制限事項
- リスク評価
- 付録
- ディスカッションガイド
- カスタマイズオプション
- 関連レポート
- 免責事項
*** 本調査レポートに関するお問い合わせ ***

オルガノイドとは、多能性幹細胞や組織幹細胞を三次元的に培養することで、生体内の特定の臓器に似た構造と機能を自己組織化によって形成させた、数百マイクロメートルから数ミリメートル程度の微小な臓器モデルを指します。これらの細胞は、特定の培養条件下で増殖し、互いに相互作用しながら、本来の臓器が持つ細胞の種類や組織構造、さらには一部の機能までを再現することが可能になります。生体外で複雑な臓器の機能を模倣できるため、従来の二次元培養細胞や動物モデルでは難しかった、より生体に近い環境での研究を可能にする画期的な技術として注目を集めています。
オルガノイドには様々な種類があり、研究対象となる臓器に応じて多岐にわたるモデルが開発されています。例えば、脳オルガノイドは、大脳皮質の層構造や神経細胞の活動を再現し、脳の発達メカニズムや神経疾患の病態解明に用いられます。腸オルガノイドは、小腸や大腸の上皮構造、吸収機能、さらに幹細胞ニッチの維持を模倣し、消化器疾患や感染症、腸内細菌との相互作用の研究に貢献しています。その他にも、肝臓オルガノイドは薬物代謝機能や肝疾患モデルとして、腎臓オルガノイドは腎臓の発生や疾患メカニズムの解明に、膵臓オルガノイドは糖尿病や膵臓がんの研究に利用されています。近年では、肺、胃、網膜、心臓などのオルガノイドも作製されており、単一の臓器だけでなく、複数のオルガノイドを組み合わせた多臓器連携システム(いわゆる「body-on-a-chip」)の研究も進展し、より複雑な生体応答の再現が試みられています。
オルガノイドの主な用途は多岐にわたります。まず、疾患モデルとしての活用が挙げられます。遺伝性疾患、がん、感染症、神経変性疾患など、多様な病気の病態生理をオルガノイド上で再現し、疾患メカニズムの解明や新たな治療法の探索が行われています。特に、患者由来のiPS細胞から作製されたオルガノイドは、個々の患者の遺伝的背景を反映した「疾患オルガノイド」として、パーソナライズ医療の実現に向けた研究基盤となっています。次に、創薬スクリーニングへの応用です。新薬候補物質の有効性や毒性を、より生体に近い環境で評価できるため、開発期間の短縮や成功率の向上に寄与すると期待されています。従来の動物実験では見過ごされがちなヒト特異的な薬物応答や副作用の検出にも有効です。さらに、発生生物学の研究ツールとしても非常に強力です。臓器がどのように形成され、成熟していくのかという複雑な過程を、体外で段階的に観察できるため、初期発生のメカニズム解明に貢献しています。将来的には、再生医療への応用も期待されており、損傷した臓器の修復や、移植用臓器の供給源としての可能性も模索されていますが、そのためには血管網の構築や成熟度の向上など、まだ多くの課題が残されています。また、環境化学物質などの毒性試験や、宇宙生物学における微小重力環境下での細胞挙動研究など、幅広い分野での活用が進められています。
オルガノイド技術を支える関連技術も多岐にわたります。その根幹にあるのは、多能性幹細胞(ES細胞やiPS細胞)や組織幹細胞を分離、培養し、特定の細胞へと分化誘導する幹細胞技術です。特にiPS細胞の登場は、患者特異的なオルガノイドの作製を可能にし、疾患研究に革命をもたらしました。また、オルガノイドを三次元的に培養するための技術も不可欠です。細胞の足場となるマトリゲルやハイドロゲルといった生体模倣材料、栄養供給や酸素供給を最適化するためのバイオリアクター、そして微細加工技術を駆使して血管網や複数の臓器間連携を再現するマイクロ流体デバイス(organ-on-a-chip)などが開発されています。さらに、ゲノム編集技術であるCRISPR/Cas9システムは、オルガノイドの遺伝子を自在に操作し、疾患関連遺伝子の導入や修復、レポーター遺伝子の導入などに用いられ、機能解析や疾患モデル作製を加速させています。オルガノイドが持つ細胞の多様性や分化経路を詳細に解析するためには、シングルセル解析技術が用いられ、個々の細胞の遺伝子発現プロファイルを明らかにします。最後に、オルガノイドの形態形成や機能動態をリアルタイムで観察するための高度なイメージング技術、例えば蛍光顕微鏡、共焦点顕微鏡、光シート顕微鏡なども、オルガノイド研究の進展に不可欠な要素となっています。これらの技術の融合により、オルガノイドは生命科学研究の新たなフロンティアを切り開いています。