バイオプロセスバリデーション市場規模と展望, 2025年~2033年

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
**バイオプロセスバリデーション市場の包括的概要**
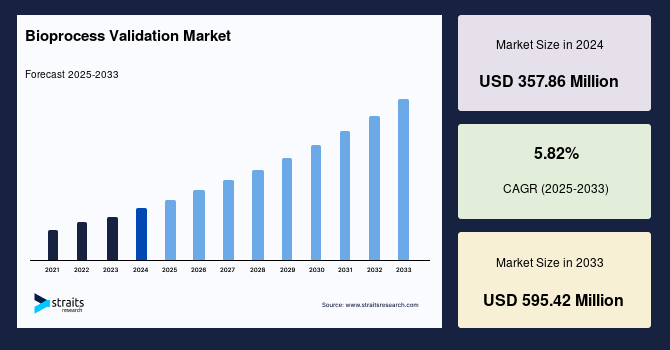
世界の**バイオプロセスバリデーション**市場は、厳格な安全性および品質基準、そして**バイオプロセスバリデーション**のアウトソーシング需要の増大といった主要因に牽引され、着実な成長を遂げています。2024年には3億5786万米ドルの市場規模であったものが、2025年には3億7868万米ドルに成長し、2033年までには5億9542万米ドルに達すると予測されており、予測期間(2025年~2033年)における年平均成長率(CAGR)は5.82%と見込まれています。
**バイオプロセスバリデーション**とは、バイオ製品の生産サイクル全体を通じて行われる様々な活動の総称であり、主に原薬(API)やその他の潜在的な汚染物質の検査を含みます。これは、動物用医薬品やその他の生物学的製品の開発および製造プロセスにおいて不可欠な評価であり、科学的に厳密かつ十分に文書化された方法論を通じて、特定のプロセスが所定の仕様および品質特性を満たす製品を一貫して生産できるという高度な保証を提供するものです。各プロジェクト段階で正確なデータが収集、レビュー、文書化されることにより、プロセスが一貫して高品質な製品を生み出すことができるという科学的証拠が確立されます。この検証活動は、運用および生産におけるほぼすべてのバイオプロセシング関連産業活動に影響を与え、例えば、新型コロナウイルスワクチンの製造においても多数のバイオプロセシング技術が活用されています。ライフサイエンス分野における研究開発費の増加も市場拡大を後押しする要因となっています。
**市場の推進要因 (Market Drivers)**
**バイオプロセスバリデーション**市場の成長を促進する主な要因は多岐にわたります。
1. **厳格な安全性および品質基準の遵守:**
バイオ製品の製造プロセスは、均一な品質特性を持つ製品を提供することを目的として設計されています。これには、エンドトキシン、ウイルス、細胞膜、核酸、タンパク質、培地成分、プロセス化学物質、リガンド、製品改変凝集体、不活性形態など、クロマトグラフィー媒体からの不純物や汚染物質の除去が含まれます。製造プロセスは、使用される方法と各機器が効果的であることを示す、科学的に厳密で十分に文書化された検証を通じて確認される必要があります。
米国食品医薬品局(FDA)の「プロセスバリデーションの一般原則に関するガイドライン」では、プロセスバリデーションを「特定のプロセスが所定の仕様と品質特性を満たす製品を一貫して生産できるという高度な保証を提供するために、文書化された証拠を構築すること」と定義しています。また、バイオ医薬品の品質を保証するためには、物理的、化学的、生物学的、微生物学的な試験特性である重要品質特性(CQA)が許容範囲内で管理されなければなりません。これらの厳格な要件が、**バイオプロセスバリデーション**市場を強力に推進しています。
製薬業界において、**バイオプロセスバリデーション**はFDAや欧州医薬品庁(EMA)の国内外の基準への準拠が不可欠であるため、統合されたプロセスとなっています。バリデーションは、すべての手順が規定されたcGMP(現行適正製造基準)要件に準拠していることを確認します。いかなるバリデーション方法も、標準作業手順書および継続的な活動に準拠した詳細な文書化を必要とします。
2. **バイオプロセスバリデーションのアウトソーシングニーズの増大:**
医薬品製造は、生産収量を向上させるために、現在、サードパーティのサービスプロバイダーにアウトソーシングされるケースが増えています。これは、企業がコアコンピタンスに集中し、コスト効率を高めるための戦略的な動きです。
医薬品開発における使い捨て技術の普及も、生産コストの削減に貢献しています。シングルユースバイオリアクターは、プロセスの適応性を高め、交差汚染の可能性を劇的に低減しました。これにより、信頼性の高い製品が迅速に市場に投入されることが可能になります。
さらに、製薬企業は、急速に拡大する情報、進歩する技術、不安定な経済の中で競争力と柔軟性を維持するために、研究活動を学術機関やCRO(医薬品開発業務受託機関)にアウトソーシングしています。これらのアウトソーシングのトレンドは、専門的な**バイオプロセスバリデーション**サービスへの需要を増幅させ、市場シェアの拡大を後押ししています。
3. **バイオ医薬品需要の増加とライフサイエンス研究開発費の上昇:**
バイオ医薬品の需要が増加するにつれて、それらの製造プロセスにおける品質と安全性を保証するための**バイオプロセスバリデーション**の重要性も増しています。また、ライフサイエンス分野における研究開発費の増加は、新しいバイオ製品や治療法の開発を促進し、それぞれの製品が市場に投入される前に厳格な検証プロセスを経る必要があるため、市場拡大の原動力となります。
**市場の抑制要因 (Market Restraints)**
市場の拡大を制限する可能性のある要因も存在します。
1. **抽出物および浸出物に関連する問題:**
医薬品および食品分野では、抽出または浸出プロセスによって生成される微量の汚染物質に対処する際の困難が認識されています。FDAやEMEA(欧州医薬品評価庁)の厳格な規制があるにもかかわらず、企業がこれらの問題を見過ごし、患者や消費者の生命を危険にさらすリスクは依然として存在します。
抽出物(Extractables)および浸出物(Leachables)は、製薬メーカーや規制当局にとってますます懸念される問題となっています。ガラス、プラスチックボトル、フォイルパウチ、梱包材、ラベリングインクなど、あらゆる医薬品の包装および容器システムは、医薬品または食品成分に望ましくない汚染物質を浸出させる可能性があります。特に、経口および経口薬製品、非経口および眼科用製品は、より重大なリスクを伴うことが多いため、これらの問題への対処は**バイオプロセスバリデーション**における大きな課題となっています。
**市場の機会 (Market Opportunities)**
**バイオプロセスバリデーション**市場には、いくつかの有望な拡大機会があります。
1. **バイオ製品の特許切れ:**
主要なバイオ製品の特許切れは、バイオシミラー製品の開発と市場投入を加速させます。バイオシミラーは、既存の参照バイオ製品と高い類似性を示す必要がありますが、その安全性、品質、有効性を証明するためには、独自の包括的な**バイオプロセスバリデーション**が不可欠です。これにより、市場全体の検証活動の需要が増加し、サービスプロバイダーにとって新たなビジネスチャンスが生まれます。
2. **新興市場への参入:**
可処分所得の増加と新しい検査サービス法規の導入により、発展途上国では**バイオプロセスバリデーション**サービスの未開拓市場が多数出現する可能性があります。インドや中国などの国々は、製造コストの低さと生産能力の高さから、新たな産業ハブとなりつつあります。アジアにおける急速な工業化と経済成長は、世界の**バイオプロセスバリデーション**市場に大きな影響を与え、成長機会を提供すると予測されます。これらの地域では、医薬品製造の規模が拡大し、それに伴い厳格な品質管理と検証の必要性が高まっているため、市場の潜在力は非常に大きいと言えます。
**セグメント分析 (Segment Analysis)**
世界の**バイオプロセスバリデーション**市場は、試験タイプ、プロセスコンポーネント、エンドユーザー、および地域に基づいて分類されます。
**1. 試験タイプ別:**
* **抽出物試験サービス (Extractable Testing Services):**
このセグメントは、予測期間中に4.8%のCAGRで成長し、最大の市場シェアを占めると予測されています。医薬品開発プロセスにおいて、容器閉鎖システム、医療機器、医療機器包装、プロセス機器および包装から医薬品に移行し、潜在的に有害な浸出物となる様々な化学物質を特定し定量化することは極めて重要です。規制当局は、製品の不純物混入のリスクを検出するために、抽出物試験を要求しています。
抽出物研究は、調査対象の医薬品容器または閉鎖系、材料と抽出溶媒との適合性、容器の種類、容器と医薬品の接触の種類、保管条件、特定の投与または再構成手順、医薬品の種類、投与経路、投与計画、および関連する閾値要件など、様々な要素に合わせて最適化され、調整されるように設計されています。この複雑性と規制の厳しさが、このセグメントの市場を牽引しています。
* **完全性試験サービス (Integrity Testing Services):**
このセグメントは、2番目に大きなシェアを占めます。滅菌フィルターの完全性試験は、製薬業界における重要なプロセスろ過アプリケーションにとって必須です。FDAの規制に従い、大量非経口製剤(LVP)や少量非経口製剤(SVP)などの無菌溶液の処理に使用されるフィルターは、完全性試験を受けなければなりません。さらに、**バイオプロセスバリデーション**市場に導入される新技術は、規制当局が要求する最高レベルのデータ完全性を含む正確な結果を提供できるため、このセグメントの重要性は高まっています。
**2. プロセスコンポーネント別:**
* **フィルターエレメント (Filter Elements):**
このセグメントは、6.5%のCAGRで成長し、最大の市場シェアを占めると予測されています。バイオプロセシング産業において、ろ過は組換えタンパク質、ワクチン、遺伝子治療、細胞治療製品などのバイオ治療薬の分離、単離、精製のための従来の単位操作または他の単位操作にとって極めて重要なステップです。バイオプロセシングでは、フィルターはダウンストリームの単位操作としてだけでなく、実質的に他のすべてのステップをサポートするためにも利用されます。
バイオ医薬品の安全性と有効性、バイオ医薬品に対する厳格な規制と業界標準、バイオプロセシングにおける様々なフィルターの使用増加、および特定のフィルターエレメントの評価とその最終医薬品への影響に対する高い需要が、**バイオプロセスバリデーション**におけるフィルターエレメント市場を牽引する主要因となっています。
* **バイオリアクター (Bioreactors):**
このセグメントは、2番目に大きなシェアを占めます。バイオリアクターはバイオプロセシングワークフローの不可欠な部分であり、戦略的な利点として考慮されるべきです。この基本的な技術は、現在および将来にわたって慎重に選択、指定、設計、およびサポートされる必要があります。バイオロジクスを生成する際、シングルユースバイオリアクターは、設備投資の削減、運用コストの削減、および環境フットプリントの縮小を提供できます。さらに、従来のステンレス製リアクターと比較して、より多くの小規模バッチをより短い時間で製造する柔軟性を提供するため、その検証需要は堅調です。
**3. エンドユーザー別:**
* **製薬・バイオテクノロジー企業 (Pharmaceutical & Biotechnology Companies):**
このセグメントは、6%のCAGRで成長し、最大の市場シェアを占めると予測されています。製薬・バイオテクノロジー分野の企業は、製品および患者の安全性を維持しながら、製造能力を迅速かつ費用対効果の高い方法で増強するという課題を抱えています。FDAおよびEMAの国内外の基準を満たす必要があるため、**バイオプロセスバリデーション**は製薬・バイオテクノロジー分野の不可欠な部分です。
製薬・バイオテクノロジー企業における生産プロセスの各段階は、人々が日常的に依存する医薬品の絶対的な保護を保証するために、厳密に試験される一連の手順と調整で構成されています。**バイオプロセスバリデーション**は、絶えず進化する品質要件とダイナミックな市場の動きとの間のギャップを埋めるのに役立ちます。
* **受託開発製造機関 (CDMOs: Contract Development & Manufacturing Organizations):**
このセグメントは、2番目に大きなシェアを占めます。CDMOは、製薬およびバイオテクノロジー産業に医薬品開発および製造サービスを提供します。製剤スクリーニングおよび開発、分析開発、安定性試験、前臨床安全性評価試験から、無菌および非無菌生産、包装および物流を含む治験薬まで、CDMOは幅広い製品タイプ、デリバリーシステム、剤形の開発および製造を迅速化するための包括的なソリューションを提供します。彼らの専門知識と統合されたサービスは、バイオプロセス検証の需要を外部にシフトさせ、市場における重要な役割を担っています。
**地域分析 (Regional Analysis)**
世界の**バイオプロセスバリデーション**市場の地域別セグメンテーションには、北米、ヨーロッパ、アジア太平洋、LAMEA(ラテンアメリカ、中東、アフリカ)が含まれます。
* **北米:**
北米は、最大の市場シェアを占め、4.9%のCAGRで成長すると予測されています。この地域における**バイオプロセスバリデーション**市場は、**バイオプロセスバリデーション**のアウトソーシング需要の増加、バイオロジクスに特化したライフサイエンス研究の増加、製薬およびバイオテクノロジー企業の投資の増加により、継続的に成長しています。
さらに、北米の**バイオプロセスバリデーション**市場は十分に確立されており、国内の製薬およびバイオテクノロジー企業による試験が増加しています。米国政府はバリデーションサービスへの資金提供を増やしており、Danaher Corporation、Thermo Fisher Scientific, Inc.、Toxikon Corporation、Eurofins、Meissner Filtration Products, Inc.などの主要企業の強力な存在感が、この地域の市場成長をさらに支えています。
* **ヨーロッパ:**
ヨーロッパ市場は5.8%のCAGRで成長し、1億3000万米ドルを保持すると予測されています。この市場は、新しい試験サービスの数の増加、英国、フランス、ドイツなどの国々における医療インフラの発展、および**バイオプロセスバリデーション**の成長の結果として急速に拡大しています。規制当局の承認、製品発売、サービスの増加、および主要分野における政府資金の利用可能性が、世界の**バイオプロセスバリデーション**産業を前進させると予想されます。
例えば、2020年には、Almac Groupがバイオロジクス試験ソリューションを導入しました。これは、FDA、EMA、PMDAなどの業界要件に準拠し、GMP基準の下でクライアントの医薬品開発プログラムをサポートするための包括的でカスタマイズ可能な医薬品試験サービスを提供します。Almac Group、Sartorius、Porvair Plc、Merck KGaAなどの**バイオプロセスバリデーション**企業の強力な存在感も、市場成長に引き続き影響を与えています。
* **アジア太平洋およびLAMEA:**
アジア太平洋地域は、インドや中国などの新興経済国における急速な工業化と経済成長により、新たな産業ハブとしての地位を確立しつつあり、**バイオプロセスバリデーション**市場に大きな成長機会を提供すると期待されています。可処分所得の増加と新しい検査サービス法規の実施は、これらの地域における市場のさらなる拡大を促進するでしょう。
結論として、世界の**バイオプロセスバリデーション**市場は、厳格な規制環境、バイオ医薬品需要の増加、技術革新、そしてアウトソーシングのトレンドにより、今後も堅調な成長が見込まれます。抽出物および浸出物に関する課題は存在するものの、特許切れバイオ製品や新興市場への注力は、将来的な市場拡大のための重要な機会となるでしょう。
Report Coverage & Structure
- セグメンテーション
- 調査方法
- 無料サンプルを入手
- 目次
- エグゼクティブサマリー
- 調査範囲 & セグメンテーション
- 調査目的
- 制限 & 前提
- 市場範囲 & セグメンテーション
- 考慮される通貨 & 価格設定
- 市場機会評価
- 新興地域/国
- 新興企業
- 新興アプリケーション/最終用途
- 市場トレンド
- 推進要因
- 市場警戒要因
- 最新のマクロ経済指標
- 地政学的影響
- テクノロジー要因
- 市場評価
- ポーターの5つの力分析
- バリューチェーン分析
- 規制の枠組み
- 北米
- 欧州
- アジア太平洋
- 中東およびアフリカ
- ラテンアメリカ
- ESGトレンド
- グローバル バイオプロセスバリデーション市場規模分析
- グローバル バイオプロセスバリデーション市場概要
- テストタイプ別
- 概要
- テストタイプ別(金額ベース)
- 溶出物試験サービス
- 金額ベース
- 微生物試験サービス
- 金額ベース
- 理化学試験サービス
- 金額ベース
- 完全性試験サービス
- 金額ベース
- 適合性試験サービス
- 金額ベース
- その他の試験サービス
- 金額ベース
- プロセスコンポーネント別
- 概要
- プロセスコンポーネント別(金額ベース)
- フィルターエレメント
- 金額ベース
- バイオリアクター
- 金額ベース
- その他のプロセスコンポーネント
- 金額ベース
- 最終用途別
- 概要
- 最終用途別(金額ベース)
- 製薬 & バイオテクノロジー企業
- 金額ベース
- 医薬品受託開発製造機関(CDMO)
- 金額ベース
- 北米市場分析
- 概要
- テストタイプ別
- 概要
- テストタイプ別(金額ベース)
- 溶出物試験サービス
- 金額ベース
- 微生物試験サービス
- 金額ベース
- 理化学試験サービス
- 金額ベース
- 完全性試験サービス
- 金額ベース
- 適合性試験サービス
- 金額ベース
- その他の試験サービス
- 金額ベース
- プロセスコンポーネント別
- 概要
- プロセスコンポーネント別(金額ベース)
- フィルターエレメント
- 金額ベース
- バイオリアクター
- 金額ベース
- その他のプロセスコンポーネント
- 金額ベース
- 最終用途別
- 概要
- 最終用途別(金額ベース)
- 製薬 & バイオテクノロジー企業
- 金額ベース
- 医薬品受託開発製造機関(CDMO)
- 金額ベース
- 米国
- テストタイプ別
- 概要
- テストタイプ別(金額ベース)
- 溶出物試験サービス
- 金額ベース
- 微生物試験サービス
- 金額ベース
- 理化学試験サービス
- 金額ベース
- 完全性試験サービス
- 金額ベース
- 適合性試験サービス
- 金額ベース
- その他の試験サービス
- 金額ベース
- プロセスコンポーネント別
- 概要
- プロセスコンポーネント別(金額ベース)
- フィルターエレメント
- 金額ベース
- バイオリアクター
- 金額ベース
- その他のプロセスコンポーネント
- 金額ベース
- 最終用途別
- 概要
- 最終用途別(金額ベース)
- 製薬 & バイオテクノロジー企業
- 金額ベース
- 医薬品受託開発製造機関(CDMO)
- 金額ベース
- カナダ
- 欧州市場分析
- 概要
- テストタイプ別
- 概要
- テストタイプ別(金額ベース)
- 溶出物試験サービス
- 金額ベース
- 微生物試験サービス
- 金額ベース
- 理化学試験サービス
- 金額ベース
- 完全性試験サービス
- 金額ベース
- 適合性試験サービス
- 金額ベース
- その他の試験サービス
- 金額ベース
- プロセスコンポーネント別
- 概要
- プロセスコンポーネント別(金額ベース)
- フィルターエレメント
- 金額ベース
- バイオリアクター
- 金額ベース
- その他のプロセスコンポーネント
- 金額ベース
- 最終用途別
- 概要
- 最終用途別(金額ベース)
- 製薬 & バイオテクノロジー企業
- 金額ベース
- 医薬品受託開発製造機関(CDMO)
- 金額ベース
- 英国
- テストタイプ別
- 概要
- テストタイプ別(金額ベース)
- 溶出物試験サービス
- 金額ベース
- 微生物試験サービス
- 金額ベース
- 理化学試験サービス
- 金額ベース
- 完全性試験サービス
- 金額ベース
- 適合性試験サービス
- 金額ベース
- その他の試験サービス
- 金額ベース
- プロセスコンポーネント別
- 概要
- プロセスコンポーネント別(金額ベース)
- フィルターエレメント
- 金額ベース
- バイオリアクター
- 金額ベース
- その他のプロセスコンポーネント
- 金額ベース
- 最終用途別
- 概要
- 最終用途別(金額ベース)
- 製薬 & バイオテクノロジー企業
- 金額ベース
- 医薬品受託開発製造機関(CDMO)
- 金額ベース
- ドイツ
- フランス
- スペイン
- イタリア
- ロシア
- 北欧
- ベネルクス
- その他の欧州
- アジア太平洋市場分析
- 概要
- テストタイプ別
- 概要
- テストタイプ別(金額ベース)
- 溶出物試験サービス
- 金額ベース
- 微生物試験サービス
- 金額ベース
- 理化学試験サービス
- 金額ベース
- 完全性試験サービス
- 金額ベース
- 適合性試験サービス
- 金額ベース
- その他の試験サービス
- 金額ベース
- プロセスコンポーネント別
- 概要
- プロセスコンポーネント別(金額ベース)
- フィルターエレメント
- 金額ベース
- バイオリアクター
- 金額ベース
- その他のプロセスコンポーネント
- 金額ベース
- 最終用途別
- 概要
- 最終用途別(金額ベース)
- 製薬 & バイオテクノロジー企業
- 金額ベース
- 医薬品受託開発製造機関(CDMO)
- 金額ベース
- 中国
- テストタイプ別
- 概要
- テストタイプ別(金額ベース)
- 溶出物試験サービス
- 金額ベース
- 微生物試験サービス
- 金額ベース
- 理化学試験サービス
- 金額ベース
- 完全性試験サービス
- 金額ベース
- 適合性試験サービス
- 金額ベース
- その他の試験サービス
- 金額ベース
- プロセスコンポーネント別
- 概要
- プロセスコンポーネント別(金額ベース)
- フィルターエレメント
- 金額ベース
- バイオリアクター
- 金額ベース
- その他のプロセスコンポーネント
- 金額ベース
- 最終用途別
- 概要
- 最終用途別(金額ベース)
- 製薬 & バイオテクノロジー企業
- 金額ベース
- 医薬品受託開発製造機関(CDMO)
- 金額ベース
- 韓国
- 日本
- インド
- オーストラリア
- 台湾
- 東南アジア
- その他のアジア太平洋
- 中東およびアフリカ市場分析
- 概要
- テストタイプ別
- 概要
- テストタイプ別(金額ベース)
- 溶出物試験サービス
- 金額ベース
- 微生物試験サービス
- 金額ベース
- 理化学試験サービス
- 金額ベース
- 完全性試験サービス
- 金額ベース
- 適合性試験サービス
- 金額ベース
- その他の試験サービス
- 金額ベース
- プロセスコンポーネント別
- 概要
- プロセスコンポーネント別(金額ベース)
- フィルターエレメント
- 金額ベース
- バイオリアクター
- 金額ベース
- その他のプロセスコンポーネント
- 金額ベース
- 最終用途別
- 概要
- 最終用途別(金額ベース)
- 製薬 & バイオテクノロジー企業
- 金額ベース
- 医薬品受託開発製造機関(CDMO)
- 金額ベース
- アラブ首長国連邦
- テストタイプ別
- 概要
- テストタイプ別(金額ベース)
- 溶出物試験サービス
- 金額ベース
- 微生物試験サービス
- 金額ベース
- 理化学試験サービス
- 金額ベース
- 完全性試験サービス
- 金額ベース
- 適合性試験サービス
- 金額ベース
- その他の試験サービス
- 金額ベース
- プロセスコンポーネント別
- 概要
- プロセスコンポーネント別(金額ベース)
- フィルターエレメント
- 金額ベース
- バイオリアクター
- 金額ベース
- その他のプロセスコンポーネント
- 金額ベース
- 最終用途別
- 概要
- 最終用途別(金額ベース)
- 製薬 & バイオテクノロジー企業
- 金額ベース
- 医薬品受託開発製造機関(CDMO)
- 金額ベース
- トルコ
- サウジアラビア
- 南アフリカ
- エジプト
- ナイジェリア
- その他の中東およびアフリカ
- ラテンアメリカ市場分析
- 概要
- テストタイプ別
- 概要
- テストタイプ別(金額ベース)
- 溶出物試験サービス
- 金額ベース
- 微生物試験サービス
- 金額ベース
- 理化学試験サービス
- 金額ベース
- 完全性試験サービス
- 金額ベース
- 適合性試験サービス
- 金額ベース
- その他の試験サービス
- 金額ベース
- プロセスコンポーネント別
- 概要
- プロセスコンポーネント別(金額ベース)
- フィルターエレメント
- 金額ベース
- バイオリアクター
- 金額ベース
- その他のプロセスコンポーネント
- 金額ベース
- 最終用途別
- 概要
- 最終用途別(金額ベース)
- 製薬 & バイオテクノロジー企業
- 金額ベース
- 医薬品受託開発製造機関(CDMO)
- 金額ベース
- ブラジル
- テストタイプ別
- 概要
- テストタイプ別(金額ベース)
- 溶出物試験サービス
- 金額ベース
- 微生物試験サービス
- 金額ベース
- 理化学試験サービス
- 金額ベース
- 完全性試験サービス
- 金額ベース
- 適合性試験サービス
- 金額ベース
- その他の試験サービス
- 金額ベース
- プロセスコンポーネント別
- 概要
- プロセスコンポーネント別(金額ベース)
- フィルターエレメント
- 金額ベース
- バイオリアクター
- 金額ベース
- その他のプロセスコンポーネント
- 金額ベース
- 最終用途別
- 概要
- 最終用途別(金額ベース)
- 製薬 & バイオテクノロジー企業
- 金額ベース
- 医薬品受託開発製造機関(CDMO)
- 金額ベース
- メキシコ
- アルゼンチン
- チリ
- コロンビア
- その他のラテンアメリカ
- 競争環境
- バイオプロセスバリデーション市場のプレイヤー別シェア
- M&A契約 & 提携分析
- 市場プレイヤー評価
- アルマックグループ
- 概要
- 事業情報
- 収益
- 平均販売価格
- SWOT分析
- 最近の動向
- バイオジーン
- コベッター・フィルトレーション・イクイップメント株式会社
- ダナハーコーポレーション(ポールコーポレーション)
- メルクKGaA
- マイスナー・フィルトレーション・プロダクツ株式会社
- ポーベア・ピーエルシー
- ザルトリウス
- サーモフィッシャーサイエンティフィック株式会社
- トキシコンコーポレーション
- 調査方法
- 調査データ
- 二次データ
- 主要な二次情報源
- 二次情報源からの主要データ
- 一次データ
- 一次情報源からの主要データ
- 一次情報の内訳
- 二次および一次調査
- 主要な業界インサイト
- 市場規模の推定
- ボトムアップアプローチ
- トップダウンアプローチ
- 市場予測
- 調査の前提
- 前提
- 制限
- リスク評価
- 付録
- ディスカッションガイド
- カスタマイズオプション
- 関連レポート
- 免責事項
*** 本調査レポートに関するお問い合わせ ***

バイオプロセスバリデーションは、医薬品、特にバイオ医薬品の製造プロセスにおいて、一貫して高品質な製品を生産できることを科学的かつ文書的に証明する体系的な活動でございます。これは製品の安全性、有効性、そして品質を保証するための極めて重要なプロセスであり、規制当局からの承認を得るためにも不可欠な要件となっております。常に所定の品質基準を満たし、患者様に安心して提供できる製品を確実にするための基盤を築くものです。
このバリデーションの主な目的は、特定の製造プロセスが、設計された意図通りに機能し、期待される結果を再現性高く達成できることを検証することにあります。原材料の受け入れから最終製品の出荷に至るまでの各工程、例えば培養、精製、ろ過、充填など、全ての段階において、あらかじめ設定された管理戦略が適切に機能していることを確認いたします。これにより、工程中の変動要因を特定し、効果的に管理することで、製品の品質に対するリスクを最小限に抑えることが可能となります。
バイオプロセスバリデーションには多岐にわたる種類が存在いたします。まず、製造プロセスの性能そのものを評価する「プロセスバリデーション」があり、これは工程が安定稼働し、所望の品質特性を持つ製品を継続的に生産できることを実証いたします。次に、製造設備や容器が適切に洗浄され、次のバッチに汚染をもたらさないことを確認する「洗浄バリデーション」が重要です。さらに、製品の品質評価に用いられる試験法が正確性、再現性、特異性などを有することを証明する「分析法バリデーション」も欠かせません。
また、製造環境を支えるインフラストラクチャーもバリデーションの重要な対象です。「設備・ユーティリティバリデーション」では、培養槽、クロマトグラフィーシステム、滅菌装置などの設備、そして清浄な空気、精製水、注射用水、蒸気といったユーティリティが、定められた仕様通りに機能することを確認いたします。さらに、製造プロセスの監視やデータ管理に用いられるソフトウェアやシステムが正確かつ安全に動作することを保証する「コンピュータシステムバリデーション」も現代のバイオ医薬品製造では極めて重要でございます。これら全てが最終製品の品質に影響を及ぼすため、包括的な検証が求められます。
バイオプロセスバリデーションは、単独の活動ではなく、関連する多くの技術や概念と連携して実施されることが一般的です。製品開発の初期段階から品質を設計に組み込む「Quality by Design (QbD)」の考え方は、バリデーション計画策定の重要な指針となります。また、製造工程中のリアルタイムなデータ収集と分析を可能にする「Process Analytical Technology (PAT)」は、プロセスの理解を深め、より効果的なバリデーション戦略の立案に貢献いたします。統計的手法を用いたデータ解析やリスクアセスメントも不可欠であり、国際的なICHガイドラインや各国のGMP規制に則って実施されることが一般的でございます。
このように、バイオプロセスバリデーションは、医薬品製造における品質保証の根幹をなす活動であり、患者様の健康と安全を守る上で極めて重要な役割を担っております。科学的なアプローチに基づき、厳格な文書化と継続的な監視を通じて、製品のライフサイクル全体にわたる品質の一貫性を保証し、信頼性の高い医薬品供給体制を確立するために不可欠なプロセスでございます。