NGSサンプル調製市場:市場規模・シェア分析 – 成長動向と予測 (2025-2030年)
次世代シーケンシング(NGS)サンプル調製市場レポートは、製品(試薬・消耗品、自動化ワークステーションなど)、ワークフローフェーズ(核酸抽出・精製など)、アプリケーション(診断、創薬など)、エンドユーザー(病院・リファレンスラボなど)、および地域(北米、欧州など)別に分類されます。市場予測は金額(米ドル)で提供されます。

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
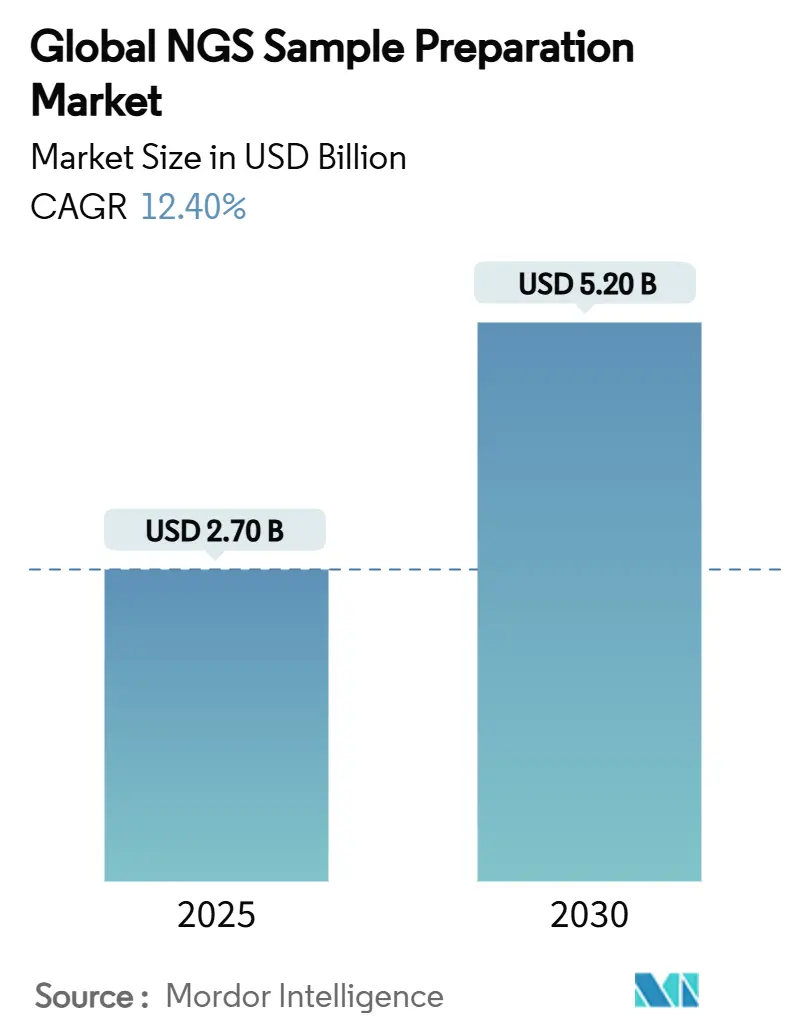
次世代シーケンシング(NGS)サンプル調製市場は、2025年には27億米ドルに達し、2030年までに52億米ドルに成長すると予測されており、予測期間中の年平均成長率(CAGR)は14.3%と見込まれています。この成長は、シーケンシングあたりのコスト低下、手作業時間を削減する自動化の進展、および腫瘍学や非侵襲的出生前診断(NIPT)などの臨床用途の拡大によって推進されています。試薬および消耗品は継続的な収益源を提供し、自動化ワークステーションは労働力削減のためのインフラ投資として予算が再配分されています。北米における規制の明確化とアジア太平洋地域全体での政府資金によるゲノムプログラムが需要を支える一方で、サプライチェーンの回復力とコールドチェーン不要の化学技術が調達戦略を再構築しています。市場の競争は中程度であり、既存企業は垂直統合を活用し、資金力のある新規参入企業はコストとプラットフォームの柔軟性で差別化を図っています。
市場規模と予測
* 2025年の市場規模:27億米ドル
* 2030年の市場規模:52億米ドル
* 2025年から2030年までのCAGR:14.3%
* 最も成長が速い地域:アジア太平洋
* 最大の市場:北米
* 市場集中度:中程度
主要な成長要因
市場の成長を牽引する主な要因は以下の通りです。
* シーケンシングあたりのコスト低下とオープンプラットフォームケミストリーの普及(CAGRへの影響:+2.80%): フローセル、酵素、ターミネーターなどのコンポーネント価格が低下し、マルチベンダーサプライチェーンが成熟しています。これにより、10万米ドル以下のベンチトップシーケンサーが市場に投入され、Illuminaのオンフローセルライブラリケミストリー(2025年商用リリース予定)は、個別のライブラリ調製ステップを不要にし、ランあたりの総コストを削減します。CapTrap-seqのようなプラットフォームに依存しないキットは、機器の切り替えの柔軟性を提供し、資本予算がハードウェアから化学とワークフローの最適化へと移行しています。
* ハイスループットラボにおける自動化による手作業時間の削減(CAGRへの影響:+2.40%): 音響液体ハンドラーは、8時間の手動ワークフローを約30分に短縮し、貴重な技術者の時間を解放します。MGISP-960のようなハイスループットシステムは、96プレートを無人運転で自動化し、毎月数千の腫瘍学および遺伝性疾患サンプルを処理する病院のニーズに応えています。AIスケジューリングモジュールは、調達の遅延をさらに削減し、消耗品の在庫切れを防ぎます。自動化された細胞遺伝学ラボでは、オペレーター間のばらつきが減少し、再現性の向上が資本支出を正当化しています。
* 精密腫瘍学およびコンパニオン診断アプリケーションの拡大(CAGRへの影響:+3.10%): ゲノムプロファイリングが主要な癌サブタイプにおける標準治療となるにつれて、精密腫瘍学の応用が拡大しています。初期段階の腫瘍における微小残存病変(MRD)検出パネルは、補助療法選択を導き、サンプル調製に対する感度要件を高めています。
* 感染症および新興病原体の有病率上昇(CAGRへの影響:+2.10%): サブサハラアフリカ諸国の半数以上が国内NGSサーベイランスプラットフォームを運用し、COVID-19対応中に構築された病原体追跡能力を加速させています。アジア病原体ゲノミクスイニシアチブのような地域コンソーシアムは、持続的な供給ボトルネックを緩和するためにリソースを集約しています。
* 迅速なオンボードサンプル・トゥ・アンサーシステムの臨床導入(CAGRへの影響:+1.90%): カナダの液体生検プログラムは、採取から報告までの中央値3日間という迅速なターンアラウンドを実現しており、従来の組織ワークフローの2週間以上と比較して大幅な改善です。2023年のFDAによるメタゲノムNGSアッセイの画期的な承認は、感染症パネルの迅速な導入を促進し、病院のラボが救急医療現場にシーケンシングを直接組み込むインセンティブを与えています。
* サービスとしてのサンプル調製スタートアップへのベンチャー資金提供(CAGRへの影響:+1.20%): 新興企業への投資が、新しいサービスモデルの創出を後押ししています。
主要な市場抑制要因
市場の成長を妨げる主な要因は以下の通りです。
* 中規模ラボにとっての資本集約的な自動化および消耗品コスト(CAGRへの影響:-1.80%): MGISP-960のようなユニットは、数百万ドルの投資と安定したスループットを必要とし、毎月1,000サンプル未満を処理するラボでは、サンプルあたりのコスト削減を実現することが困難です。消耗品は総調製コストの最大70%を占めることがあり、中規模施設はシーケンシングを外部委託せざるを得ない状況にあります。
* 地域間で断片化されたラボ開発テスト(LDT)に関する規制ガイダンス(CAGRへの影響:-2.10%): FDAの2024年5月の最終規則は、高リスクLDTに対する市販前審査を義務付け、4年間で執行裁量を段階的に廃止します。欧州のIVDR経路は文書要件が異なり、アジア太平洋のいくつかの国では現地登録制度が適用されるため、多国籍ラボは並行してバリデーションを管理する必要があります。
* 新興市場における試薬物流のコールドチェーン制約(CAGRへの影響:-1.40%): サブサハラアフリカ、東南アジア、ラテンアメリカなどの地域では、試薬の輸送と保管におけるコールドチェーンの維持が課題となっています。
* 上流のサンプル品質のばらつきがライブラリ収量に与える影響(CAGRへの影響:-1.20%): サンプル品質のばらつきは、ライブラリ調製の成功率に影響を与え、特にリソースが限られた環境で問題となります。
製品別分析
2024年には、試薬および消耗品がNGSサンプル調製市場の64.7%を占め、継続的な収益源としての重要性を示しています。一方、自動化ワークステーションは、絶対的な収益では低いものの、人員不足が手動ワークフローのコストを上昇させる中で、年間18.5%の成長が見込まれています。NEBNext Ultra II酵素的断片化キットのように、手作業時間を15分に短縮しつつ高いライブラリ複雑性を維持する化学的進歩は、自動化を補完するものです。ラボは、自動化ハードウェアと試薬枯渇を予測するソフトウェアダッシュボードを組み合わせることで、ジャストインタイムの配送と購入を連携させています。
用途別分析
診断分野、特に腫瘍学は、2024年の収益の54.1%を占め、ゲノムプロファイリングが主要な癌サブタイプにおける標準治療となっています。生殖医療(NIPT)は、より広範な支払い者によるカバレッジと父系ハプロタイプアッセイの拡大により、2030年までに17.8%のCAGRで成長すると予測されています。精密腫瘍学パネルは、初期段階の腫瘍における微小残存病変を検出し、補助療法選択を導き、サンプル調製に対する感度要件を高めています。創薬グループは、腫瘍微小環境を解明するためにシングルセルシーケンシングを採用し、農業研究者は作物特性を改善するためにターゲットゲノムタイピング・バイ・シーケンシングを展開しており、ヒトの健康以外の収益源を多様化しています。
エンドユーザー別分析
病院およびリファレンスラボは2024年の収益の37.7%を占めましたが、医薬品開発者がゲノミクスプロジェクトを専門パートナーに外部委託する傾向にあるため、受託研究機関(CRO)は15.9%のCAGRで拡大しています。Charles Riverのような企業は、微生物同定、RNA-Seq、CRISPR編集サービスをターンキーパッケージで提供し、内部インフラ投資を不要にしています。学術機関は安定した購入者ですが、中規模のバイオテクノロジー企業は、規制に準拠したシーケンスデータをCROと提携して取得することが増えており、第三者機関の成長を後押ししています。
ワークフロー段階別分析
抽出品質は下流の成功を決定しますが、ライブラリ構築は最もエラーが発生しやすい段階です。このため、Illumina DNA Prepのようなビーズ結合型トランスポゾンキットの採用が促進されており、1〜500 ngのインプットから3.5時間で均一なゲノムカバレッジを提供します。ハイブリッドキャプチャターゲット濃縮は、液体生検アッセイに不可欠な10〜100倍の感度向上をもたらします。リアルタイムQCモジュールは、ラン中に最適でない断片を検出し、プロトコルをその場で調整することを可能にします。ワークフローの統合も加速しており、Illuminaのオンフローセルケミストリー(2025年予定)は、ライブラリ調製とシーケンシングを単一の消耗品に統合し、汚染リスクの低減とサイクル時間の短縮を約束しています。
地域別分析
* 北米: 2024年の収益の39.6%を占め、堅牢な医療償還制度と明確な規制経路に支えられています。Illumina、Thermo Fisher Scientific、Element Biosciencesなどの主要企業は、地域に製造およびサポート拠点を維持しています。カナダの地域病院における液体生検プログラムは臨床導入の例であり、メキシコは米国サプライヤーへの近接性を活用してリファレンスラボの能力を拡大しています。
* 欧州: ドイツ、英国、フランス、イタリア、スペインなどの国々における協調的な研究資金とインフラの成熟から恩恵を受けています。調和されたIVDR規則は国境を越えたキット展開を可能にしますが、追加の文書作成はコストオーバーヘッドを課し、小規模ラボはコンソーシアム購入モデルを通じてこれを相殺しています。
* アジア太平洋: 政府がゲノミクスを公衆衛生アジェンダに組み込むにつれて、14.4%のCAGRで最も急速に成長している地域です。インドのIndiGenイニシアチブは、1,000ゲノムのシーケンシングを通じて、現地のバイオバンキング能力を飛躍的に向上させました。中国のMGI Techは、自動化ワークステーションを国内で拡大し、東南アジアに輸出しており、日本は三次病院で迅速シーケンシングを先駆けています。しかし、コールドチェーン物流と多様な規制基準は依然として課題であり、ベンダーは常温安定化剤や現地のコンプライアンスサポートオフィスを通じてこれに対処しています。
競争環境
市場集中度は中程度です。Illumina、Thermo Fisher Scientific、Qiagen、Agilent、MGI Techなどの上位5社が、プラットフォーム所有と試薬の添付率の両方を反映して、かなりの市場シェアを集合的に支配しています。IlluminaによるSomaLogicの3億5000万米ドルでの買収は、プロテオミクスをそのエコシステムに統合し、マルチオミクスでのクロスセル可能性を強化しています。Element Biosciencesは、集中的なR&Dと2億7700万米ドルの新規資本により、1年間でシーケンサーの設置数を40台から190台に迅速に拡大し、価格性能ベンチマークに挑戦しています。ベンダーは、リード長や精度だけでなく、総所有コスト、ワークフローの広さ、統合された分析機能に基づいて競争する傾向が強まっています。診断ラボ、CRO、農業ゲノムパートナーとの戦略的提携は、アプリケーションのフットプリントを広げ、消耗品収益を確保しています。
主要企業
* Illumina, Inc.
* Agilent Technologies, Inc.
* Thermo Fisher Scientific Inc.
* PerkinElmer Inc.
* F. Hoffmann-La Roche Ltd
最近の業界動向
* 2025年6月:IlluminaはSomaLogicを3億5000万米ドルで買収し、SomaScanプロテオミクスアッセイをNGSワークフローと統合することに合意しました。
* 2025年2月:Agilentは、治療用核酸製造能力を倍増させるために7億2500万米ドルを投じ、2026年に新規出荷を予定しています。
このレポートは、次世代シーケンシング(NGS)サンプル調製市場に関する詳細な分析を提供しています。NGSは、ゲノム、トランスクリプトーム、エピゲノムレベルであらゆる種の情報を取得できるハイスループット技術であり、より迅速かつ信頼性の高い、低コストでの遺伝情報取得を可能にしています。シーケンシング技術の急速な発展により、スループット能力が大幅に向上し、コスト削減が進んでいます。
市場規模と成長予測:
NGSサンプル調製市場は、2025年には27億米ドルの規模に達し、2030年までには52億米ドルに成長すると予測されています。
主要セグメントと地域動向:
製品クラス別では、試薬および消耗品が2024年の収益の64.7%を占めており、サンプルあたりの継続的な需要を反映して市場を牽引しています。地域別では、アジア太平洋地域が最も急速に成長しており、年平均成長率(CAGR)14.4%を記録しています。これは、インドのIndiGenプロジェクトのような政府資金によるプログラム、病原体監視の拡大、および医療投資の増加によって推進されています。
市場の推進要因:
市場の成長を促進する主な要因は以下の通りです。
* 感染症および新興病原体の蔓延の増加。
* シーケンシングの塩基あたりコストの低下とオープンプラットフォーム化学の進展。
* ハイスループットラボにおける自動化による手作業時間の削減。自動化ワークステーションは、8時間かかっていた手動のライブラリ調製を約30分に短縮し、大量処理を行うラボでは18ヶ月以内に投資回収が可能です。
* 迅速なオンボードサンプルから結果までのシステムの臨床導入。
* サンプル調製サービスを提供するスタートアップ企業へのベンチャー資金提供。
* 精密腫瘍学およびコンパニオン診断アプリケーションの拡大。
市場の阻害要因:
一方で、市場の成長を妨げる要因も存在します。
* 中規模ラボにとっての資本集約的な自動化設備と消耗品コストの高さ。
* 上流のサンプル品質のばらつきがライブラリ収量に与える影響。
* 地域ごとのラボ開発テスト(LDT)に関する規制ガイダンスの断片化。特に米国では、FDAが2024年5月に最終規則を発表し、4年間かけてLDTに対する執行裁量を段階的に廃止し、高リスクLDTには市販前審査を義務付けることになります。
* 新興市場における試薬物流のコールドチェーン制約。
レポートの構成:
本レポートでは、市場を以下の主要なセグメントに分けて詳細に分析しています。
* 製品クラス別: 試薬および消耗品、自動化ワークステーション、その他の消耗品。
* ワークフローフェーズ別: 核酸抽出・精製、ライブラリ構築、ターゲット濃縮・アンプリコン生成、品質管理・定量。
* アプリケーション別: 診断、創薬・機能ゲノミクス、農業・動物研究、その他の研究アプリケーション。
* エンドユーザー別: 病院・リファレンスラボ、製薬・バイオテクノロジー企業、学術・研究機関、受託研究機関(CRO)、その他。
* 地域別: 北米、欧州、アジア太平洋、中東・アフリカ、南米の主要地域および17カ国を含む詳細な分析が含まれています。
競争環境:
競争環境については、Illumina Inc.、Thermo Fisher Scientific、Qiagen N.V.、Agilent Technologies、F. Hoffmann-La Roche Ltdなど、主要な市場参加企業のプロファイルが提供されており、各社の事業概要、財務状況、製品、戦略、最近の動向などが網羅されています。
このレポートは、NGSサンプル調製市場の全体像を把握し、将来の機会と課題を理解するための包括的な情報を提供しています。

1. はじめに
- 1.1 調査の前提と市場の定義
- 1.2 調査範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場概況
- 4.1 市場概要
-
4.2 市場の推進要因
- 4.2.1 感染性および新興病原体の有病率の増加
- 4.2.2 塩基あたりのシーケンスコストの低下とオープンプラットフォーム化学
- 4.2.3 ハイスループットラボにおける手作業時間の削減を可能にする自動化
- 4.2.4 迅速なオンボードサンプルから回答までのシステムの臨床導入
- 4.2.5 サービスとしてのサンプル調製スタートアップへのベンチャー資金
- 4.2.6 精密腫瘍学およびコンパニオン診断アプリケーションの拡大
-
4.3 市場の阻害要因
- 4.3.1 中規模ラボにおける資本集約的な自動化と消耗品コスト
- 4.3.2 上流のサンプル品質のばらつきがライブラリ収量に影響
- 4.3.3 地域ごとのラボ開発テストに対する規制ガイダンスの断片化
- 4.3.4 新興市場における試薬物流のコールドチェーン制約
- 4.4 サプライチェーン分析
- 4.5 規制環境
- 4.6 技術的展望
-
4.7 ポーターの5つの力分析
- 4.7.1 新規参入者の脅威
- 4.7.2 買い手の交渉力
- 4.7.3 供給者の交渉力
- 4.7.4 代替品の脅威
- 4.7.5 競争の激しさ
5. 市場規模と成長予測(金額、百万米ドル)
-
5.1 製品クラス別
- 5.1.1 試薬および消耗品
- 5.1.2 自動化ワークステーション
- 5.1.3 その他の消耗品
-
5.2 ワークフローフェーズ別
- 5.2.1 核酸抽出および精製
- 5.2.2 ライブラリー構築
- 5.2.3 ターゲット濃縮 / アンプリコン生成
- 5.2.4 品質管理および定量
-
5.3 用途別
- 5.3.1 診断
- 5.3.2 創薬 / 機能ゲノミクス
- 5.3.3 農業および動物研究
- 5.3.4 その他の研究用途
-
5.4 エンドユーザー別
- 5.4.1 病院およびリファレンスラボ
- 5.4.2 製薬およびバイオテクノロジー企業
- 5.4.3 学術および研究機関
- 5.4.4 受託研究機関
- 5.4.5 その他
-
5.5 地域別
- 5.5.1 北米
- 5.5.1.1 米国
- 5.5.1.2 カナダ
- 5.5.1.3 メキシコ
- 5.5.2 欧州
- 5.5.2.1 ドイツ
- 5.5.2.2 英国
- 5.5.2.3 フランス
- 5.5.2.4 イタリア
- 5.5.2.5 スペイン
- 5.5.2.6 その他の欧州
- 5.5.3 アジア太平洋
- 5.5.3.1 中国
- 5.5.3.2 日本
- 5.5.3.3 インド
- 5.5.3.4 韓国
- 5.5.3.5 オーストラリア
- 5.5.3.6 その他のアジア太平洋
- 5.5.4 中東およびアフリカ
- 5.5.4.1 GCC
- 5.5.4.2 南アフリカ
- 5.5.4.3 その他の中東およびアフリカ
- 5.5.5 南米
- 5.5.5.1 ブラジル
- 5.5.5.2 アルゼンチン
- 5.5.5.3 その他の南米
6. 競合情勢
- 6.1 市場集中度
- 6.2 市場シェア分析
-
6.3 企業プロファイル(グローバルレベルの概要、市場レベルの概要、主要セグメント、利用可能な財務情報、戦略的情報、主要企業の市場ランク/シェア、製品とサービス、および最近の動向を含む)
- 6.3.1 Illumina Inc.
- 6.3.2 Thermo Fisher Scientific
- 6.3.3 Qiagen N.V.
- 6.3.4 Agilent Technologies
- 6.3.5 F. Hoffmann-La Roche Ltd
- 6.3.6 PerkinElmer Inc.
- 6.3.7 Danaher Corp (Beckman Coulter)
- 6.3.8 BGI Genomics
- 6.3.9 Eurofins Scientific
- 6.3.10 Bio-Rad Laboratories
- 6.3.11 Oxford Nanopore Technologies
- 6.3.12 Pacific Biosciences
- 6.3.13 Macrogen Inc.
- 6.3.14 Integrated DNA Technologies
- 6.3.15 Genomatix
- 6.3.16 Tecan Group
- 6.3.17 Hamilton Company
- 6.3.18 New England Biolabs
- 6.3.19 Swift Biosciences
- 6.3.20 Helix OpCo LLC
7. 市場機会と将来展望
*** 本調査レポートに関するお問い合わせ ***

次世代シーケンシング(NGS)サンプル調製は、NGS解析の最初にして最も重要なステップの一つであり、生体サンプルから得られた核酸(DNAやRNA)をシーケンサーが読み取れる形式に加工する一連の工程を指します。この工程の品質が、その後のシーケンスデータ、ひいては解析結果の信頼性と精度に直接影響を与えるため、非常に慎重かつ正確な実施が求められます。具体的には、核酸の抽出・精製、断片化、アダプターライゲーション、そしてライブラリー増幅といった主要なステップが含まれます。
この調製プロセスは、単に核酸を準備するだけでなく、シーケンスプラットフォームの要件に合致させ、目的とする解析に応じた適切なライブラリーを構築することを目的としています。例えば、特定の遺伝子領域のみを解析したい場合はターゲットエンリッチメントが必要となり、遺伝子発現を解析したい場合はRNAからcDNAを合成し、リボソームRNAを除去するなどの前処理が加わります。このように、NGSサンプル調製は、多様なアプリケーションとシーケンス技術に対応するための基盤となる技術です。
NGSサンプル調製には、解析目的や対象となる核酸の種類に応じて多岐にわたる方法が存在します。核酸の種類としては、ゲノムDNA、循環腫瘍DNA(ctDNA)や無細胞DNA(cfDNA)などの微量DNA、クロマチン免疫沈降後のDNA(ChIP-DNA)、そしてmRNA、miRNA、total RNAなどのRNAが挙げられます。それぞれに最適な抽出・精製プロトコルとライブラリー調製キットが開発されています。
アプリケーション別では、全ゲノムシーケンス(WGS)や全エクソームシーケンス(WES)、遺伝子発現解析のためのRNAシーケンス(RNA-Seq)、エピゲノム解析のためのChIPシーケンスやメチル化シーケンス、微生物叢解析のためのメタゲノムシーケンスなどがあります。WESや特定の遺伝子パネル解析では、目的領域のみを濃縮するターゲットエンリッチメント技術(ハイブリダイゼーションキャプチャー法やアンプリコンシーケンス法)が用いられます。また、近年注目されているシングルセル解析では、極めて微量の核酸を扱うための特殊な調製技術が不可欠です。これらの多様なニーズに応えるため、各メーカーから様々な専用キットや自動化システムが提供されています。
NGSサンプル調製は、基礎研究から臨床応用、さらには産業分野に至るまで、幅広い領域で不可欠な技術となっています。基礎研究においては、遺伝子の機能解析、疾患メカニズムの解明、進化生物学、微生物生態学など、生命現象の根源的な理解を深めるために利用されます。特に、網羅的な遺伝子発現解析やゲノムワイドな変異解析は、新たな知見の発見に貢献しています。
臨床応用では、がんの診断・治療において、腫瘍組織やリキッドバイオプシー検体からの遺伝子変異検出、コンパニオン診断、薬剤耐性遺伝子の特定などに活用されています。また、遺伝性疾患の原因遺伝子特定、感染症の病原体同定や薬剤耐性評価、さらには非侵襲的出生前遺伝学的検査(NIPT)など、診断精度の向上と個別化医療の実現に大きく貢献しています。農業分野では品種改良や病害診断、環境科学では微生物叢解析や生態系モニタリングなど、その応用範囲は拡大の一途を辿っています。
NGSサンプル調製は、複数の要素技術の組み合わせによって成り立っています。まず、高品質な核酸を得るための核酸抽出・精製技術が基盤となります。これには、フェノール・クロロホルム法、シリカゲルカラム法、磁気ビーズ法などがあり、サンプル源や核酸の種類に応じて選択されます。次に、シーケンスに適したサイズの断片に核酸を切断する断片化技術があり、超音波(ソニケーション)による物理的断片化や、トランスポザーゼや制限酵素を用いた酵素的断片化が一般的です。
断片化された核酸には、シーケンサーが認識するためのアダプター配列を付加するライゲーションが行われます。この工程は、ライブラリーの品質を決定する重要なステップです。その後、PCRによるライブラリー増幅が行われ、シーケンスに必要な十分な量のライブラリーを確保します。これらの各ステップにおいて、核酸濃度、純度、断片サイズ分布などを評価するための品質管理(QC)技術(例:Qubit、NanoDrop、Agilent Bioanalyzer/TapeStation、qPCR)が不可欠です。さらに、高スループット化や再現性向上のため、液体ハンドリングロボットなどの自動化システムも広く導入されています。
NGS市場の急速な拡大に伴い、NGSサンプル調製市場も著しい成長を遂げています。この市場は、Illumina、Thermo Fisher Scientific、Agilent Technologies、Roche(Kapa Biosystems)、New England Biolabs、Takara Bio、QIAGENといった主要なグローバル企業によって牽引されています。これらの企業は、多様なアプリケーションに対応する革新的なキットや自動化ソリューションを開発・提供し、市場競争を繰り広げています。
現在の市場トレンドとしては、まず、自動化とハイスループット化の進展が挙げられます。これにより、大規模な研究や臨床検査における効率と再現性が向上しています。次に、微量サンプル(例:cfDNA、シングルセル)からの調製技術の需要が高まっており、低インプット量でも高感度かつ高精度な解析を可能にする製品が求められています。また、調製時間の短縮とコスト削減も重要なトレンドであり、より迅速かつ経済的なソリューションが市場に投入されています。リキッドバイオプシーやシングルセル解析といった新たな応用分野の拡大も、サンプル調製技術の進化を加速させています。
NGSサンプル調製技術の将来は、さらなる自動化、統合化、そして多様なサンプルタイプへの対応強化が鍵となるでしょう。将来的には、サンプル投入からシーケンスデータ取得までの一貫した「エンド・ツー・エンド」の自動化ワークフローがより普及し、研究者や臨床医の負担を軽減し、ヒューマンエラーを最小限に抑えることが期待されます。これにより、NGS解析のアクセシビリティが向上し、より多くの研究機関や医療機関で利用されるようになるでしょう。
また、超微量かつ低品質な臨床検体(例:FFPE組織、血漿中のcfDNA)からの高精度なライブラリー調製技術は、個別化医療や早期診断の進展に不可欠であり、今後も研究開発が加速すると考えられます。調製時間の劇的な短縮やコストのさらなる低減も、NGSの普及を後押しする重要な要素です。さらに、ポータブルシーケンサーやロングリードシーケンサーといった新しいシーケンス技術に最適化された調製法の開発、AIや機械学習を活用した品質管理やプロトコル最適化、そしてゲノム、エピゲノム、トランスクリプトームなどを統合的に解析する多角的オミクス解析に対応する技術の進化も期待されます。これらの進歩は、生命科学研究と臨床診断の未来を大きく変革する可能性を秘めています。