潜在性結核感染症検査市場 規模・シェア分析、成長動向と予測 (2025年~2030年)
潜在性結核感染症検出市場レポートは、検査方法(ツベルクリン反応検査、インターフェロンガンマ遊離試験、その他の新興検査)、検体タイプ(血液、その他)、テクノロジープラットフォーム(ELISAベースのIGRA、化学発光免疫測定法、蛍光免疫測定法など)、エンドユーザー(病院など)、および地域別に分類されます。市場予測は、金額(米ドル)で提供されます。

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
潜在性結核感染症検出市場規模、シェア、2030年までの成長トレンドに関するレポートの概要を以下にご報告いたします。本市場は、検査方法、検体タイプ、技術プラットフォーム、エンドユーザー、地域別にセグメント化されており、市場予測は米ドル(USD)建てで提供されています。
市場概要
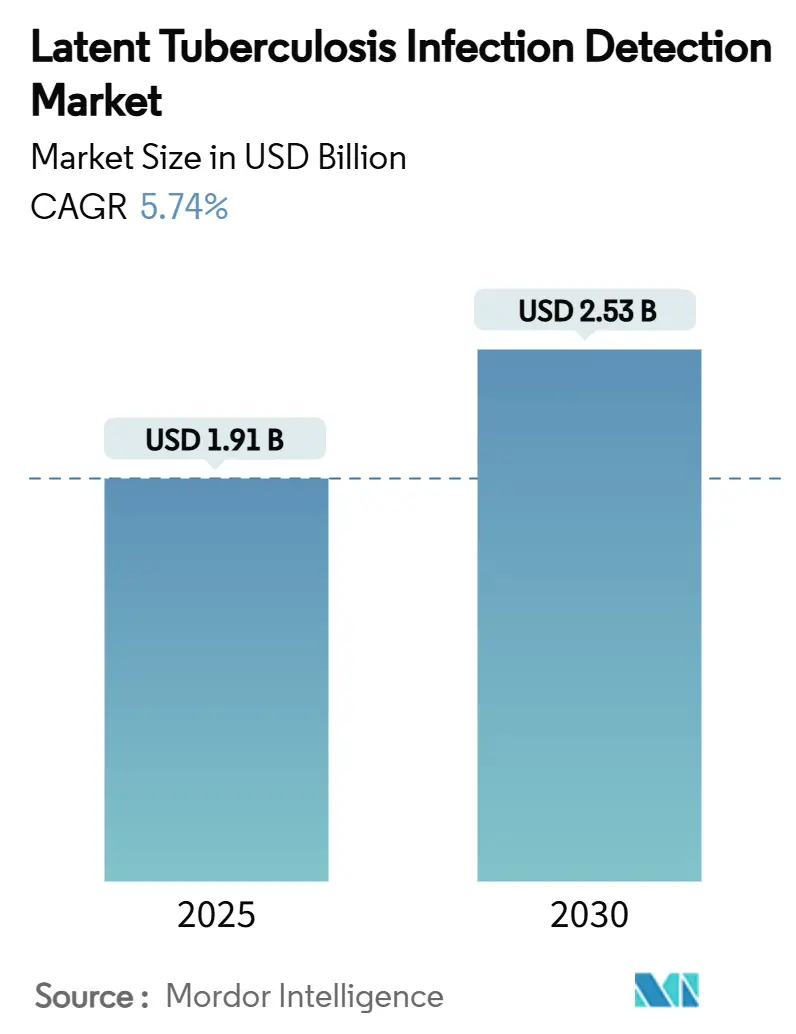
本市場の調査期間は2019年から2030年までです。2025年には19.1億米ドルに達し、2030年には25.3億米ドルに成長すると予測されており、この期間の年平均成長率(CAGR)は5.74%を見込んでおります。最も急速に成長する市場はアジア太平洋地域であり、最大の市場は北米です。市場の集中度は中程度と評価されています。主要なプレーヤーには、QIAGEN N.V.、Revvity、Abbott Laboratories、SD Biosensor Inc.、Thermo Fisher Scientific Inc.などが挙げられます。
潜在性結核感染症検出市場は、潜在性感染症が公衆衛生上の優先事項として認識されつつあること、予防的検査に対する償還範囲の拡大、そしてBCGワクチン接種集団におけるインターフェロンガンマ放出アッセイ(IGRA)の使用加速が、その拡大を支える主要因となっています。北米および欧州の医療費支払機関は、高リスクグループに対する定期的なスクリーニングへの資金提供を継続しており、アジア太平洋地域の政府はスクリーニングと化学予防を組み合わせた国家プログラムを拡大しています。主要な診断企業は、病院や検査機関が検査を統合する中でIGRAの流通を強化しており、新しいポイントオブケア形式は地方市場における分散型チャネルを開拓しています。精製タンパク質誘導体(PPD)抗原の供給不足や、高度なアッセイの検査あたりの高コストは依然として課題ですが、継続的な技術投資とバンドル型支払いモデルがこれらの圧力を相殺し、市場の成長軌道を維持しています。
主要なレポートのポイント
* 検査方法別: 2024年にはツベルクリン皮膚反応検査が市場シェアの54.38%を占めましたが、IGRAは2030年までに9.46%の最速CAGRを記録すると予測されています。
* 検体タイプ別: 2024年には血液ベースのアッセイが市場規模の62.57%を占め、8.52%のCAGRで拡大しています。
* 技術プラットフォーム別: 2024年にはELISAベースのIGRAが収益シェアの47.59%を占めましたが、ラテラルフローおよびポイントオブケア形式は2030年までに9.06%のCAGRで進展しています。
* エンドユーザー別: 2024年には病院が市場規模の37.59%を占め、診断検査機関は2030年までに8.42%の最速CAGRを記録すると予測されています。
* 地域別: 2024年には北米が32.49%のシェアを維持しましたが、アジア太平洋地域は7.52%の最速CAGRで成長すると予測されています。
世界の潜在性結核感染症検出市場のトレンドと洞察
市場の成長を牽引する主な要因は以下の通りです。
* 政府資金によるLTBIスクリーニング義務化: 医療従事者、免疫不全患者、高負荷地域からの移民に対する定期的な潜在性結核検査が、国および州の機関によって義務付けられています。2024年のCDC予防サービス更新により、医療費負担適正化法に基づきこれらの検査の自己負担費用が撤廃され、安定した需要を促進しています。米国コロラド州やロードアイランド州などの州では年間スクリーニング規則が施行されており、カリフォルニア州では病院向けに州全体の結核リスク評価ツールが導入されています。欧州連合全体でも同様の政策が遵守を義務付ける基盤を提供し、経済サイクルから市場を保護する一貫した検査量を確保しています。IGRAは、単一訪問でのワークフローとBCGワクチン接種コホートにおける正確性から、最も恩恵を受けています。
* 移民・難民プログラムの拡大: 地政学的な不安定さが続く中、亡命希望者の結核に対する警戒が高まっています。2024年11月に発表されたWHOのガイダンスは、到着時の体系的なスクリーニングを推奨しており、欧州、カナダ、オーストラリアで活動性結核と潜在性結核の両方に対応するアルゴリズムの採用を促しています。ECDCのデータによると、2023年にスクリーニングされたウクライナ難民の結核通知率は10万人あたり16.9件であり、受入国の平均の2倍以上でした。韓国における移民を対象としたIGRAパイロットプログラムでは、未治療のIGRA陽性参加者における潜在性感染症の発生率が10万人年あたり312.5件であることが明らかになり、早期発見の重要性が再確認されました。これらの調査結果は、国境診療所におけるポータブルIGRA分析装置への資金提供を加速させ、市場拡大に貢献しています。
* 低発生率国におけるIGRAの採用増加: 低発生率地域では、過去のBCGワクチン接種によりツベルクリン皮膚反応検査の偽陽性が問題となっています。WHOの2024年診断モジュールは、これらの状況でのIGRAの使用を推奨しており、西欧諸国や日本で迅速なガイドライン更新につながっています。QIAGEN社のQuantiFERONフランチャイズが2023年に24%の収益増加を記録したことは、IGRAの正確性に対する医療従事者の選好を示しています。EMAが2024年に組換えESAT-6/CFP-10 IGRAに対して肯定的な意見を出したことは、製品の展望を広げ、さらなる成長を示唆しています。
* LTBI診断に対するバンドル型償還: 支払機関は、結核検査と関連する外来診療をバンドル化する傾向を強めており、医療提供者を細分化された償還リスクから保護しています。更新されたメディケアのガイダンスは、ELISA IGRA(CPT 86480)とT細胞数測定アッセイ(CPT 86481)を区別し、両形式の支払いを明確にしています。メディケイドは、42 CFR 435.215に基づき、結核感染者に対する診断をカバーしており、感染が確認された後の検査の継続性を保証しています。このような明確化は、医療提供者が財政的な不確実性なしに最新のIGRA技術を導入することを奨励し、市場を強化しています。
市場の成長を抑制する主な要因は以下の通りです。
* 精製タンパク質誘導体(PPD)抗原の供給不足: 製造上のボトルネックにより、ツベルクリン皮膚反応検査の供給が定期的に制限されています。多くの低・中所得国(LMIC)のスクリーニングプログラムはコスト上の理由から皮膚反応検査に依存しているため、在庫切れは監視スケジュールを混乱させ、検査の滞留を拡大し、定期プログラムへの信頼を損なっています。供給不足はしばしば利害関係者にIGRA代替品の評価を促しますが、移行には設備投資が必要であり、市場の勢いを一時的に弱めるギャップを生み出します。
* LMICにおけるIGRAの検査あたりの高コスト: IGRA試薬はツベルクリンバイアルの最大10倍のコストがかかることがあります。予算が限られている場合、公衆結核プログラムは高度なアッセイを特定のコホートに限定して配給するため、皮膚反応検査の広範な置き換えが遅れています。外部からの寄付金はギャップを縮めますが、多くの保健省は依然として調達規模の拡大に苦慮しており、高負荷地域における市場を制限しています。
セグメント分析
* 検査方法別:IGRAの採用が加速
2024年にはツベルクリン皮膚反応検査が潜在性結核感染症検出市場の54.
本レポートは、潜在性結核感染症(LTBI)検出市場に関する詳細な分析を提供しています。市場の定義、調査範囲、調査方法、エグゼクティブサマリー、市場概況、成長予測、競争環境、および将来の展望を網羅しています。
市場は2025年に19.1億米ドルの規模に達すると予測されており、2030年までに年平均成長率(CAGR)5.74%で成長し、25.3億米ドルに達すると見込まれています。地域別では、アジア太平洋地域が大規模なスクリーニング投資に牽引され、7.52%のCAGRで最も高い成長潜在力を示しています。
市場の成長を促進する主な要因としては、政府資金によるLTBIスクリーニング義務化、移民・難民向け医療プログラムの拡大、低発生率国におけるインターフェロンガンマ放出アッセイ(IGRA)の採用増加、結核/潜在性結核診断のバンドル型償還、AI支援トリアージツールによる検査需要の増加、および免疫不全集団におけるLTBIの標的型管理が挙げられます。
一方で、市場の成長を抑制する要因も存在します。これには、精製ツベルクリン誘導体(PPD)抗原の供給不足、低・中所得国(LMICs)におけるIGRAの高コスト、BCGワクチン接種集団における偽陽性率の高さ、および高スループットELISA IGRA分析のための検査室能力の限界が含まれます。
検査方法のトレンドとして、ツベルクリン皮膚反応検査(TST)からIGRAへの移行が進んでいます。これは、IGRAがBCGワクチン接種集団においてより高い特異性を提供し、患者の来院が1回で済むという利点があるためです。しかし、LMICsではIGRAの検査費用が高いことが普及の最大の障壁となっています。競争環境では、Rocheが2024年にLumiraDxの技術プラットフォームを買収し、迅速なポイントオブケアIGRAカートリッジ市場に参入するなど、主要企業による戦略的な動きが見られます。
市場は、検査方法(ツベルクリン皮膚反応検査、IGRA、その他の新興検査)、検体タイプ(血液、その他)、技術プラットフォーム(ELISAベースIGRA、化学発光免疫測定法(CLIA)、蛍光免疫測定法(FIA)、ラテラルフロー/ポイントオブケアアッセイ、分子診断(PCR/NGS))、エンドユーザー(病院、診断検査機関、公衆衛生機関、その他)、および地域(北米、欧州、アジア太平洋、中東・アフリカ、南米)によって詳細に分析されています。
競争環境の分析では、市場集中度、市場シェア分析、および主要企業のプロファイルが含まれています。主要企業には、QIAGEN N.V.、Revvity、Abbott Laboratories、Thermo Fisher Scientific Inc.、Danaher Corp、Bio-Rad Laboratories Inc.、Hologic Inc.、SD Biosensor Inc.、Beijing Wantai Biological Pharmacy、Creative Diagnostics、Lionex GmbH、Serum Institute of India Pvt Ltd、ZeptoMetrix Corp.、R-Biopharm AG、GenoScreen SAS、Alpha Laboratories Ltd、Ansh Labs、ARKRAY Inc.、Tulip Diagnostics (P) Ltd、Diasorin SpAなどが挙げられます。
本レポートは、市場の機会と将来の展望についても言及しており、未開拓の領域や満たされていないニーズの評価を通じて、今後の市場発展の方向性を示唆しています。

1. はじめに
- 1.1 調査の前提と市場の定義
- 1.2 調査範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場概況
- 4.1 市場概要
-
4.2 市場の推進要因
- 4.2.1 政府資金によるLTBIスクリーニング義務化
- 4.2.2 移民および難民の健康プログラムの拡大
- 4.2.3 発生率の低い国におけるIGRAの採用増加
- 4.2.4 結核/潜在性結核診断のバンドル償還
- 4.2.5 AI支援トリアージツールによる検査需要の増加
- 4.2.6 免疫不全者集団における標的型LTBI管理
-
4.3 市場の制約
- 4.3.1 精製タンパク質誘導体(PPD)抗原の供給不足
- 4.3.2 LMICにおけるIGRAの検査あたりの高コスト
- 4.3.3 BCGワクチン接種コホートにおける偽陽性率
- 4.3.4 高スループットELISA IGRA分析のための限られた検査室能力
- 4.4 バリュー/サプライチェーン分析
- 4.5 規制環境
- 4.6 テクノロジーの見通し
-
4.7 ポーターの5つの力分析
- 4.7.1 供給者の交渉力
- 4.7.2 買い手の交渉力
- 4.7.3 新規参入の脅威
- 4.7.4 代替品の脅威
- 4.7.5 競争の激しさ
5. 市場規模と成長予測(金額-米ドル)
-
5.1 検査方法別
- 5.1.1 ツベルクリン反応検査 (TST)
- 5.1.2 インターフェロンガンマ遊離試験 (IGRA)
- 5.1.3 その他の新規検査
-
5.2 検体タイプ別
- 5.2.1 血液
- 5.2.2 その他 (例: 皮膚)
-
5.3 技術プラットフォーム別
- 5.3.1 ELISAベースのIGRA
- 5.3.2 化学発光免疫測定法 (CLIA)
- 5.3.3 蛍光免疫測定法 (FIA)
- 5.3.4 ラテラルフロー / 迅速診断検査
- 5.3.5 分子診断 (PCR/NGS)
-
5.4 エンドユーザー別
- 5.4.1 病院
- 5.4.2 診断検査機関
- 5.4.3 公衆衛生機関
- 5.4.4 その他
-
5.5 地域別
- 5.5.1 北米
- 5.5.1.1 米国
- 5.5.1.2 カナダ
- 5.5.1.3 メキシコ
- 5.5.2 欧州
- 5.5.2.1 ドイツ
- 5.5.2.2 英国
- 5.5.2.3 フランス
- 5.5.2.4 イタリア
- 5.5.2.5 スペイン
- 5.5.2.6 その他の欧州
- 5.5.3 アジア太平洋
- 5.5.3.1 中国
- 5.5.3.2 日本
- 5.5.3.3 インド
- 5.5.3.4 オーストラリア
- 5.5.3.5 韓国
- 5.5.3.6 その他のアジア太平洋
- 5.5.4 中東およびアフリカ
- 5.5.4.1 GCC
- 5.5.4.2 南アフリカ
- 5.5.4.3 その他の中東およびアフリカ
- 5.5.5 南米
- 5.5.5.1 ブラジル
- 5.5.5.2 アルゼンチン
- 5.5.5.3 その他の南米
6. 競合情勢
- 6.1 市場集中度
- 6.2 市場シェア分析
-
6.3 企業プロファイル(グローバルレベルの概要、市場レベルの概要、主要セグメント、利用可能な財務情報、戦略情報、主要企業の市場ランク/シェア、製品とサービス、および最近の動向を含む)
- 6.3.1 QIAGEN N.V.
- 6.3.2 レブビティ
- 6.3.3 アボット・ラボラトリーズ
- 6.3.4 サーモフィッシャーサイエンティフィック株式会社
- 6.3.5 ダナハー・コーポレーション
- 6.3.6 バイオ・ラッド・ラボラトリーズ株式会社
- 6.3.7 ホロジック株式会社
- 6.3.8 SDバイオセンサー株式会社
- 6.3.9 北京万泰生物薬業
- 6.3.10 クリエイティブ・ダイアグノスティクス
- 6.3.11 ライオネックスGmbH
- 6.3.12 インド血清研究所Pvt Ltd
- 6.3.13 ゼプトメトリックス・コーポレーション
- 6.3.14 R-バイオファームAG
- 6.3.15 ジェノスクリーンSAS
- 6.3.16 アルファ・ラボラトリーズ株式会社
- 6.3.17 アンシュ・ラボ
- 6.3.18 アークレイ株式会社
- 6.3.19 チューリップ・ダイアグノスティクス (P) Ltd
- 6.3.20 ディアソリンSpA
7. 市場機会と将来展望
*** 本調査レポートに関するお問い合わせ ***

潜在性結核感染症検査は、結核菌に感染しているものの、まだ活動性の結核を発病していない状態、すなわち潜在性結核感染症(Latent Tuberculosis Infection: LTBI)にあるかどうかを診断するための検査です。この状態では、自覚症状は全くなく、他人に結核菌を感染させることもありませんが、免疫力が低下した際などに将来的に活動性結核へと移行するリスクがあります。そのため、潜在性結核感染症を早期に発見し、適切な治療を行うことで、発病を未然に防ぎ、結核のまん延を抑制することが重要な公衆衛生上の課題とされています。
潜在性結核感染症検査には、主に二つの種類があります。一つは、古くから用いられているツベルクリン反応検査(Tuberculin Skin Test: TST)です。これは、精製ツベルクリン(PPD)を前腕の皮膚内に少量注入し、48~72時間後の発赤や硬結の大きさを測定することで、結核菌に対する免疫反応の有無を評価するものです。比較的安価で簡便に実施できる利点がありますが、BCGワクチン接種の影響や非結核性抗酸菌感染による偽陽性、あるいは免疫抑制状態にある患者での偽陰性など、特異度や感度に限界があるという課題も指摘されています。もう一つは、近年広く普及しているインターフェロンγ遊離試験(Interferon-Gamma Release Assay: IGRA)です。これは、採血した血液を用いて、結核菌に特異的な抗原(ESAT-6、CFP-10など、BCGには含まれない抗原)で刺激した際に、T細胞から産生されるインターフェロンγの量を測定することで、結核菌感染の有無を判定する検査です。IGRAには、クォンティフェロンTBゴールドプラス(QuantiFERON-TB Gold Plus: QFT-Plus)とT-SPOT.TBの二つの主要な製品があります。QFT-Plusは、採血した血液を専用の採血管に入れ、培養後にELISA法でインターフェロンγを測定します。T-SPOT.TBは、採血した血液から単核球を分離し、ELISPOT法でインターフェロンγ産生細胞数を測定します。IGRAは、BCG接種の影響を受けないため、ツベルクリン反応検査に比べて特異度が高く、より正確な診断が可能であるとされています。
これらの検査は、様々な状況で活用されています。最も一般的な用途の一つは、活動性結核患者との接触者検診です。結核患者と濃厚接触した可能性のある人々を対象に検査を行い、潜在性結核感染症と診断された場合には、発病予防のための治療(潜在性結核感染症治療)が検討されます。また、免疫抑制状態にある患者、例えばHIV感染者、臓器移植患者、生物学的製剤や免疫抑制剤を使用する患者などは、結核の発病リスクが非常に高いため、これらの治療を開始する前に潜在性結核感染症の有無を確認することが重要です。医療従事者も、結核患者と接する機会が多いため、定期的な検査や入職時検査が行われることがあります。さらに、結核高まん延国への渡航者や、そこからの帰国者、あるいは集団感染が発生した際のスクリーニングなどにも用いられます。
関連技術としては、IGRAの測定原理であるELISA法(Enzyme-Linked Immunosorbent Assay)やELISPOT法(Enzyme-Linked ImmunoSpot Assay)が挙げられます。これらの免疫学的測定技術は、微量のサイトカインを正確に検出するために不可欠です。また、結核菌特異抗原の開発は、BCG接種の影響を排除し、検査の特異度を向上させる上で極めて重要でした。検査の効率化と標準化には、自動分析装置の導入も貢献しています。将来的には、次世代シーケンサーを用いた結核菌のゲノム解析技術が、薬剤耐性診断や感染経路の追跡、疫学調査などに応用される可能性も期待されています。
市場背景としては、世界保健機関(WHO)が掲げる「End TB Strategy」に代表されるように、結核の撲滅に向けた国際的な取り組みが強化されており、潜在性結核感染症の診断と治療は、その重要な柱の一つと位置づけられています。日本国内では、結核患者数は減少傾向にあるものの、高齢者層での発病や外国出生者の患者増加など、依然として課題が残っています。このような状況において、IGRAはツベルクリン反応検査に代わる検査として、その高い特異度と感度から普及が進んでいます。主要なメーカーとしては、QFTを開発したQIAGEN社や、T-SPOT.TBを開発したOxford Immunotec社(現在はPerkinElmer社傘下)などが挙げられます。日本国内では、特定の条件下で潜在性結核感染症検査が保険適用されており、医療機関での導入が進んでいます。
将来の展望としては、まず、より高感度・高特異度な新規バイオマーカーの開発が期待されています。これにより、潜在性結核感染症と活動性結核の鑑別をより正確に行い、治療効果の判定にも役立つマーカーの発見が望まれます。また、迅速かつ簡便な検査法、特にPOCT(Point-of-Care Testing)の実現が重要な課題です。採血から結果までを短時間で行えるキットが開発されれば、医療資源が限られた地域や緊急時においても、より迅速な診断と介入が可能になります。AIを活用した画像診断技術と潜在性結核感染症検査を組み合わせることで、診断精度をさらに向上させる研究も進められています。ゲノム解析技術の応用は、薬剤耐性菌の早期発見や感染経路の追跡に貢献し、結核対策の個別化を推進するでしょう。グローバルな視点では、低・中所得国における検査の普及とアクセス改善が、世界的な結核撲滅目標達成のために不可欠です。最終的には、これらの進歩を通じて、潜在性結核感染症治療の最適化、すなわち患者一人ひとりの状態に合わせた個別化医療の推進が期待されています。