肢端肥大症治療市場規模・シェア分析 2025-2030年、成長トレンドと予測
肢端肥大症治療市場レポートは、製品タイプ(ソマトスタチンアナログ、成長ホルモン受容体拮抗薬、ドーパミンアゴニスト、およびその他の製品タイプ)、流通チャネル(病院薬局、小売薬局、オンライン薬局)、および地域(北米、欧州、アジア太平洋など)によってセグメント化されています。市場予測は、金額(米ドル)で提供されます。

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
肢端肥大症治療市場の概要
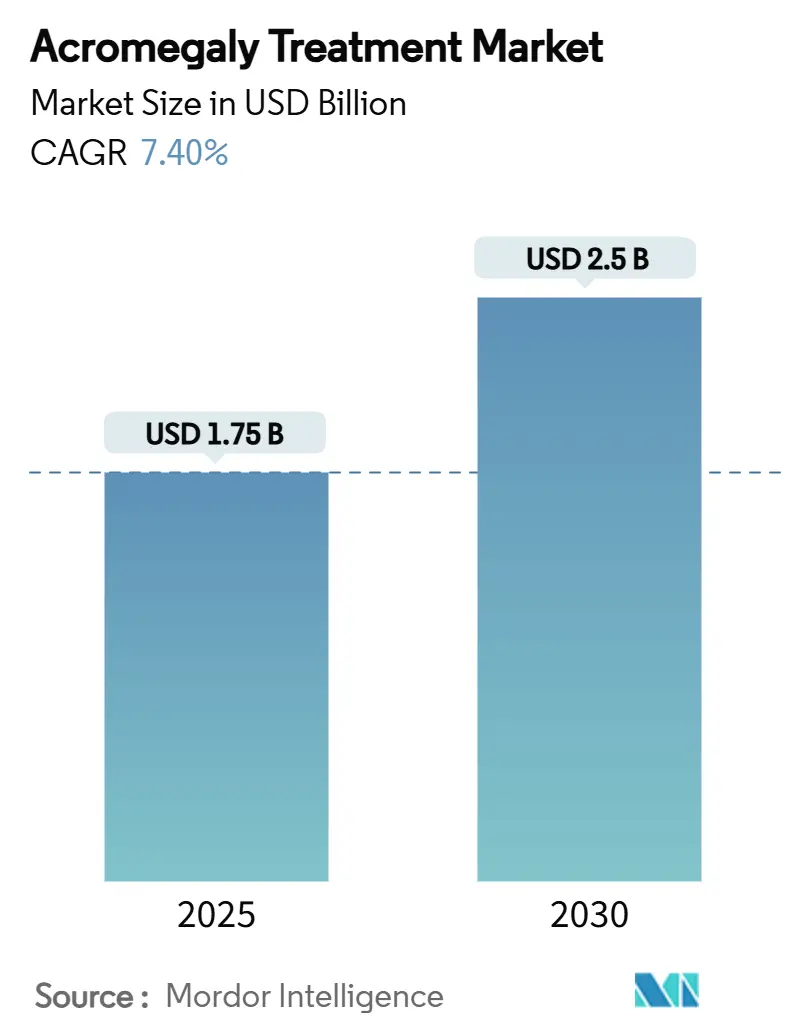
肢端肥大症治療市場は、2025年には17.5億米ドル、2030年には25.0億米ドルに達すると予測されており、2025年から2030年にかけて年平均成長率(CAGR)7.40%で成長する見込みです。この成長は、診断患者数の増加、早期診断プロトコルの導入、患者に優しい長時間作用型製剤の継続的な発売によって牽引されています。業界参加者は、生化学的コントロール率を改善し、投与頻度を減らす臨床プログラムにより多くの予算を割り当てており、支払者は治療費を相殺するために成果ベースの契約を試行しています。経口治療薬が市場に登場するにつれて、特にオンライン薬局などのデジタル流通チャネルが急速に拡大しており、専門外科センターは補助的な薬物療法の需要を強化しています。新興バイオテクノロジー企業が差別化されたデリバリープラットフォームで既存企業に挑戦しているため、競争の勢いは激化しており、パイプライン主導の市場リーダーシップの転換が期待されています。
市場概要
本市場は、製品タイプ(ソマトスタチンアナログ、成長ホルモン受容体拮抗薬、ドーパミンアゴニスト、その他の製品タイプ)、流通チャネル(病院薬局、小売薬局、オンライン薬局)、および地域(北米、欧州、アジア太平洋など)によってセグメント化されています。調査期間は2019年から2030年で、2025年の市場規模は17.5億米ドル、2030年には25.0億米ドルに達し、2025年から2030年までの成長率はCAGR 7.40%と予測されています。最も急速に成長する市場はアジア太平洋地域であり、最大の市場は北米です。市場の集中度は中程度です。
セグメント分析
1. 製品タイプ別:ソマトスタチンアナログが優位性を維持
製品タイプ別では、ソマトスタチンアナログが2024年に肢端肥大症治療市場の55.0%を占め、Somatuline(ランレオチド)の売上が11億2,130万米ドルに達し、市場を牽引しました。このセグメントは、第一選択薬としての広範なガイドライン推奨と、患者の利便性を高めるデポ製剤の革新によって恩恵を受けています。成長ホルモン受容体拮抗薬は市場シェアは小さいものの、ペグビソマントやパイプライン製品が高い生化学的正常化率を示すことから、2030年までにCAGR 9.5%で成長すると予測されています。経口非ペプチド製剤であるパルトソチンは、PATHFNDR-1試験で83%のIGF-1コントロールを示し、将来的に1日1回の経口治療への処方パターンの変化を示唆しています。
パイプライン活動は競争環境を再構築しており、CAM2029は患者が自己注射可能なオートインジェクターによる月1回の皮下投与を提供し、服薬遵守を改善し、クリニック受診回数を減らします。開発企業は、難治性疾患のニッチ市場を開拓するために、アンチセンスRNAやGHRH受容体遮断薬も模索しています。これらのモダリティが後期臨床試験に進むにつれて、経口および自己投与製品が病院投与の注射剤からシェアを奪い、収益源の再分配が起こる可能性があります。
2. 流通チャネル別:病院薬局がリード、オンラインセグメントが急増
流通チャネル別では、複雑な注射剤が通常専門医の監督下で開始されるため、病院薬局が2024年に肢端肥大症治療市場の61.0%を占めました。このチャネルは、統合されたケアパスウェイ、バンドルサービス請求、および綿密なモニタリング機能から恩恵を受けています。新しい長時間作用型デポ製剤も開始時、用量調整、MRIフォローアップに専門医の監督が必要であるため、病院薬局の市場規模は安定して推移するでしょう。
オンライン薬局は、コールドチェーン管理が不要な経口薬の商業化に牽引され、CAGR 13.6%で最も急速に成長しているチャネルです。遠隔医療の普及によりフォローアップ診察の地理的障壁が取り除かれ、認定されたe-薬局が高価な内分泌薬を患者に直接届けることが可能になっています。処方薬価格透明化法などの規制は広範な価格差を浮き彫りにしており、透明性の高い価格設定と患者への直接流通が、今後5年間でオンラインセグメントが肢端肥大症治療市場のシェアをさらに獲得する要因となるでしょう。
地域分析
北米は、2024年に肢端肥大症治療市場の43.0%を占め、引き続き市場の主要な牽引役となっています。米国には約27,000人の診断患者がおり、そのうち11,000人が薬物療法を受けています。インフレ抑制法によりメディケア・パートDの自己負担額に2,000米ドルの上限が導入され、高齢患者の服薬遵守が改善される可能性があります。ボストン、ヒューストン、ロサンゼルスなどの学術センターは、経口ソマトスタチン受容体アゴニストの早期採用者であり、地域全体の医師の経験曲線とガイドライン更新に影響を与えています。
欧州は売上高で第2位であり、長時間作用型デポ製剤の広範な使用と堅固な専門医ネットワークに支えられています。調査対象の脳下垂体腫瘍専門センターの報告によると、患者の48.9%が薬物療法を受けており、第一世代ソマトスタチン受容体リガンドが約半数の患者で好ましい選択肢となっています。NICEやIQWiGなどの健康技術評価機関は、臨床的価値の増分を厳しく評価しており、活発な価格交渉につながる一方で、費用対効果の高いデポ製剤の採用を促進しています。EMAの承認サイクルは予測可能であり、ドイツ、フランス、イタリアなどの主要経済圏における肢端肥大症治療市場の着実な拡大を支えています。
アジア太平洋地域の肢端肥大症治療市場は、2030年までにCAGR 8.2%で成長すると予測されています。中国、日本、韓国が地域全体の大部分を占めており、専門医の増加と民間保険の適用拡大が貢献しています。タイの希少疾病監査では、推奨される医薬品の46.8%しか登録されておらず、必須医薬品としてリストされているのは22.93%に過ぎず、アクセスギャップが依然として存在することを浮き彫りにしています。インドの5億7,450万米ドルの生産連動型インセンティブ制度は、複雑な注射剤の国内製造を促進し、コスト削減と供給拡大を目指しています。地域政府がユニバーサルヘルスプログラムを展開するにつれて、手頃な価格のデポ製剤や経口治療薬への需要が高まり、肢端肥大症治療市場全体を押し上げるでしょう。
市場の推進要因
市場の成長を促進する主な要因は以下の通りです。
* 成長ホルモン分泌性下垂体腺腫の有病率上昇: 世界的に肢端肥大症の発生率が10万人年あたり0.38人、有病率が10万人あたり5.9人に達しており、高解像度MRIや高感度IGF-1アッセイにより診断遅延が短縮され、特に中年層で潜在的な症例が発見されています。
* 内分泌学会ガイドライン改訂による早期診断: 第14回肢端肥大症コンセンサスにより、確認閾値がIGF-1レベルの正常上限の1.3倍にシフトし、ルーチンのGH抑制試験の必要性がなくなりました。これにより診断ラグが5~7年(以前は10~12年)に短縮され、以前は進行した疾患状態にあった患者が早期に治療市場に加わることになります。
* 長時間作用型デポ製剤への移行: 欧州の内分泌専門医は、自宅で自己投与可能な月1回投与のデポ注射剤の処方を増やしています。CAM2029の第3相データでは、参加者の77.2%が生化学的コントロールを達成し、患者の88.9%が利便性と注射部位反応の少なさから長時間作用型製剤を好むと回答しています。
* 希少疾病用医薬品インセンティブによる研究開発資金の加速: 現在、米国またはEUで7つの治験薬が希少疾病用医薬品指定を受けており、手数料免除、税額控除、欧州での10年間の独占販売権が与えられています。これらのインセンティブは開発リスクを低減し、ベンチャーキャピタルを誘致し、競争分野を拡大することで、肢端肥大症治療市場の高い成長軌道を維持するイノベーションサイクルを強化しています。
* MRIガイド下経蝶形骨手術の採用拡大による補助療法需要の創出: MRIガイド下経蝶形骨手術の採用が増加しており、これにより補助的な薬物療法の需要が生まれています。
* 国家希少疾病償還リストの拡大: 中国、ブラジル、GCC諸国などで希少疾病用医薬品の償還リストが拡大しており、治療へのアクセスが改善されています。
市場の抑制要因
一方、市場の成長を抑制する要因も存在します。
* 注射後線維症および脂肪萎縮症によるデポ製剤の服薬遵守制限: 注射可能なソマトスタチンアナログの長期使用は、患者の最大20%に注射部位反応を引き起こし、5~8%が重度の線維症や脂肪萎縮症を発症し、治療レジメンの変更を余儀なくされることがあります。
* ペグビソマント誘発性肝酵素上昇によるモニタリングの必要性: ペグビソマントはIGF-1を正常化するものの、肝酵素上昇のため定期的な肝機能モニタリングが必要であり、年間1,200~1,800米ドルの追加治療コストが発生し、支払者の監視を強化しています。ソマトスタチンアナログとの併用療法では肝毒性リスクが11~15%に上昇するため、肝臓への負担が少ない次世代拮抗薬の開発が進められています。
* 低所得国における専門センターの不足: アフリカやカリブ海諸国などの低所得地域では、専門医センターが限られており、治療へのアクセスが困難です。
* 高額な年間治療費: 年間25万米ドルを超える高額な治療費は、支払者の予算を圧迫し、特にユニバーサルヘルスケアが普及していない地域で大きな影響を与えています。
競争環境
肢端肥大症治療市場の集中度は中程度です。Ipsen社はSomatulineでリーダーシップを維持しており、企業収益の約3分の1を占めています。Novartis社とPfizer社も幅広いポートフォリオを通じて安定した地位を保持しています。Recordati社は希少疾患に特化した内分泌資産を買収し、存在感を強化しました。新規参入企業は差別化されたデリバリープラットフォームを重視しており、CAM2029は自宅での月1回投与を、パルトソチンは注射の完全な排除を目指しています。Amolyt Pharma社のAZP-3813は、ペグビソマントの欠点である肝毒性の改善を目指しています。
戦略的提携やライセンス契約が技術移転を加速させており、Ipsen社はデバイス企業と提携して看護師の投与時間を短縮するプレフィルドシリンジを共同開発しています。Crinetics社は、2025年の承認に先立ち供給を確保するため、シンガポールの受託製造業者と協力しています。オクトレオチドナノデポシステムや経口受容体アゴニストの特許出願は前年比18%増加しており、米国と欧州に集中していますが、韓国と中国でも増加しています。デジタル治療薬も競争の新たな側面として浮上しており、遠隔IGF-1モニタリングアプリとスマートインジェクターを組み合わせたパイロット研究が米国の学術センターで進行中です。
未開拓の機会は、第一世代アナログ治療患者の最大40%に影響する治療抵抗性疾患にあります。ペグビソマントとソマトスタチンアナログを統合した併用療法は90%の生化学的コントロールを報告していますが、依然としてコストが高く、モニタリングが頻繁に必要です。リアルワールドエビデンスに基づいたバリューベースの価格設定を導入する企業は、支払者の抵抗を打ち破り、肢端肥大症治療市場内でのリーチを拡大できる可能性があります。
主要企業には、Novartis AG、Ipsen SA、Pfizer Inc.、Recordati S.p.A.、Amryt Pharma plcなどが挙げられます。
最近の業界動向
* 2025年5月: 欧州医薬品庁(EMA)の医薬品評価委員会(CHMP)は、ソマトスタチンアナログに反応した肢端肥大症成人患者の維持療法としてOczyesa(オクトレオチド)に対し肯定的な意見を表明しました。
* 2025年3月: Crinetics Pharmaceuticals社は、1日1回経口投与の選択的ソマトスタチン受容体タイプ2アゴニストであるパルトソチンに対し、EUの希少疾病用医薬品指定を受けました。
* 2025年2月: Camurus社は、CAM2029で治療された患者の77.2%がIGF-1 ≤ 1 ULNを達成したことを示すACROINNOVAデータを発表しました(プラセボ群では37.5%)。
本レポートは、成長ホルモン分泌性下垂体腺腫の成人患者を対象とした先端巨大症治療薬市場に関する詳細な分析を提供しています。血清IGF-1の正常化または腫瘍負荷の制御を目的とする処方箋医薬品(ブランド品およびジェネリック品)が対象であり、メーカー販売価格に基づき、病院薬局、小売薬局、オンライン薬局の3つの流通チャネルを通じて、世界17カ国における収益を追跡しています。手術費、放射線治療サービス、診断用画像機器は本分析の範囲外です。
市場は、2025年に17.5億米ドルと評価され、2030年までに25億米ドルに達すると予測されています。ソマトスタチンアナログが市場の55%を占め、ガイドラインで推奨される第一選択薬としての地位と、ランレオチドなどの薬剤の堅調な売上を反映し、現在も市場を支配しています。オンライン薬局は、経口製剤(オクトレオチドカプセルなど)の登場と遠隔医療の普及により、13.6%の年平均成長率(CAGR)で牽引力を増しています。価格圧力に対しては、成果連動型契約や、メディケア・パートDの自己負担上限設定のような法改正を通じて、手頃な価格での提供とイノベーションの促進が図られています。特に、経口選択的ソマトスタチン受容体タイプ2アゴニストであるパルトソチンは、後期臨床試験で83%のIGF-1正常化を示し、EUで希少疾病用医薬品指定を受けており、2025年には市場に大きな変化をもたらす可能性があります。
市場の成長を促進する主な要因としては、成長ホルモン分泌性下垂体腺腫の有病率の上昇、内分泌学会のガイドライン普及による早期診断の進展、欧州における持続性デポ製剤への移行、希少疾病用医薬品インセンティブによる研究開発資金の加速、MRIガイド下経蝶形骨手術の採用拡大による補助療法需要の創出、中国、ブラジル、GCC諸国における希少疾病償還リストの拡大が挙げられます。
一方で、市場の成長を抑制する要因も存在します。注射後の線維症や脂肪萎縮がデポ製剤のコンプライアンスを制限すること、ペグビソマントによる肝酵素上昇がモニタリングを必要とすること、低所得のアフリカ諸国やカリブ海諸国における専門センターの不足、そして年間25万米ドルを超える高額な治療費が支払者の予算を圧迫している点などが挙げられます。
市場は、製品タイプ別(ソマトスタチンアナログ、成長ホルモン受容体拮抗薬、ドーパミンアゴニスト、その他の製品タイプ)、流通チャネル別(病院薬局、小売薬局、オンライン薬局)、および地域別(北米、欧州、アジア太平洋、中東・アフリカ、南米の主要国およびその他地域)に詳細に分析されています。
本レポートの調査方法は、内分泌科医、脳神経外科医、支払者、専門薬剤師への一次調査と、NIH、Eurostat、FDA、EMAなどの公的データベースや企業情報を含む二次調査を組み合わせています。市場規模の推計は、有病率に基づくトップダウンアプローチと、病院入札価格やサプライヤーの売上データに基づくボトムアップアプローチを併用し、診断時年齢、持続性注射剤への移行、ジェネリック薬の発売時期、希少疾病薬インセンティブ、地域別GDPなどの主要要因を考慮しています。競争環境については、市場集中度、主要企業の戦略的動向、市場シェア分析、およびファイザー、ノバルティス、イプセンなどの主要企業のプロファイルが含まれています。レポートでは、未開拓分野とアンメットニーズの評価を通じて、将来の市場機会と展望についても言及しています。

1. はじめに
- 1.1 調査の前提と市場の定義
- 1.2 調査範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場概況
- 4.1 市場概要
- 4.2 市場の推進要因
- 4.2.1 GH分泌性下垂体腺腫の有病率の上昇
- 4.2.2 内分泌学会ガイドラインの普及による早期診断
- 4.2.3 欧州における持続性デポ製剤への移行
- 4.2.4 希少疾病用医薬品のインセンティブによる研究開発資金の加速
- 4.2.5 MRIガイド下経蝶形骨手術の採用拡大による補助療法需要の創出
- 4.2.6 各国の希少疾患償還リストの拡大(中国、ブラジル、GCC)
- 4.3 市場の阻害要因
- 4.3.1 注射後の線維化と脂肪萎縮によるデポ製剤のコンプライアンス制限
- 4.3.2 ペグビソマント誘発性肝酵素上昇によるモニタリングの必要性
- 4.3.3 低所得のアフリカおよびカリブ諸国における専門センターの限定
- 4.3.4 高額な年間治療費(25万米ドル超)による支払者予算の制約
- 4.4 規制の見通し
- 4.5 ポーターの5つの力分析
- 4.5.1 新規参入者の脅威
- 4.5.2 買い手/消費者の交渉力
- 4.5.3 供給者の交渉力
- 4.5.4 代替品の脅威
- 4.5.5 競争の激しさ
5. 市場規模と成長予測(金額、米ドル)
- 5.1 製品タイプ別
- 5.1.1 ソマトスタチンアナログ
- 5.1.2 成長ホルモン受容体拮抗薬
- 5.1.3 ドーパミンアゴニスト
- 5.1.4 その他の製品タイプ
- 5.2 流通チャネル別
- 5.2.1 病院薬局
- 5.2.2 小売薬局
- 5.2.3 オンライン薬局
- 5.3 地域別
- 5.3.1 北米
- 5.3.1.1 米国
- 5.3.1.2 カナダ
- 5.3.1.3 メキシコ
- 5.3.2 ヨーロッパ
- 5.3.2.1 ドイツ
- 5.3.2.2 イギリス
- 5.3.2.3 フランス
- 5.3.2.4 イタリア
- 5.3.2.5 スペイン
- 5.3.2.6 その他のヨーロッパ
- 5.3.3 アジア太平洋
- 5.3.3.1 中国
- 5.3.3.2 日本
- 5.3.3.3 インド
- 5.3.3.4 オーストラリア
- 5.3.3.5 韓国
- 5.3.3.6 その他のアジア太平洋
- 5.3.4 中東 & アフリカ
- 5.3.4.1 GCC
- 5.3.4.2 南アフリカ
- 5.3.4.3 その他の中東 & アフリカ
- 5.3.5 南米
- 5.3.5.1 ブラジル
- 5.3.5.2 アルゼンチン
- 5.3.5.3 その他の南米
6. 競合情勢
- 6.1 市場集中度
- 6.2 戦略的動向
- 6.3 市場シェア分析
- 6.4 企業プロファイル(グローバルレベルの概要、市場レベルの概要、主要セグメント、利用可能な財務情報、戦略情報、主要企業の市場ランキング/シェア、製品 & サービス、および最近の動向を含む)
- 6.4.1 ファイザー株式会社
- 6.4.2 ノバルティスAG
- 6.4.3 イプセンSA
- 6.4.4 レコルダティS.p.A.
- 6.4.5 アムリット・ファーマplc
- 6.4.6 クリネティクス・ファーマシューティカルズ株式会社
- 6.4.7 アイオニス・ファーマシューティカルズ株式会社
- 6.4.8 アモリット・ファーマ
- 6.4.9 カムルスAB
7. 市場機会 & 将来展望
*** 本調査レポートに関するお問い合わせ ***

肢端肥大症治療について、包括的な概要を述べさせていただきます。
肢端肥大症は、脳下垂体から成長ホルモン(GH)が過剰に分泌されることによって引き起こされる稀な内分泌疾患でございます。この過剰なGH分泌は、通常、良性の下垂体腫瘍(成長ホルモン産生腺腫)が原因でございます。GHの過剰分泌は、肝臓からのインスリン様成長因子-1(IGF-1)の産生を促進し、これが全身の組織や臓器の異常な成長を引き起こします。特徴的な症状としては、手足の肥大、顔貌の変化(鼻や唇の肥厚、下顎の突出)、発汗の増加、頭痛、関節痛などが挙げられます。また、高血圧、糖尿病、心血管疾患、睡眠時無呼吸症候群、大腸ポリープなどの合併症を引き起こし、放置すると生命予後を悪化させる可能性がございます。そのため、GHおよびIGF-1の分泌を正常化し、腫瘍の増大を抑制し、合併症を改善・予防することが治療の主要な目的となります。
肢端肥大症の治療法には、主に手術療法、薬物療法、放射線療法の三つがございます。これらの治療法は、患者様の状態、腫瘍の大きさや位置、GH/IGF-1値、合併症の有無などを総合的に考慮して選択され、単独または組み合わせて用いられます。
まず、手術療法は、下垂体腺腫の摘出を目的とし、通常は第一選択として検討されます。最も一般的な術式は、経蝶形骨洞手術でございます。これは、鼻腔から蝶形骨洞を経由して下垂体に到達し、腫瘍を摘出する方法で、内視鏡を用いることでより低侵襲かつ精密な手術が可能となっております。手術の目標は、腫瘍を完全に摘出し、GHおよびIGF-1値を正常化させることでございます。腫瘍が小さい場合や、下垂体外への浸潤がない場合には、高い治癒率が期待できます。しかし、腫瘍が大きい場合や、周囲組織への浸潤がある場合には、完全摘出が困難なこともあり、その際には術後にGH/IGF-1値が正常化しないことがございます。
次に、薬物療法は、手術でGH/IGF-1値が正常化しなかった場合や、手術が困難な場合、あるいは手術前の腫瘍縮小目的などで用いられます。主な薬剤としては、ソマトスタチンアナログ製剤、ドーパミンアゴニスト製剤、GH受容体拮抗薬がございます。
ソマトスタチンアナログ製剤(オクトレオチド、ランレオチドなど)は、下垂体腺腫のソマトスタチン受容体に結合し、GHの分泌を抑制するとともに、腫瘍の増殖を抑制する効果がございます。注射剤として定期的に投与され、多くの患者様でGH/IGF-1値の低下と症状の改善が認められます。
ドーパミンアゴニスト製剤(ブロモクリプチン、カベルゴリンなど)は、下垂体腺腫のドーパミン受容体に作用し、GH分泌を抑制しますが、ソマトスタチンアナログ製剤に比べて効果は限定的でございます。プロラクチンも同時に過剰分泌されている混合型腺腫の患者様や、軽症の患者様で有効な場合がございます。
GH受容体拮抗薬(ペグビソマント)は、肝臓や末梢組織のGH受容体に結合し、GHが受容体に結合するのを阻害することで、IGF-1の産生を抑制します。GH値自体は低下させませんが、IGF-1値を強力に正常化させる効果がございます。他の治療法で効果が不十分な場合に用いられます。
最後に、放射線療法は、手術や薬物療法で効果が不十分な場合や、手術が適応とならない場合に選択されます。従来の外部照射放射線療法と、より精密な定位放射線手術(ガンマナイフ、サイバーナイフなど)がございます。定位放射線手術は、高線量の放射線を腫瘍に集中して照射することで、周囲の正常組織への影響を最小限に抑えつつ、腫瘍を制御する治療法でございます。放射線療法は、GH/IGF-1値の低下に時間がかかることや、下垂体機能低下症などの合併症のリスクがあるため、慎重に適用されます。
関連技術としては、診断における高精度な画像診断技術が挙げられます。MRIは下垂体腺腫の検出、大きさ、周囲組織との関係を評価するために不可欠でございます。また、GH分泌抑制試験(経口ブドウ糖負荷試験)やIGF-1測定などの生化学的検査は、診断確定と治療効果のモニタリングに必須でございます。手術においては、内視鏡を用いた経蝶形骨洞手術が主流となり、術中のナビゲーションシステムや画像誘導技術が手術の安全性と確実性を高めております。薬物療法では、持続性注射製剤の開発により、患者様の負担が軽減されております。放射線療法においては、三次元画像を用いた治療計画や、ロボットアームによる高精度な照射技術が進化しております。
市場背景としましては、肢端肥大症は稀な疾患(希少疾患)であり、その治療薬はオーファンドラッグとして開発・承認されることが多いです。ソマトスタチンアナログ製剤やGH受容体拮抗薬は高価であり、医療経済的な側面も考慮される必要がございます。世界的に見ても、これらの薬剤市場は特定の製薬会社によって寡占されており、新規薬剤の開発競争は活発でございます。診断の遅れが依然として課題であり、早期診断と早期治療介入の重要性が認識されております。
将来展望としましては、より効果的で安全な新規薬剤の開発が期待されております。例えば、経口ソマトスタチンアナログ製剤や、新たな作用機序を持つ薬剤(GH放出ホルモン受容体拮抗薬など)の研究が進められております。また、腫瘍の遺伝子変異や分子生物学的特性に基づいた個別化医療の導入も視野に入っております。手術においては、さらに低侵襲で高精度な術式の開発や、術中モニタリング技術の向上が期待されます。放射線療法では、副作用をさらに軽減しつつ効果を高めるための技術革新が続くでしょう。最終的には、患者様の生活の質(QOL)を最大限に高め、長期的な予後を改善するための、多角的なアプローチがさらに発展していくと考えられます。診断から治療、そして長期的なフォローアップまで、専門医によるチーム医療の重要性が今後ますます高まることでしょう。