細胞・遺伝子治療受託開発製造機関市場 規模・シェア分析 – 成長トレンド・予測 (2025年~2030年)
細胞・遺伝子治療CDMO市場レポートは、製品(細胞治療{幹細胞ベースなど}、遺伝子治療{ウイルスベクター、非ウイルスベクター})、段階(前臨床、臨床、商業)、サービスタイプ(プロセス開発、GMP製造など)、および地域(北米、欧州、アジア太平洋など)別に分類されます。市場予測は、金額(米ドル)で提供されます。

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
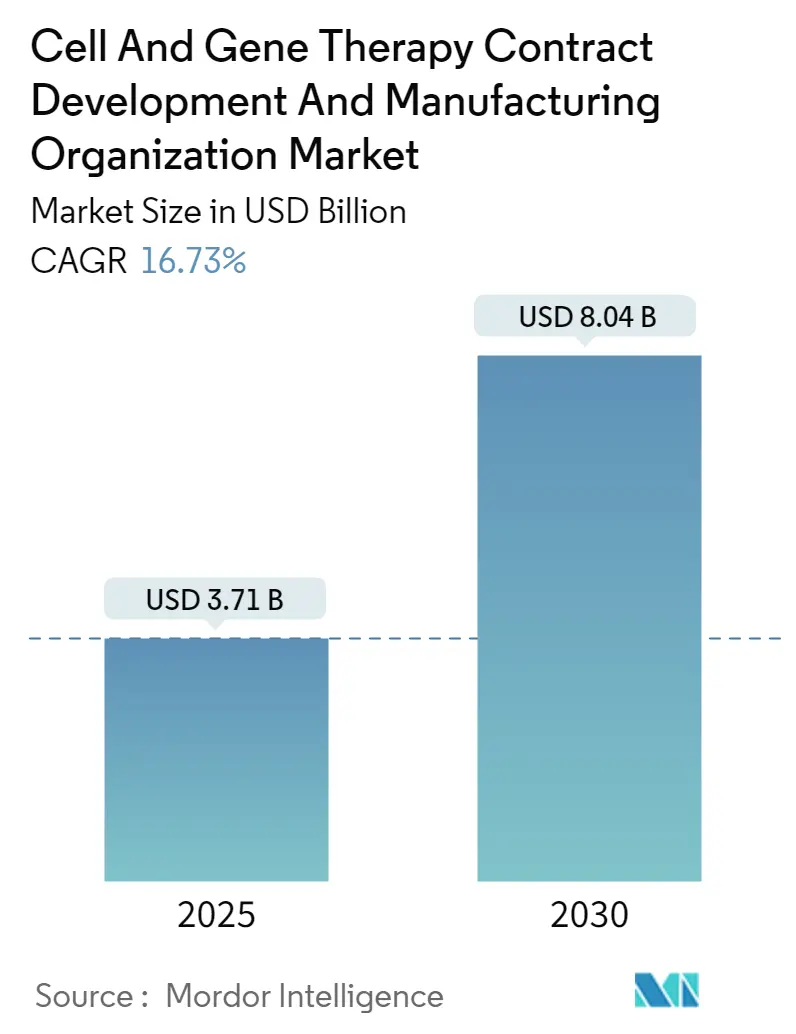
細胞・遺伝子治療の受託開発製造機関(CDMO)市場は、2025年には37.1億米ドルと評価され、2030年には80.4億米ドルに達すると予測されており、予測期間中の年平均成長率(CAGR)は16.73%と急成長が見込まれています。この急成長は、2,000件を超える臨床および前臨床プロジェクトの堅調なパイプラインと、規制当局が2025年までに年間10~20件の承認を期待していることに起因しています。
これに対応するため、CDMO各社は激しい設備増強競争に乗り出しており、2024年以降、100億米ドルを超える投資が発表されています。例えば、Samsung Biologicsは2025年までに784,000Lの生産能力を目指し、LonzaはVacavilleの施設を12億米ドルで買収し、ウイルスベクター向けに330,000Lを確保しました。また、Novo HoldingsがCatalentを165億米ドルで買収するなど、垂直統合の魅力が高まり、さらなる合併・買収の憶測を呼んでいます。しかし、COVID-19後の過剰設備により、一部の工場では稼働率が70%を下回っており、CDMOはより高利益な分析およびプロセス開発サービスの追加を余儀なくされています。
主要なレポートのポイント
* 製品別: 2024年には細胞治療が市場シェアの70.6%を占めましたが、遺伝子治療は2030年までに17.2%のCAGRで最も速い成長を遂げると予測されています。
* 段階別: 2024年には前臨床および研究開発活動が収益の70.8%を占めましたが、商業製造は15.3%のCAGRで成長すると見込まれています。
* サービスタイプ別: 2024年には受託製造が市場の35.8%を占めましたが、GMP製造は2030年までに13.4%のCAGRで増加すると予測されています。
* 地域別: 2024年には北米が44.2%のシェアで市場をリードしましたが、アジア太平洋地域は15.8%のCAGRで最も急速な成長を遂げると予測されています。
市場成長の推進要因
1. CGT臨床パイプラインの増加: 2,000件を超える活発なプログラムが開発中であり、米国FDAは審査を効率化するために治療製品局を設立し、2025年までに毎年2桁の承認を予測しています。各候補は特注のウイルスベクターまたは細胞増殖ワークフローを必要とし、ほとんどのスポンサーはこれを社内で賄う専門知識が不足しています。Casgevy、Lyfgeniaなどの商業承認は需要を裏付け、多ロットの臨床供給注文を誘発しています。北米と欧州が治験の80%を占め、現地施設の負担を増やし、高価格設定を可能にしています。この要因は、CDMO市場の持続的な2桁成長を支えるものであり、CAGRに+4.20%の影響を与え、北米およびEUに集中しつつグローバルに、中期的に(2~4年)影響を及ぼすと見られています。
2. 遺伝性疾患およびがんの有病率の上昇: 約4億人の患者が遺伝性疾患を抱え、世界のがん発生率は年間2~3%増加しています。精密医療の進歩により、これまで治療不可能だった標的がウイルスベクターベースのアプローチで治療可能になりました。CAR-T療法は現在40万~50万米ドルの価格で、支払者が一度限りの介入に償還する意欲を示しています。高所得地域の高齢化は対象人口を増やし、糖尿病や心血管遺伝子治療の緊急承認は主流への普及を示唆しています。CDMOは、適応症の規模が拡大するにつれて、より大きなバッチサイズを供給できる体制を整えることで、最大の恩恵を受けるでしょう。この要因は、CAGRに+3.80%の影響を与え、先進国市場でより大きな影響を伴い、グローバルに、長期的に(4年以上)影響を及ぼすと見られています。
3. VCおよび大手製薬会社の資金調達の急増: 2024年にはバイオ医薬品企業とベンチャーファンドがCGT関連取引に150億米ドル以上を投入しました。Novo HoldingsによるCatalentの165億米ドルでの買収は、生産能力確保への戦略的意図を強調しています。資金流入は発見から第I相までの期間を短縮し、プロセス開発およびGMPロットの受注増加につながっています。資金流入は地域全体に及び、特に北米とヨーロッパで顕著であり、CGT分野の成長をさらに加速させています。この要因は、CAGRに+3.00%の影響を与え、グローバルに、長期的に(4年以上)影響を及ぼすと見られています。
4. 規制当局の承認の加速と簡素化: 規制当局は、CGT製品の迅速な承認を促進するために、適応症の拡大と優先審査経路を導入しています。米国FDAは、2023年にCGT製品の承認を2倍に増やし、2024年にはさらに多くの承認が予想されています。欧州医薬品庁(EMA)も同様に、条件付き承認や迅速評価を積極的に活用しています。この規制環境の進化は、市場投入までの時間を短縮し、CDMOにとってより多くの製造機会を生み出します。この要因は、CAGRに+2.70%の影響を与え、グローバルに、中長期的に(2~4年以上)影響を及ぼすと見られています。
5. 製造技術の進歩と自動化: CGT製造における自動化、閉鎖系システム、および連続生産プロセスの導入は、汚染リスクを低減し、スループットを向上させ、コストを削減します。例えば、GE HealthcareのFlexFactoryやThermo Fisher ScientificのCell Therapy Systemsのような統合プラットフォームは、製造プロセスの効率化を可能にしています。これらの技術革新は、CDMOがより大規模でコスト効率の高い生産を提供することを可能にし、市場の成長を支えます。この要因は、CAGRに+2.20%の影響を与え、グローバルに、長期的に(4年以上)影響を及ぼすと見られています。
これらの要因は複合的に作用し、細胞・遺伝子治療CDMO市場の堅調な成長を牽引すると予測されます。特に、CDMOは、専門知識、設備、および規制対応能力を提供することで、この急成長する分野において不可欠な役割を果たすでしょう。
市場の課題と制約
CGT市場は大きな可能性を秘めている一方で、いくつかの重要な課題と制約に直面しており、CDMO市場の成長にも影響を与える可能性があります。
1. 高額な治療費と償還の不確実性: CAR-T療法のようなCGT製品は、その革新性にもかかわらず、非常に高額であり、単回治療で数十万ドルに達することがあります。この高額な費用は、医療システムや保険会社にとって大きな負担となり、償還モデルの確立が課題となっています。支払者は、長期的な有効性と費用対効果に関するさらなるデータや、成果ベースの支払いモデルを求めています。償還の不確実性は、患者アクセスを制限し、結果としてCGT製品の需要とCDMOへの製造委託量に影響を与える可能性があります。この要因は、CAGRに-2.00%の影響を与え、グローバルに、中長期的に(2~4年以上)影響を及ぼすと見られています。
2. 複雑な製造プロセスと品質管理の課題: CGT製品の製造は、生細胞やウイルスベクターを使用するため、非常に複雑で、高度な専門知識と厳格な品質管理が求められます。バッチ間のばらつき、汚染リスク、およびスケールアップの困難さは、CDMOにとって大きな課題です。特に、自家細胞療法では患者ごとに個別の製造が必要となるため、標準化と効率化が難しい側面があります。これらの製造上の複雑さは、生産コストを押し上げ、リードタイムを延長し、CDMOの能力と収益性に影響を与える可能性があります。この要因は、CAGRに-1.50%の影響を与え、グローバルに、長期的に(4年以上)影響を及ぼすと見られています。
3. 熟練した人材の不足: CGT分野の急速な成長に伴い、プロセス開発、製造、品質管理、規制対応など、専門的なスキルを持つ人材の需要が急増しています。しかし、この分野は比較的新しいため、必要な専門知識と経験を持つ人材が不足しています。この人材不足は、CDMOが生産能力を拡大し、新しい技術を導入する上でのボトルネックとなり、運営コストの増加やプロジェクトの遅延につながる可能性があります。この要因は、CAGRに-1.00%の影響を与え、グローバルに、長期的に(4年以上)影響を及ぼすと見られています。
4. サプライチェーンの脆弱性: CGT製造には、特殊な原材料、試薬、および機器が必要であり、これらのサプライチェーンは比較的ニッチで脆弱な場合があります。特定のウイルスベクターや細胞培養培地の供給不足は、製造スケジュールに大きな影響を与え、CDMOの生産能力を制限する可能性があります。また、原材料の品質と一貫性の確保も重要な課題です。サプライチェーンの混乱は、製造コストの増加、リードタイムの延長、および市場投入の遅延につながる可能性があります。この要因は、CAGRに-0.80%の影響を与え、グローバルに、中長期的に(2~4年以上)影響を及ぼすと見られています。
これらの課題は、CGT CDMO市場の成長を抑制する可能性がありますが、業界はこれらの問題に対処するために、技術革新、戦略的パートナーシップ、および規制当局との協力を通じて積極的に取り組んでいます。
このレポートは、細胞・遺伝子治療CDMO(受託開発製造機関)市場に関する詳細な分析を提供しています。細胞・遺伝子治療CDMOサービスとは、生きた細胞や遺伝物質を用いた疾患治療薬の開発、製造、試験を支援する専門的なサービスを指します。本報告書は、製品(細胞治療、遺伝子治療)、開発段階(前臨床、臨床、商業)、適応症(腫瘍学、心血管疾患、感染症、遺伝性疾患、神経疾患など)、および地域(北米、欧州、アジア太平洋、中東・アフリカ、南米)別に市場をセグメント化し、世界の主要地域における17カ国の市場規模とトレンドを推定しています。
市場の現状と予測に関して、細胞・遺伝子治療CDMO市場は2025年に37.1億米ドルに達し、2030年には年平均成長率(CAGR)16.73%で成長し、80.4億米ドルに達すると予測されています。
市場を牽引する主な要因としては、細胞・遺伝子治療の臨床パイプラインの増加、遺伝性疾患やがんの有病率の上昇、ベンチャーキャピタル(VC)および大手製薬会社からの資金調達の急増が挙げられます。また、小規模な細胞・遺伝子治療開発企業によるアウトソーシングの選好、大規模バッチCDMO能力を必要とする同種異系「既製(off-the-shelf)」プラットフォームの登場、そしてFDA、EMA、PMDA間のグローバルなCMC(製造・品質管理)申請書類の調和による複数地域での上市期間の短縮も、市場成長を後押ししています。
一方で、市場の成長を抑制する要因も存在します。大規模なAAV(アデノ随伴ウイルス)生産における高スループット分析の限界、複雑で手作業に依存する製造プロセスと規制上の課題、GMP(医薬品製造管理および品質管理基準)グレードのプラスミドおよびウイルス原材料の不足が挙げられます。さらに、COVID-19後のCDMOの過剰供給が利益率の圧迫につながっている状況も見られます。
製品別では、細胞治療が2024年に市場シェアの70.6%を占め、承認済みのCAR-T製品や深い同種異系パイプラインに牽引され、最大の収益貢献セグメントとなっています。遺伝子治療もウイルスベクターと非ウイルスベクターに分かれ、重要なセグメントです。サービスタイプには、プロセス開発、GMP製造、分析試験/品質管理(QC)、充填・包装が含まれます。
地域別に見ると、アジア太平洋地域が2030年までに15.8%のCAGRで最も急速に成長すると予測されており、中国、日本、韓国における設備投資がその成長を支えています。
競争環境においては、業界の統合が進んでおり、例えばNovo HoldingsによるCatalent買収のような大型M&Aは、サプライヤーの数を減らし、残存する独立系企業に価格交渉力を与え、委託元企業に複数年契約での能力確保を促しています。CDMOは、手作業によるコストの最大60%削減と失敗リスクの低減、再現性の向上、リードタイムの短縮のため、自動化への大規模な投資を行っています。主要なCDMOを差別化する能力としては、ウイルスベクターと細胞処理を統合したスイート、高度な分析技術、およびIND(治験薬申請)から商業上市までのエンドツーエンドプログラムに対応できるグローバルな規制専門知識が挙げられます。
このレポートは、市場の機会と将来の展望についても触れており、未開拓分野や満たされていないニーズの評価を行っています。

1. はじめに
- 1.1 調査の前提 & 市場の定義
- 1.2 調査範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場概況
- 4.1 市場概要
-
4.2 市場の推進要因
- 4.2.1 CGT臨床パイプラインの増加
- 4.2.2 遺伝性疾患およびがんの有病率の上昇
- 4.2.3 VCおよび大手製薬会社の資金調達の急増
- 4.2.4 小規模CGT開発者のアウトソーシング志向
- 4.2.5 大量生産CDMO能力を必要とする同種「既製」プラットフォーム
- 4.2.6 グローバルCMCドシエの調和(FDA-EMA-PMDA)による複数地域での発売期間の短縮
-
4.3 市場の阻害要因
- 4.3.1 大規模AAV生産における限定的なハイスループット分析
- 4.3.2 複雑で手作業の多い製造および規制上の課題
- 4.3.3 GMPグレードのプラスミドおよびウイルス原料の不足
- 4.3.4 COVID後CDMOの過剰生産能力によるマージン圧迫
- 4.4 サプライチェーン分析
- 4.5 規制環境
- 4.6 技術的展望
-
4.7 ポーターの5つの力分析
- 4.7.1 供給者の交渉力
- 4.7.2 買い手の交渉力
- 4.7.3 新規参入の脅威
- 4.7.4 代替品の脅威
- 4.7.5 業界内の競争
5. 市場規模と成長予測(金額)
-
5.1 製品別
- 5.1.1 細胞療法
- 5.1.1.1 幹細胞ベース
- 5.1.1.2 非幹細胞ベース
- 5.1.1.3 その他の細胞療法
- 5.1.2 遺伝子治療
- 5.1.2.1 ウイルスベクター
- 5.1.2.2 非ウイルスベクター
-
5.2 段階別
- 5.2.1 前臨床
- 5.2.2 臨床
- 5.2.3 商業
-
5.3 サービスタイプ別
- 5.3.1 プロセス開発
- 5.3.2 GMP製造
- 5.3.3 分析試験 / 品質管理
- 5.3.4 充填・最終包装
-
5.4 地域別
- 5.4.1 北米
- 5.4.1.1 米国
- 5.4.1.2 カナダ
- 5.4.1.3 メキシコ
- 5.4.2 欧州
- 5.4.2.1 ドイツ
- 5.4.2.2 イギリス
- 5.4.2.3 フランス
- 5.4.2.4 イタリア
- 5.4.2.5 スペイン
- 5.4.2.6 その他の欧州
- 5.4.3 アジア太平洋
- 5.4.3.1 中国
- 5.4.3.2 日本
- 5.4.3.3 インド
- 5.4.3.4 韓国
- 5.4.3.5 オーストラリア
- 5.4.3.6 その他のアジア太平洋
- 5.4.4 中東・アフリカ
- 5.4.4.1 GCC
- 5.4.4.2 南アフリカ
- 5.4.4.3 その他の中東・アフリカ
- 5.4.5 南米
- 5.4.5.1 ブラジル
- 5.4.5.2 アルゼンチン
- 5.4.5.3 その他の南米
6. 競合情勢
- 6.1 市場集中度
- 6.2 市場シェア分析
-
6.3 企業プロファイル(グローバル概要、市場概要、主要セグメント、財務、戦略情報、市場順位/シェア、製品・サービス、最近の動向を含む)
- 6.3.1 ロンザグループ
- 6.3.2 カタレント社
- 6.3.3 サーモフィッシャーサイエンティフィック(パテオン)
- 6.3.4 薬明康徳アドバンストセラピー
- 6.3.5 サムスンバイオロジクス
- 6.3.6 AGCバイオロジクス
- 6.3.7 チャールズ・リバー・ラボラトリーズ(コグネート)
- 6.3.8 レシファームAB
- 6.3.9 富士フイルムダイオシンスバイオテクノロジーズ
- 6.3.10 ミナリス再生医療
- 6.3.11 PCIファーマサービス
- 6.3.12 アルマックグループ
- 6.3.13 ファイザー・センターワン
- 6.3.14 KBIバイオファーマ
- 6.3.15 バイオセントリック
- 6.3.16 エレベートバイオ
- 6.3.17 イポスケシ
- 6.3.18 ジェネゼン
- 6.3.19 3Pバイオファーマシューティカルズ
- 6.3.20 オックスフォード・バイオメディカ
7. 市場機会 & 将来展望
*** 本調査レポートに関するお問い合わせ ***

細胞・遺伝子治療受託開発製造機関とは、製薬企業やバイオベンチャー企業が開発を進める細胞治療薬や遺伝子治療薬の、研究開発から製造、品質管理に至るまでの一連のプロセスを外部から受託する専門機関を指します。一般的にCDMO(Contract Development and Manufacturing Organization)と呼ばれ、高度な専門知識、特殊な設備、厳格な品質管理体制を要する細胞・遺伝子治療製品の開発・製造において、その複雑性と高コストを背景に、製薬業界における重要なパートナーとして位置づけられています。
この機関の主な役割は、クライアント企業が自社で抱える技術的、設備的、人的リソースの課題を解決し、製品の市場投入を加速させることにあります。具体的には、プロセス開発、分析法開発、治験薬製造、そして商業生産まで、製品ライフサイクルの様々な段階でサービスを提供します。特に、医薬品製造における国際的な品質基準であるGMP(Good Manufacturing Practice)に準拠した施設と体制を整え、高品質かつ安全な製品の安定供給を保証することが求められます。
細胞・遺伝子治療受託開発製造機関には、提供するサービス範囲や対象製品によっていくつかの種類があります。サービス範囲では、開発のみを受託するCDO(Contract Development Organization)、製造のみを受託するCMO(Contract Manufacturing Organization)、そして開発から製造まで一貫して手掛けるCDMOに大別されますが、細胞・遺伝子治療分野では、開発と製造の両方を手掛けるCDMOが主流となっています。対象製品では、iPS細胞やES細胞、CAR-T細胞などの細胞治療製品に特化した機関や、アデノ随伴ウイルス(AAV)やレンチウイルスベクターなどの遺伝子治療製品に特化した機関、あるいはその両方に対応する機関が存在します。また、開発初期段階の小規模生産に強みを持つ機関から、商業生産に対応できる大規模な施設を持つ機関まで、規模や専門性も多岐にわたります。
これらの機関が求められる背景には、細胞・遺伝子治療製品の開発・製造が持つ特有の難しさがあります。まず、生きた細胞やウイルスを扱うため、無菌操作や細胞培養、遺伝子導入といった高度な専門技術と、それらを支える特殊な設備が不可欠です。これらを自社で全て揃えるには莫大な初期投資と維持コストがかかります。また、製造プロセスは非常に複雑で、ロットごとの品質の均一性を保つための厳格な品質管理と、各国の薬事規制(日本におけるGCTP省令など)への適合が求められます。CDMOは、これらの専門知識、設備、規制対応のノウハウを一元的に提供することで、クライアント企業が開発コストを削減し、開発期間を短縮し、製造上のリスクを分散することを可能にします。これにより、クライアント企業は研究開発や臨床試験といったコア業務に集中できるというメリットも享受できます。
関連する技術は多岐にわたります。細胞培養技術では、大規模かつ効率的な細胞増殖を可能にするバイオリアクターや、3次元培養技術、さらには自動培養システムが重要です。遺伝子導入技術では、AAVやレンチウイルスなどのウイルスベクターの製造技術とその品質管理、非ウイルスベクター技術の開発が進められています。細胞分離・精製技術では、目的細胞を高純度で分離するためのフローサイトメトリーや磁気ビーズ分離などが用いられます。品質管理・分析技術は特に重要で、リアルタイムPCR、ELISA、次世代シーケンサー(NGS)を用いた遺伝子解析、細胞の特性評価、無菌試験、マイコプラズマ試験、エンドトキシン試験など、多角的な評価が求められます。また、細胞の生存率を維持するための凍結保存・輸送技術や、コールドチェーン管理も不可欠です。近年では、製造プロセスの自動化やデジタル化、AIを活用した品質管理、データインテグリティの確保といった技術も導入されつつあります。
市場背景としては、近年、癌や希少疾患、遺伝性疾患などに対する細胞・遺伝子治療薬の承認が世界的に増加しており、それに伴い開発パイプラインも豊富になっています。この成長市場において、製造の複雑性やコストの高さが依然として大きな課題であり、CDMOの需要は急速に拡大しています。特に、バイオベンチャー企業は自社で製造設備を持つことが難しいため、CDMOへの依存度が高い傾向にあります。大手製薬企業も、特定の技術や設備を持たない場合や、リスク分散のためにCDMOを活用するケースが増えています。また、各国での薬事規制の厳格化も、専門的な規制対応能力を持つCDMOの価値を高めています。原材料の安定供給や、製品の特性に応じた複雑な物流(コールドチェーンなど)の構築も、CDMOが解決すべき重要な課題となっています。
将来展望としては、細胞・遺伝子治療市場のさらなる拡大に伴い、CDMOの役割は一層重要になると考えられます。技術革新は継続し、製造プロセスの自動化・標準化、連続生産技術の導入、AIやIoTを活用したスマートファクトリー化が進むことで、製造コストの低減と生産効率の向上が期待されます。これにより、現在高額な細胞・遺伝子治療薬の価格が下がり、より多くの患者に治療が届くようになる可能性があります。また、グローバルな規制調和の動きが進む中で、国際的なサプライチェーンの構築や、各国の規制に対応できる体制を持つCDMOの競争力が高まるでしょう。特定の細胞種やベクターに特化した専門性の高いCDMOや、開発初期段階に特化したニッチなサービスを提供するCDMOなど、多様なニーズに応じた専門化が進むことも予想されます。競争激化に伴い、CDMO間のM&Aや、製薬企業との戦略的提携も増加すると考えられます。一方で、高度な専門知識を持つ人材の確保と育成は引き続き重要な課題であり、業界全体の成長を支える上で不可欠な要素となります。