細胞溶解市場:市場規模・シェア分析、成長動向、予測 (2025年~2030年)
細胞溶解市場は、製品タイプ(機器[ホモジナイザーなど]、および試薬)、細胞タイプ(哺乳類細胞、微生物細胞など)、溶解技術(機械的、酵素的など)、アプリケーション(タンパク質精製・プロテオミクスなど)、エンドユーザー(バイオテクノロジー・バイオ医薬品企業など)、および地域(北米、欧州など)によってセグメント化されています。市場予測は、金額(米ドル)で提供されます。

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
細胞溶解市場の概要:成長トレンドと予測(2025年~2030年)
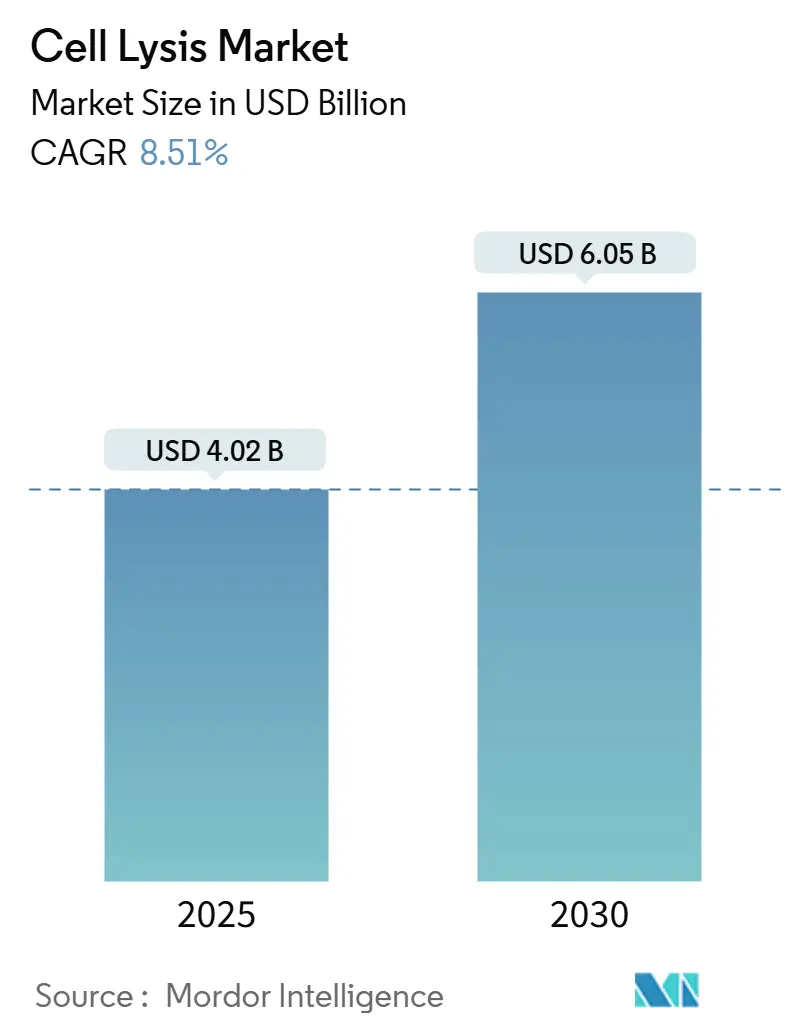
細胞溶解市場は、2025年には40.2億米ドルと評価され、2030年までに60.5億米ドルに達すると予測されており、年平均成長率(CAGR)8.51%で成長しています。この成長は、シングルセルオミクス、連続バイオプロセシング、自動化されたサンプル前処理プラットフォームへの継続的な投資によって支えられています。穏やかでありながらハイスループットな溶解プロトコルの広範な採用は、拡大する遺伝子治療パイプラインを支援し、スケーラブルな機械システムは哺乳類灌流ランにおける製品の完全性を保護しています。精密医療の要件との厳密な連携により、溶解効率と再現性が主要な購入基準として重視されています。企業は、汚染リスクを低減し、規制当局への申請を加速するために、閉鎖型で自動化されたハードウェアを優先しています。一方、細胞毒性洗剤を段階的に廃止する環境規制は、エコ準拠の試薬や検証済みの酵素カクテルへの調達を促しています。
主要なレポートのポイント
* 製品タイプ別: 試薬は2024年に52.35%の収益シェアを占めましたが、機器は2030年までに12.25%のCAGRで拡大すると予測されています。
* 細胞タイプ別: 哺乳類細胞は2024年に細胞溶解市場シェアの45.53%を占め、ウイルス粒子は2030年までに16.85%のCAGRで成長すると予測されています。
* 溶解技術別: 機械的方法は2024年に細胞溶解市場規模の45.82%を占め、酵素溶解は2030年までに10.61%のCAGRで進展しています。
* アプリケーション別: タンパク質精製およびプロテオミクスは2024年に細胞溶解市場規模の42.82%を占め、細胞ベースワクチンは2030年までに12.22%のCAGRで拡大しています。
* エンドユーザー別: バイオテクノロジーおよびバイオ医薬品企業は2024年に41.62%の収益シェアを占め、CRO/CMOセグメントは2030年までに13.41%のCAGRで成長しています。
* 地域別: 北米は2024年に38.82%の収益シェアを占め、アジア太平洋地域は2030年までに11.52%のCAGRで拡大すると予測されています。
市場の動向と洞察:促進要因
* シングルセルオミクスサンプル前処理需要の急増: シングルセルシーケンシングとプロテオミクスの急速な成長により、溶解要件は極めて穏やかで汚染管理が可能なものへと再調整されています。高度な液滴およびマイクロウェルプラットフォームは、数千の細胞を並行して処理し、下流のバーコーディングのためにRNAおよびタンパク質の完全性を維持する試薬処方が求められています。これにより、最小侵襲性腫瘍プロファイリングのためのキットが臨床検査室で活用され、細胞溶解市場が拡大しています。
* バイオ医薬品およびバイオシミラーパイプラインの拡大: ブロックバスター抗体の特許切れは、高細胞密度哺乳類培養を処理できる大容量でスケーラブルな溶解ハードウェアの需要を高める製造施設の建設を促しています。アジア太平洋地域の施設は470万リットル以上のステンレスおよびシングルユース容量を提供し、堅牢なホモジナイザーおよびマイクロフルイダイザーに対する地域的な需要を強化しています。
* ハイスループット自動化ワークフローの採用: 自動化は、運用上の利便性から戦略的必要性へと移行しています。AIガイドの超音波処理システムは、96ウェルプレート全体で音響エネルギーを均一化し、オペレーターのばらつきとバッチリリース偏差を大幅に削減しています。閉ループ温度制御を備えた機器は、熱に弱いタンパク質を保護し、脆弱なウイルスベクターへの適用範囲を広げています。
* 細胞ベースワクチンへの資金提供の増加: 公的資金は、ウイルスベクターおよびmRNAプラットフォーム向けの特殊な溶解ソリューションを促進しています。CEPIが支援するスピンフリージング技術や生体バイオリアクタープロジェクトには、宿主細胞を不活性化しつつエンベロープウイルスを保護する洗剤が必要です。これらの取り組みは、バイオセーフティの制約下で迅速にスケールアップできるGMPグレードの酵素および低せん断機械装置の需要を増幅させています。
* CRISPRベースの合成生物学ツールキットにおける穏やかな溶解の必要性: CRISPRベースの合成生物学ツールキットの採用は、細胞溶解市場の成長を促進する重要な要因です。これらの高度な遺伝子編集技術は、細胞の完全性を維持し、標的分子の損傷を最小限に抑えるために、非常に穏やかな溶解プロトコルを必要とします。
市場の動向と洞察:抑制要因
* 厳格なバイオプロセス検証およびQA/QCプロトコル: FDAがリアルタイムリリース試験を重視するようになったことで、製造業者はスケールや環境変数全体で溶解の一貫性を証明する必要があり、開発期間が長くなり、製造コストが増加しています。専用の品質チームを持たない小規模企業は高い障壁に直面し、広範な検証文書と過去の性能データを持つプラットフォームへの買い手の選好を強めています。
* マイクロ流体溶解システムの高い設備投資コスト: 最先端のマイクロ流体デバイスは、比類のない穏やかさとサンプル保存を提供しますが、リソースが限られた環境での採用を妨げる高額な価格設定となっています。総設置コストには、特殊なポンプ、使い捨てチップ、および独自のソフトウェアが含まれ、多くの収益前のスタートアップ企業にとって損益分岐点分析が手の届かないものとなっています。
* 細胞毒性洗剤の廃棄とESG圧力: EU規制により化学洗剤が厳しく監視されており、歴史的な性能に匹敵する生分解性界面活性剤への迅速な移行が加速しています。これにより、代替界面活性剤の認証とマスターバッチ記録の更新が推進され、試薬の売上は増加しますが、資格認定が完了するまで新しい機器の調達は遅れる可能性があります。
セグメント分析
* 製品タイプ別:試薬の優位性にもかかわらず、機器がイノベーションを牽引
試薬は2024年の収益の52.35%を占め、日常的なワークフローがバッチごとに消耗品に依存していることを示しています。しかし、機器は2030年までに12.25%のCAGRで試薬を上回ると予測されており、自動化されたバイオプロセシングにおける戦略的重要性を示しています。スマートホモジナイザーやビーズミルライザーの需要は、最小限のオペレーター介入で24時間365日の連続運転を目指すスポンサーが増えるにつれて増加しています。
* 細胞タイプ別:哺乳類細胞がリードし、ウイルス粒子が急増
哺乳類細胞は2024年の需要の45.53%を維持し、モノクローナル抗体および組換えタンパク質生産におけるその中心的な役割を反映しています。哺乳類培養の細胞溶解市場規模は、強化された灌流バイオリアクターが細胞密度を高め、堅牢でありながら穏やかな破壊を必要とするため、着実に拡大すると予測されています。しかし、ウイルス粒子は、遺伝子および細胞治療におけるアデノ随伴ウイルス(AAV)およびレンチウイルスベクタープログラムに牽引され、16.85%のCAGRで最も急速に成長する機会を表しています。
* 溶解技術別:酵素的成長にもかかわらず、機械的方法が優勢
機械的破壊は2024年に45.82%の収益シェアを占め、その堅牢性と簡単な検証により、スケールアップのデフォルトの選択肢としての地位を確立しています。高圧ホモジナイザーとビーズミルは、バッチ量全体で一貫した粒子サイズ縮小を提供し、大規模な抗体精製の基盤を形成しています。しかし、細胞溶解市場では、組換え酵素が下流分析に不可欠な立体構造エピトープを保存する低温処理を可能にするため、酵素的方法が10.61%のCAGRで成長しています。
* アプリケーション別:タンパク質精製がリードし、細胞ベースワクチンが加速
タンパク質精製およびプロテオミクスは2024年の収益の42.82%を占め、研究および製造における成熟した検証済みプロトコルで細胞溶解市場を支えています。抗体価の上昇とサブユニットワクチンへの関心の高まりが、このセグメントの回復力を維持しています。細胞ベースワクチンは12.22%のCAGRで拡大しており、ウイルス感染性を維持できる高度な溶解ソリューションを迅速に追跡する世界的なパンデミック対策資金の恩恵を受けています。
* エンドユーザー別:バイオテクノロジー企業がリードし、CRO/CMOセグメントが急増
バイオテクノロジーおよびバイオ医薬品企業は2024年の支出の41.62%を占め、社内のプロセス開発チームを活用して、特注の溶解ハードウェアと試薬を指定しています。CRO/CMOセクターは13.41%のCAGRを記録しており、グローバルなアウトソーシング需要に対応するために能力を拡大し、多様なクライアントプロトコルと互換性のあるターンキー溶解スキッドに対してかなりの定期注文を生み出しています。
地域分析
* 北米は2024年に38.82%の収益を占め、強固なバイオ医薬品製造基盤、NIHおよびBARDAからの多額の資金提供、検証済み自動化を奨励するFDAフレームワークに支えられています。米国は先進治療における新薬承認をリードし続けており、GMPグレードキットの国内需要を強化しています。
* アジア太平洋地域は、積極的な政府インセンティブとCDMO活動の増加に牽引され、11.52%のCAGRを達成すると予測されています。中国の2025年までの41.7億米ドルのバイオ製造へのコミットメントは、モノクローナルおよび遺伝子治療プログラム向けの閉鎖型自動溶解モジュールを指定する複数の工業団地を支えています。
* ヨーロッパは、厳格な環境政策が購買決定を左右する重要な市場であり続けています。Triton X-100の禁止は、生分解性洗剤への迅速な移行を強制し、先行サプライヤーに優位性をもたらしています。
* 南米および中東・アフリカは、全体的にシェアは小さいものの、分散型診断キットや地元のワクチン充填・仕上げ工場への関心が高まっています。インフラの制約は、高コストのマイクロ流体機器の短期的な採用を抑制し、柔軟な資金調達が可能な実績のある機械システムへの需要を合わせています。
競争環境
細胞溶解市場は中程度の集中度を示しており、グローバルな多国籍企業がかなりのシェアを占める一方で、ニッチなイノベーターが参入し続けています。Thermo Fisher Scientificは、自動化および試薬ポートフォリオを拡大するために400億~500億米ドルのM&Aを目標とする買収戦略を主導しています。Sartoriusは、契約製造業者と提携して高性能細胞株と下流プロセス機器をバンドルし、クライアントのタイムラインを短縮するターンキーパッケージを作成しています。
技術的な差別化は、閉鎖型自動化、AI支援パラメーター制御、およびエコ準拠の試薬化学に集中しています。QIAGENの今後のサンプル前処理機器は、プラスチック使用量の削減と合理化されたロボット統合を約束し、グリーン認証を求める研究室向けに同社を位置付けています。マイクロ流体企業はCAR-Tワークフローに有利な穏やかなせん断環境を強調し、超音波専門家はキャビテーション管理ソフトウェアを改良しています。
ホワイトスペースの機会は、シングルセル哺乳類ワークフロー、植物分子農業向けの酵素キット、およびラテンアメリカでの地域流通にあります。地元のCDMOとの合弁事業を追求するベンダーは、大規模な調達サイクルが始まる前に拡張プロジェクトへの早期アクセスを獲得し、優先サプライヤーの地位を確立しています。規制に関する専門知識、特に検証文書における専門知識は、GMP設備への入札において、確立されたプレーヤーにとって決定的な優位性であり続けています。
細胞溶解業界の主要企業
* Thermo Fisher Scientific
* Bio-Rad Laboratories, Inc.
* F. Hoffmann-La Roche Ltd.
* Merck KGaA
* Danaher Corporation
最近の業界動向
* 2025年4月: Thermo Fisher Scientificは、5L DynaDriveシングルユースバイオリアクターを発売し、生産性を27%向上させ、1Lから5,000Lへのスケールアップを簡素化しました。
* 2024年3月: SartoriusとLFB Biomanufacturingは提携し、バイオ医薬品パイプラインを加速する統合された細胞株開発および製造サービスを創出しました。
細胞ライシス市場に関する本レポートは、微生物、植物、動物細胞を破砕し、細胞内生体分子を回収するための試薬、消耗品キット、およびベンチトップからパイロット規模の装置の世界的な売上を対象としています。ただし、組織学や再生医療のみを目的とした組織解離酵素は範囲外とされています。
市場は2025年に40.2億米ドルと評価されており、2030年までに60.5億米ドルに達すると予測されています。
市場の主な成長要因としては、以下の点が挙げられます。
* シングルセルオミクスサンプル調製需要の急増
* バイオ医薬品およびバイオシミラーパイプラインの拡大
* ハイスループット自動ワークフローの採用
* 細胞ベースワクチンの資金増加
* 植物分子農業プラットフォームの導入
* CRISPRベースの合成生物学ツールキットにおける穏やかなライシス要件
一方、市場の抑制要因には、以下の課題があります。
* 厳格なバイオプロセス検証および品質保証/品質管理プロトコル
* マイクロ流体ライシスシステムの高い設備投資コスト
* 細胞毒性洗剤の廃棄とESG(環境・社会・ガバナンス)圧力
* 哺乳類細胞の集約におけるスケールアップの非効率性
レポートでは、市場を以下の主要なセグメントに分けて詳細に分析しています。
* 製品タイプ別: 装置(ホモジナイザー、ビーズミルライザー、超音波破砕装置、マイクロ流動化装置、遠心分離機など)と試薬(洗剤キット、酵素・ヌクレアーゼ、化学バッファー、完全ライシスキットなど)に分類されます。自動化への投資により、装置セグメントは2030年まで年平均成長率12.25%で最も急速に成長すると予測されています。
* 細胞タイプ別: 哺乳類細胞、微生物細胞、植物細胞、ウイルス粒子、その他が含まれます。遺伝子治療やワクチンプログラムにおいてウイルス感染性を保護する穏やかな破砕方法が求められるため、ウイルス粒子ライシスソリューションは年平均成長率16.85%で牽引しています。
* ライシス技術別: 機械的(物理的)、化学的/洗剤、酵素的、浸透圧ショックの各手法が分析されています。環境規制も市場に影響を与えており、Triton X-100のEUでの使用禁止は、生分解性洗剤や酵素ベースのキットへの移行を促しています。
* 用途別: タンパク質精製・プロテオミクス、核酸抽出・ゲノミクス、細胞ベースワクチン、創薬・スクリーニング、診断などが含まれます。
* エンドユーザー別: バイオテクノロジー・バイオ医薬品企業、受託研究・製造機関(CRO/CMO)、学術・研究機関、臨床診断センター、その他が対象です。
* 地域別: 北米(米国、カナダ、メキシコ)、欧州(ドイツ、英国、フランス、イタリア、スペイン、その他欧州)、アジア太平洋(中国、日本、インド、韓国、オーストラリア、その他アジア太平洋)、中東・アフリカ(GCC、南アフリカ、その他中東・アフリカ)、南米(ブラジル、アルゼンチン、その他南米)に区分されます。特に、中国とインドにおける大規模な生産能力増強により、アジア太平洋地域が年平均成長率11.52%で最も高い成長潜在力を示しています。
調査は、プロセス科学者や調達マネージャーへの電話・ウェブインタビューを含む一次調査と、NIH RePORTER助成金、Eurostat貿易データ、WHOバイオ医薬品パイプライン追跡などの公開データセット、企業年次報告書、投資家向けプレゼンテーション、D&B Hoovers、Dow Jones Factivaなどの二次調査を組み合わせた厳格な手法に基づいて実施されています。市場規模の推定と2030年までの予測は、トップダウンおよびボトムアップモデル、多変量回帰分析、シナリオ分析を用いて行われ、データの検証と更新も定期的に実施され、信頼性の高い情報を提供しています。
競争環境については、市場集中度、市場シェア分析、およびThermo Fisher Scientific Inc.、Danaher Corporation、Merck KGaA、Becton, Dickinson & Company、Bio-Rad Laboratories Inc.、Eppendorf AG、F. Hoffmann-La Roche Ltd、Takara Bio Inc.、QIAGEN NV、Miltenyi Biotecなど、主要企業の詳細なプロファイルが含まれています。

1. はじめに
- 1.1 調査の前提 & 市場の定義
- 1.2 調査範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場概況
- 4.1 市場概要
-
4.2 市場の推進要因
- 4.2.1 シングルセルオミクスサンプル調製需要の急増
- 4.2.2 拡大するバイオ医薬品 & バイオシミラーのパイプライン
- 4.2.3 ハイスループット自動ワークフローの採用
- 4.2.4 細胞ベースワクチンの資金調達の増加
- 4.2.5 植物分子ファーミングプラットフォームの採用
- 4.2.6 穏やかな溶解を必要とするCRISPRベースの合成生物学ツールキット
-
4.3 市場の阻害要因
- 4.3.1 厳格なバイオプロセス検証 & QA/QCプロトコル
- 4.3.2 マイクロ流体溶解システムの高い設備投資コスト
- 4.3.3 細胞毒性洗剤の廃棄 & ESG圧力
- 4.3.4 哺乳類細胞強化におけるスケールアップの非効率性
-
4.4 ポーターのファイブフォース
- 4.4.1 新規参入の脅威
- 4.4.2 買い手の交渉力
- 4.4.3 供給者の交渉力
- 4.4.4 代替品の脅威
- 4.4.5 競争上の対立
5. 市場規模 & 成長予測(金額、米ドル)
-
5.1 製品タイプ別
- 5.1.1 機器
- 5.1.1.1 ホモジナイザー
- 5.1.1.2 ビーズミルライザー
- 5.1.1.3 超音波破砕装置
- 5.1.1.4 マイクロフルイダイザー
- 5.1.1.5 遠心分離機
- 5.1.2 試薬
- 5.1.2.1 界面活性剤キット
- 5.1.2.2 酵素 & ヌクレアーゼ
- 5.1.2.3 化学緩衝液
- 5.1.2.4 完全溶解キット
-
5.2 細胞タイプ別
- 5.2.1 哺乳類細胞
- 5.2.2 微生物細胞
- 5.2.3 植物細胞
- 5.2.4 ウイルス粒子
- 5.2.5 その他
-
5.3 溶解技術別
- 5.3.1 機械的(物理的)
- 5.3.2 化学的 / 界面活性剤
- 5.3.3 酵素的
- 5.3.4 浸透圧ショック
-
5.4 用途別
- 5.4.1 タンパク質精製 & プロテオミクス
- 5.4.2 核酸抽出 & ゲノミクス
- 5.4.3 細胞ベースワクチン
- 5.4.4 創薬 & スクリーニング
- 5.4.5 診断
-
5.5 エンドユーザー別
- 5.5.1 バイオテクノロジー & バイオ医薬品企業
- 5.5.2 受託研究 & 製造機関 (CRO/CMO)
- 5.5.3 学術 & 研究機関
- 5.5.4 臨床診断センター
- 5.5.5 その他
-
5.6 地域
- 5.6.1 北米
- 5.6.1.1 米国
- 5.6.1.2 カナダ
- 5.6.1.3 メキシコ
- 5.6.2 欧州
- 5.6.2.1 ドイツ
- 5.6.2.2 英国
- 5.6.2.3 フランス
- 5.6.2.4 イタリア
- 5.6.2.5 スペイン
- 5.6.2.6 その他の欧州
- 5.6.3 アジア太平洋
- 5.6.3.1 中国
- 5.6.3.2 日本
- 5.6.3.3 インド
- 5.6.3.4 韓国
- 5.6.3.5 オーストラリア
- 5.6.3.6 その他のアジア太平洋
- 5.6.4 中東およびアフリカ
- 5.6.4.1 GCC
- 5.6.4.2 南アフリカ
- 5.6.4.3 その他の中東およびアフリカ
- 5.6.5 南米
- 5.6.5.1 ブラジル
- 5.6.5.2 アルゼンチン
- 5.6.5.3 その他の南米
6. 競合情勢
- 6.1 市場集中度
- 6.2 市場シェア分析
-
6.3 企業プロファイル(グローバルレベルの概要、市場レベルの概要、主要セグメント、利用可能な財務情報、戦略情報、主要企業の市場順位/シェア、製品&サービス、および最近の動向を含む)
- 6.3.1 Thermo Fisher Scientific Inc.
- 6.3.2 Danaher Corporation
- 6.3.3 Merck KGaA
- 6.3.4 Becton, Dickinson & Company
- 6.3.5 Bio-Rad Laboratories Inc.
- 6.3.6 Eppendorf AG
- 6.3.7 F. Hoffmann-La Roche Ltd
- 6.3.8 Takara Bio Inc.
- 6.3.9 QIAGEN NV
- 6.3.10 Miltenyi Biotec
- 6.3.11 Qsonica LLC
- 6.3.12 Claremont BioSolutions LLC
- 6.3.13 Microfluidics International Corp.
- 6.3.14 Labfreez Instruments Group Co.
- 6.3.15 Cell Signaling Technology Inc.
- 6.3.16 PerkinElmer (Revvity)
- 6.3.17 Agilent Technologies Inc.
- 6.3.18 Promega Corporation
- 6.3.19 New England Biolabs
- 6.3.20 Sigma-Aldrich (SAFC)
- 6.3.21 Illumina Inc.
- 6.3.22 Sartorius AG
7. 市場機会と将来展望
*** 本調査レポートに関するお問い合わせ ***

細胞溶解とは、細胞膜や細胞壁を物理的、化学的、または酵素的な手段を用いて破壊し、細胞内の内容物(タンパク質、核酸、オルガネラなど)を外部に放出させるプロセスを指します。この操作は、細胞内の特定の成分を単離、精製、分析、または操作するために不可欠な前処理工程であり、生命科学研究、バイオテクノロジー、医療診断など幅広い分野で基盤技術として利用されています。細胞溶解の目的は、目的とする分子を効率的に回収し、同時にその機能や構造を維持することにあります。
細胞溶解の方法には、主に物理的、化学的、酵素的アプローチがあり、細胞の種類や目的とする分子の性質に応じて最適な方法が選択されます。物理的溶解法としては、超音波処理が挙げられます。これは高周波音波を用いて細胞を振動させ、キャビテーション効果により細胞膜を破壊する方法で、比較的広範な細胞に適用可能です。フレンチプレスは、高圧下で細胞懸濁液を狭いオリフィスから押し出すことで、急激な圧力変化とせん断力により細胞を破砕します。ホモジナイザーやビーズミルも物理的なせん断力や衝撃を利用して細胞を粉砕する方法で、特に硬い細胞壁を持つ植物細胞や微生物の溶解に有効です。また、凍結融解を繰り返すことで細胞膜に損傷を与え、溶解を促進する方法もあります。化学的溶解法では、界面活性剤(例:Triton X-100, SDS, NP-40など)が細胞膜の脂質二重層を可溶化し、細胞を破壊します。浸透圧ショックも、細胞を低張液に晒すことで細胞内に水が流入し、細胞が膨張して破裂する原理を利用します。酵素的溶解法は、特定の細胞壁や細胞膜の構成成分を分解する酵素(例:細菌にはリゾチーム、植物細胞にはセルラーゼ、真菌にはキチナーゼなど)を用いる方法で、穏やかな条件下で細胞を溶解できる利点があります。これらの方法は単独で用いられることもありますが、多くの場合、複数の方法を組み合わせて溶解効率を高めたり、目的分子の安定性を保ったりします。
細胞溶解の用途は多岐にわたります。最も一般的な用途の一つは、タンパク質の抽出と精製です。組換えタンパク質の発現、酵素の単離、抗体の回収など、細胞内で生産されたタンパク質を研究や産業利用のために取り出す際に必須の工程です。同様に、DNAやRNAの抽出と精製も重要な用途であり、PCR、次世代シーケンシング(NGS)、クローニング、遺伝子発現解析などの分子生物学的手法の前処理として行われます。細胞内オルガネラ(ミトコンドリア、核、リソソームなど)の分離にも細胞溶解が用いられ、それぞれのオルガネラの機能解析に貢献します。また、ウイルス粒子や細胞内寄生体の回収、細胞数測定(例えば、血液検査における赤血球の溶解)、さらには薬物送達システムにおけるリポソームなどのキャリアからの薬物放出制御にも応用されています。細胞内シグナル伝達経路の解析においても、特定の刺激後の細胞を溶解し、リン酸化タンパク質などの変化を検出するために用いられます。
関連する技術としては、細胞溶解によって得られた細胞抽出液をさらに分析・精製するための様々な手法が挙げられます。クロマトグラフィー(アフィニティー、イオン交換、ゲルろ過など)は、目的分子を他の成分から分離・精製するために広く用いられます。電気泳動(SDS-PAGE、2D-PAGE、アガロースゲル電気泳動など)は、タンパク質や核酸のサイズや電荷に基づいて分離し、その存在や純度を確認するために不可欠です。PCRや次世代シーケンシングは、抽出された核酸の増幅や配列決定に用いられ、遺伝子解析の基盤となります。質量分析は、タンパク質や代謝物の同定、定量、構造解析に利用されます。フローサイトメトリーでは、細胞内抗原を染色する際に細胞膜を透過させるための前処理として細胞溶解が応用されることがあります。ELISAやウェスタンブロッティングも、細胞溶解液中の特定のタンパク質を検出・定量する際に用いられる技術です。これらの技術は、細胞溶解と密接に連携し、生命現象の解明や疾患の診断・治療法の開発に貢献しています。
市場背景としては、ライフサイエンス研究、バイオ医薬品開発、診断薬分野の急速な拡大に伴い、細胞溶解関連製品およびサービスの市場は着実に成長しています。主要な市場プレイヤーには、Thermo Fisher Scientific、Merck KGaA(MilliporeSigma)、Bio-Rad Laboratories、QIAGEN、Promega、GE Healthcare(Cytiva)などが挙げられ、これらの企業は多様な細胞溶解キット、試薬、装置を提供しています。市場の動向としては、研究のハイスループット化、自動化へのニーズが高まっており、より迅速かつ効率的に多数のサンプルを処理できるシステムが求められています。また、微量サンプルからの高感度な解析や、目的分子の変性・分解を最小限に抑える穏やかな溶解法の開発も進んでいます。一方で、細胞の種類による溶解効率のばらつき、目的物質の安定性維持、コンタミネーションの防止、そして研究室スケールから産業スケールへのスケールアップの難しさなどが、依然として課題として存在しています。特に、特定の細胞種や組織に特化した溶解プロトコルの最適化は、研究者にとって重要な課題です。
将来の展望としては、細胞溶解技術はさらなる進化を遂げると予想されます。マイクロ流体デバイスを用いたオンチップ溶解は、微量サンプルからの迅速かつ高効率な溶解を可能にし、シングルセル解析やポイントオブケア診断への応用が期待されています。シングルセル解析の進展に伴い、細胞一つ一つを損傷なく、かつ効率的に溶解し、その内容物を解析するための超低侵襲な溶解技術の開発が加速するでしょう。人工知能(AI)や機械学習を活用した溶解条件の最適化も進み、複雑な細胞種や目的分子に対して最適な溶解プロトコルを自動で提案するシステムが登場する可能性があります。また、ゲノム編集技術(CRISPRなど)と組み合わせることで、特定の細胞のみを選択的に溶解し、特定の疾患細胞の除去や再生医療への応用も視野に入ってきます。診断分野では、病原体検出のための迅速かつ高感度な細胞溶解技術が、感染症の早期診断や公衆衛生の向上に貢献すると考えられます。これらの技術革新は、基礎研究の深化だけでなく、個別化医療、再生医療、創薬、診断といった幅広い分野において、新たな可能性を切り開くものと期待されています。