治験薬供給市場の市場規模・シェア分析:成長トレンドと予測 (2026年~2031年)
治験薬供給市場レポートは、臨床相タイプ(第I相、第II相など)、製品およびサービス(製造など)、エンドユーザー(製薬会社など)、治療領域(腫瘍学、中枢神経系疾患、感染症など)、地域(北米、欧州、アジア太平洋、中東およびアフリカ、南米)によって分類されます。市場予測は金額(米ドル)で提供されます。

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
治験薬供給市場の概要
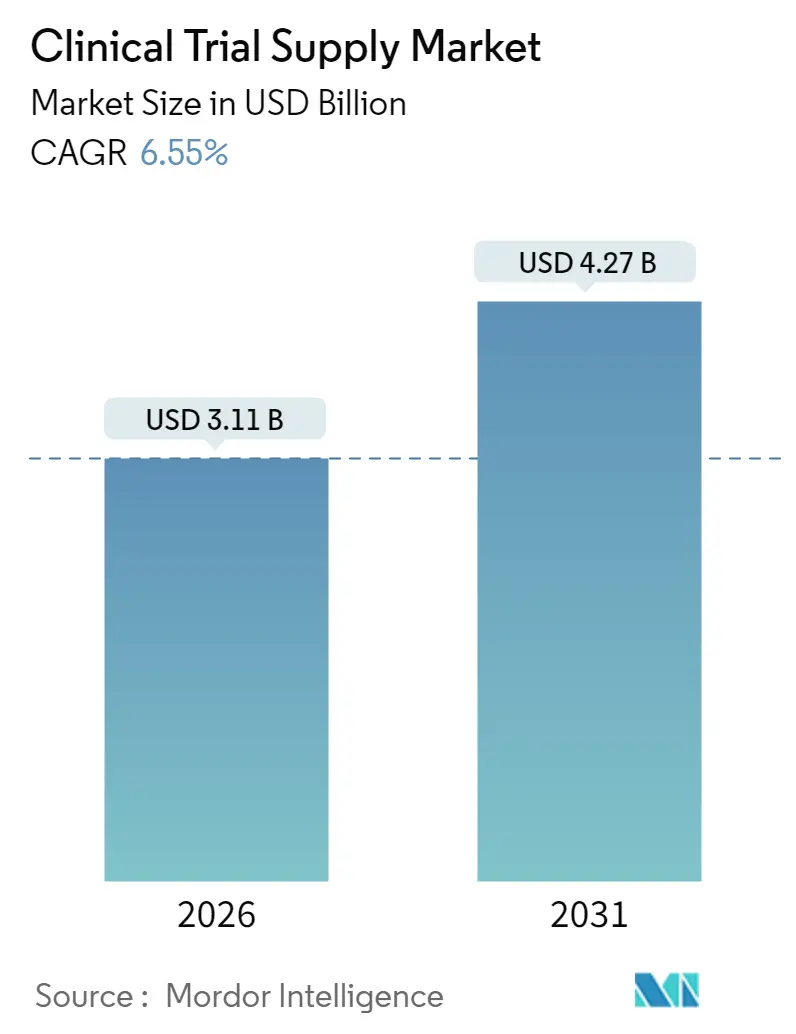
治験薬供給市場は、2025年に29.2億米ドルと評価され、2026年の31.1億米ドルから2031年には42.7億米ドルに成長し、予測期間(2026-2031年)中の年平均成長率(CAGR)は6.55%に達すると予測されています。分散型臨床試験(DCT)に対する規制支援の増加、バイオ医薬品パイプラインの急速な拡大、リアルタイム温度モニタリングへの需要の高まりが、市場成長の主要な推進要因です。北米は最大の市場ですが、アジア太平洋地域は最速の成長を遂げています。複雑なバイオ医薬品の増加はコールドチェーンへの支出を増加させ、超低温貯蔵能力やIoTセンサーへの投資を促しています。CRO(医薬品開発業務受託機関)と3PL(第三者物流)プロバイダー間の統合も加速しており、統合されたエンドツーエンドのサービス提供がベンダー選定の重要な要因となっています。一方で、医薬品不足、関税リスク、比較薬コストのインフレといった課題は、回復力のあるサプライチェーンの必要性を浮き彫りにしています。
主要なレポートのポイント
* サービス別: 2025年には保管・流通が52.12%の収益シェアを占め、サプライチェーン管理は2031年までに7.95%の収益シェアを占めると予測されています。
* 温度別: 2025年には冷蔵が50.12%の収益シェアを占め、超低温は2031年までに12.15%の収益シェアを占めると予測されています。
* 製品別: 2025年にはワクチンが35.12%の収益シェアを占め、細胞・遺伝子治療薬は2031年までに15.15%の収益シェアを占めると予測されています。
* エンドユーザー別: 2025年には製薬会社が45.12%の収益シェアを占め、CROは2031年までに20.15%の収益シェアを占めると予測されています。
* 地域別: 2025年には北米が38.12%の収益シェアを占め、アジア太平洋地域は2031年までに25.15%の収益シェアを占めると予測されています。
市場の動向
* 分散型臨床試験(DCT)の増加: DCTは、患者中心のアプローチと地理的な障壁の低減により、医薬品のコールドチェーン物流の需要を促進しています。
* バイオ医薬品パイプラインの拡大: 複雑なバイオ医薬品の増加は、厳格な温度管理を必要とするコールドチェーンソリューションへの需要を高めています。
* リアルタイム温度モニタリングへの需要: IoTセンサーとデータ分析の進歩により、医薬品の輸送中のリアルタイムモニタリングが可能になり、製品の完全性が確保されます。
* CROと3PLプロバイダー間の統合: 統合されたエンドツーエンドのサービス提供は、ベンダー選定の重要な要因となっており、市場の競争を激化させています。
* 持続可能性への焦点: 環境への影響を低減するためのグリーンコールドチェーンソリューションへの投資が増加しています。
課題
* 医薬品不足とサプライチェーンの脆弱性: 地政学的緊張や自然災害は、医薬品の供給を混乱させ、回復力のあるサプライチェーンの必要性を浮き彫りにしています。
* 関税リスクと貿易障壁: 国際貿易における関税や規制の変更は、コールドチェーン物流のコストと複雑さを増加させる可能性があります。
* 比較薬コストのインフレ: 比較薬の価格上昇は、臨床試験のコストを増加させ、医薬品開発の予算に圧力をかけています。
主要企業
医薬品コールドチェーン物流市場の主要企業には、DHL Supply Chain、FedEx、UPS Healthcare、Kuehne + Nagel、DB Schenker、Maersk、World Courier、CSafe Global、Envirotainer、Va-Q-tecなどが含まれます。これらの企業は、市場シェアを拡大するために、戦略的提携、M&A、新技術への投資に注力しています。
本レポートは、世界の治験薬供給市場に関する詳細な分析を提供しています。この市場は、治験薬の製造、包装、ラベリング、保管、流通(コールドチェーンを含む)、および比較薬や補助品の調達といったサービスを対象とし、第I相から第IV相までの治験全体をカバーしています。承認済みの市販薬に対する通常の病院物流は、本調査の範囲外です。
市場規模は2026年に31.1億米ドルに達し、2031年までには42.7億米ドルに成長すると予測されています。
市場の成長を牽引する主な要因としては、世界的な治験件数の増加、専門サービスプロバイダーへのアウトソーシング拡大、コールドチェーン物流を必要とする複雑なバイオ医薬品の普及、インタラクティブ応答技術(IRT)プラットフォームの進歩、患者中心の治験デザインに対する規制支援の強化、持続可能なサプライチェーン慣行への注力などが挙げられます。
一方で、市場の成長を抑制する要因も存在します。これには、比較薬および物流コストの高騰、地政学的な不安定性によるサプライチェーンの混乱、GMP包装・ラベリングにおける熟練人材の不足、デジタル供給プラットフォームにおけるサイバーセキュリティの脆弱性などが含まれます。
本レポートでは、市場を治験フェーズ別(第I相~第IV相など)、製品・サービス別(製造、保管・流通、サプライチェーン管理)、エンドユーザー別(製薬会社、CROなど)、治療領域別(腫瘍学、CNS疾患など)、および地域別(北米、欧州、アジア太平洋など主要地域と各国)に詳細に分析しています。
主要な調査結果として、以下の点が挙げられます。
* 地域別成長: アジア太平洋地域は、中国での治験件数増加と規制対応の迅速化に牽引され、年平均成長率(CAGR)7.62%で最も急速に成長すると予測されています。
* コールドチェーンサービスの拡大: バイオ医薬品、細胞治療、個別化ワクチンなどの増加により、超低温輸送と保管の需要が高まり、コールドチェーンサービスが急速に拡大しています。
* サプライチェーン管理の成長: IRT統合、予測分析、患者への直接配送を含むサプライチェーン管理サービスは、2031年までにCAGR 7.95%で拡大する見込みです。
* 分散型治験の影響: FDAのガイダンスにより遠隔訪問モデルが正当化され、スポンサーは患者の無作為化、自宅への薬剤直接配送、リアルタイムでの温度データ同期を可能にするプラットフォームを必要としています。
* 治験フェーズ別成長: バイオテクノロジー企業によるファースト・イン・ヒューマン試験の加速により、アジャイルな少量バッチ包装と迅速なグローバル輸入承認に依存する第I相治験がCAGR 8.18%で最も速く成長すると見込まれています。
本調査は、北米、欧州、アジア太平洋地域のサプライチェーンディレクターへの一次調査と、公開されている治験登録データ、税関統計、業界誌などの二次調査を組み合わせた堅牢な調査手法に基づいています。市場規模の算出と予測は、トップダウンとボトムアップのアプローチを組み合わせたモデルを使用し、毎年更新されるデータと専門家による検証を通じて、信頼性の高いベースラインを提供しています。
競争環境の分析では、市場集中度、市場シェア分析に加え、Thermo Fisher Scientific、Catalent、Parexel、Almac Groupなど、主要な20社以上の企業プロファイル(概要、事業セグメント、財務状況、製品・サービス、最近の動向など)が詳細に記述されています。
レポートはまた、市場の機会と将来の展望、特に未開拓の領域や満たされていないニーズの評価についても言及しています。

1. はじめに
- 1.1 調査の前提と市場の定義
- 1.2 調査範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場概況
- 4.1 市場概要
- 4.2 市場の推進要因
- 4.2.1 世界の臨床試験量の増加
- 4.2.2 専門サービスプロバイダーへのアウトソーシングの増加
- 4.2.3 コールドチェーンロジスティクスを必要とする複雑なバイオ医薬品の普及
- 4.2.4 インタラクティブ応答技術プラットフォームの進歩
- 4.2.5 患者中心の試験デザインに対する規制支援の増加
- 4.2.6 持続可能なサプライチェーン慣行への重点
- 4.3 市場の阻害要因
- 4.3.1 比較薬とロジスティクスのコスト上昇
- 4.3.2 地政学的不安定性によるサプライチェーンの混乱
- 4.3.3 GMP包装およびラベリングにおける熟練した人材の不足
- 4.3.4 デジタル供給プラットフォームにおけるサイバーセキュリティの脆弱性
- 4.4 規制環境
- 4.5 ポーターの5つの力分析
- 4.5.1 新規参入の脅威
- 4.5.2 買い手の交渉力
- 4.5.3 供給者の交渉力
- 4.5.4 代替品の脅威
- 4.5.5 競争の激しさ
5. 市場規模と成長予測(金額、米ドル)
- 5.1 臨床相タイプ別
- 5.1.1 第I相
- 5.1.2 第II相
- 5.1.3 第III相
- 5.1.4 第IV相 / BA-BE / その他
- 5.2 製品およびサービス別
- 5.2.1 製造
- 5.2.2 保管 & 流通
- 5.2.3 サプライチェーン管理
- 5.3 エンドユーザー別
- 5.3.1 製薬会社
- 5.3.2 バイオ医薬品 / バイオロジクス企業
- 5.3.3 医療機器スポンサー
- 5.3.4 医薬品開発業務受託機関 (CRO)
- 5.4 治療領域別
- 5.4.1 腫瘍学
- 5.4.2 中枢神経系疾患
- 5.4.3 感染症
- 5.4.4 代謝性疾患
- 5.4.5 心血管疾患
- 5.4.6 その他の治療領域
- 5.5 地域別
- 5.5.1 北米
- 5.5.1.1 米国
- 5.5.1.2 カナダ
- 5.5.1.3 メキシコ
- 5.5.2 ヨーロッパ
- 5.5.2.1 ドイツ
- 5.5.2.2 イギリス
- 5.5.2.3 フランス
- 5.5.2.4 イタリア
- 5.5.2.5 スペイン
- 5.5.2.6 その他のヨーロッパ
- 5.5.3 アジア太平洋
- 5.5.3.1 中国
- 5.5.3.2 日本
- 5.5.3.3 インド
- 5.5.3.4 オーストラリア
- 5.5.3.5 韓国
- 5.5.3.6 その他のアジア太平洋
- 5.5.4 中東 & アフリカ
- 5.5.4.1 GCC
- 5.5.4.2 南アフリカ
- 5.5.4.3 その他の中東 & アフリカ
- 5.5.5 南米
- 5.5.5.1 ブラジル
- 5.5.5.2 アルゼンチン
- 5.5.5.3 その他の南米
6. 競合情勢
- 6.1 市場集中度
- 6.2 市場シェア分析
- 6.3 企業プロファイル(グローバル概要、市場概要、主要事業セグメント、財務、従業員数、主要情報、市場順位、市場シェア、製品とサービス、および最近の動向の分析を含む)
- 6.3.1 サーモフィッシャーサイエンティフィック
- 6.3.2 カタレント
- 6.3.3 パレクセル
- 6.3.4 アルマックグループ
- 6.3.5 マーケン(DHLサプライチェーン)
- 6.3.6 PCIファーマサービス
- 6.3.7 ワールドクーリエ
- 6.3.8 レシファーム
- 6.3.9 IQVIA
- 6.3.10 シャープクリニカル
- 6.3.11 シネオスヘルス
- 6.3.12 ICON plc
- 6.3.13 バイオケア
- 6.3.14 ユアウェイ
- 6.3.15 パテオン
- 6.3.16 ピラマルファーマソリューションズ
- 6.3.17 UDGヘルスケア(アッシュフィールド)
- 6.3.18 マイオネックス
- 6.3.19 ルビコンリサーチ
- 6.3.20 クリニゲン
7. 市場機会 & 将来展望
*** 本調査レポートに関するお問い合わせ ***

治験薬供給とは、医薬品開発の最終段階である治験(臨床試験)において、被験者へ投与される治験薬を、適切な品質、数量、タイミングで、治験実施施設へ供給する一連のプロセスを指します。これは単に医薬品を届ける物流業務に留まらず、治験薬の製造、品質管理、包装、表示、保管、輸送、在庫管理、そして治験終了後の回収や廃棄に至るまで、極めて広範かつ専門的な業務を含んでいます。医薬品医療機器等法(薬機法)やGCP(Good Clinical Practice:医薬品の臨床試験の実施の基準)といった国内外の厳格な規制に準拠することが求められ、被験者の安全性確保と治験データの信頼性担保に不可欠な役割を担っています。
治験薬供給のプロセスは多岐にわたります。まず、治験薬の製造段階では、原薬の調達から製剤化、そして治験薬としての特殊な包装や表示が行われます。この表示には、治験薬である旨、用法用量、保管条件、被験者識別番号などが含まれ、プラセボ(偽薬)や対照薬の準備も同時に進められます。次に、保管・輸送段階では、医薬品の品質を維持するために、適切な温度・湿度管理が徹底されます。特に、コールドチェーン管理は多くのバイオ医薬品や再生医療等製品において必須であり、GDP(Good Distribution Practice:医薬品の適正流通基準)に則った厳格な管理体制が求められます。国内外への輸送においては、各国の規制や通関手続きへの対応も重要となります。さらに、治験の進捗状況や被験者の登録数、脱落率などを考慮した需要予測に基づき、治験実施施設への適切な在庫管理と計画的な補充が行われます。治験終了後や品質問題発生時には、治験薬の迅速な回収と適切な方法での廃棄も重要な業務です。また、治験の信頼性を確保するための盲検化(被験者や医師がどの薬剤を投与しているか分からないようにすること)や無作為化(被験者をランダムにグループ分けすること)に対応した供給体制も構築されます。
治験薬供給の重要性は、治験の円滑な実施、被験者の安全性確保、そして治験データの信頼性確保という三つの側面に集約されます。適切な品質の治験薬が正しいタイミングで供給されなければ、治験は滞り、最悪の場合、中断せざるを得なくなります。また、品質が保証された治験薬を正しい用法用量で供給することは、被験者の安全を守る上で最も基本的な要件です。盲検化や無作為化を維持しつつ、適切なタイミングで治験薬を供給することで、治験結果の客観性と信頼性が高まり、医薬品の承認申請に必要な質の高いデータ収集が可能となります。効率的な供給体制は、治験の遅延を防ぎ、医薬品開発全体の期間短縮にも大きく貢献します。
この複雑な業務を支えるために、様々な関連技術が活用されています。温度管理技術としては、コールドチェーンロジスティクス、温度ロガー、IoTセンサーを用いたリアルタイムモニタリングシステムが不可欠です。ITシステムでは、IVRS/IWRS(Interactive Voice/Web Response System)が被験者の登録、治験薬の割付、在庫管理に広く利用されており、CTMS(Clinical Trial Management System)やWMS(Warehouse Management System)と連携することで、サプライチェーン全体の可視化と効率化が図られています。また、GMP(Good Manufacturing Practice:医薬品の製造管理及び品質管理の基準)に準拠した包装・表示技術、偽造防止技術、トレーサビリティ確保のためのシリアル化なども進んでいます。近年では、AIを活用した需要予測やリスク管理、さらには倉庫内でのピッキングや梱包作業の自動化といったロボティクス技術の導入も進められています。
治験薬供給を取り巻く市場背景は、近年大きく変化しています。治験のグローバル化が進む中で、国境を越えた複雑な供給網の構築と、各国の異なる規制への対応が必須となっています。また、個別化医療や再生医療等製品の登場により、少量多品種生産や超低温管理といった、従来の治験薬供給とは異なる特殊な要件が増加しています。このような専門性の高い業務に対応するため、製薬企業が治験薬供給業務をCRO(Contract Research Organization:医薬品開発業務受託機関)やCDMO(Contract Development and Manufacturing Organization:医薬品開発製造受託機関)、専門のロジスティクス企業にアウトソーシングするケースが増加しており、専門性と効率性の追求が業界全体のトレンドとなっています。同時に、品質、安全性、トレーサビリティに関する規制は世界的に厳格化の一途を辿っており、これに対応するための投資と体制強化が求められています。
将来展望としては、デジタル化とデジタルトランスフォーメーション(DX)の加速が挙げられます。AIによる需要予測のさらなる高度化、ブロックチェーン技術を活用したトレーサビリティの強化、IoTセンサーによるリアルタイムモニタリングの普及により、サプライチェーン全体の透明性と効率性が飛躍的に向上すると期待されています。グローバルなサプライチェーンの可視化と最適化、そしてリスクマネジメントの強化は、今後ますます重要になるでしょう。また、細胞・遺伝子治療薬など、特殊な保管・輸送条件を要する新しいモダリティの治験薬への対応能力の向上が喫緊の課題です。環境負荷の低減を目指した持続可能なサプライチェーンの構築も重要なテーマであり、包装材の選択や輸送方法の最適化が進められるでしょう。これらの変化に対応するためには、複雑化・高度化する治験薬供給業務を担う専門知識を持った人材の育成が不可欠であり、レギュラトリーサイエンスの進化とそれに合わせた規制の整備も、業界全体の発展を支える重要な要素となります。