臨床試験市場 規模・シェア分析:成長動向と予測 (2026年~2031年)
臨床試験市場レポートは、フェーズ(フェーズIなど)、研究デザイン(介入/治療研究など)、サービスタイプ(プロトコル設計と実現可能性など)、治療領域(腫瘍学など)、スポンサータイプ(製薬・バイオ製薬企業など)、および地域(北米、ヨーロッパ、アジアなど)によってセグメント化されています。市場予測は、価値(米ドル)で提供されます。

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
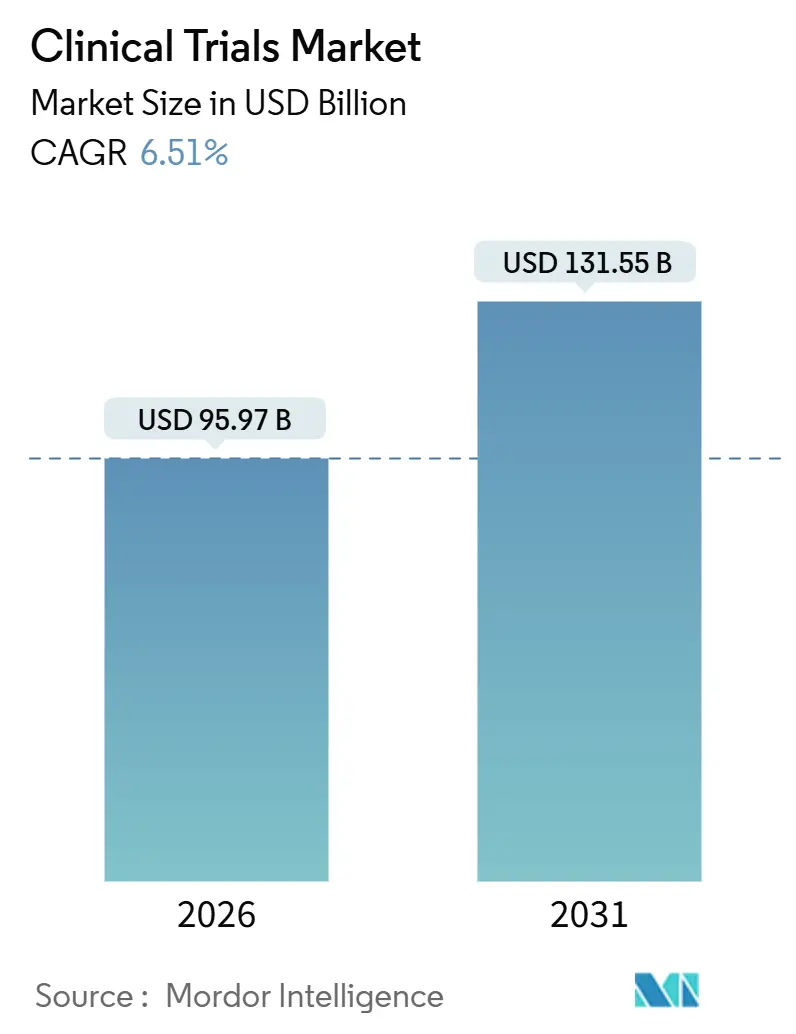
臨床試験市場は、2026年には959.7億米ドルと推定され、2031年までに1,315.5億米ドルに達すると予測されており、予測期間(2026年~2031年)中の年平均成長率(CAGR)は6.51%です。市場の集中度は中程度とされています。地域別に見ると、アジア太平洋地域が最大の市場であり、北米が最も急速に成長している市場とされていますが、詳細な分析ではアジア太平洋地域が最も高いCAGRを示すと予測されています。
パンデミック後、臨床試験市場では、オンサイト訪問とバーチャルワークフローを組み合わせたハイブリッド実行モデルが普及しつつあります。スポンサーは、規制要件を満たしつつ参加者にも魅力的な分散型コンポーネントを採用しています。精密医療候補が第III相に進む前にバイオマーカー駆動の概念実証を必要とするため、第II相試験にはより大きな予算が投入されています。また、適応的デザインは希少疾患プログラムの期間を短縮し、人工知能(AI)スクリーニングツールは腫瘍学や神経学における登録のボトルネックを解消しています。競争環境においては、主要なCRO(医薬品開発業務受託機関)がモニタリングコストを削減し、施設選定を強化するための予測分析を組み込むなど、テクノロジー統合が中心となっています。スポンサーは地理的な多様化も進めており、承認期間が3ヶ月と短い国や地域にも注目しています。これにより、グローバルな臨床試験の実施が加速され、より多様な患者集団へのアクセスが可能になっています。特に新興市場は、未開拓の患者プールと比較的低い運営コストを提供するため、魅力的な選択肢となっています。また、個別化医療の進展に伴い、特定のバイオマーカーを持つ患者を対象とした試験が増加しており、これに対応するための専門的なCROの需要が高まっています。規制当局も、革新的な治療法や希少疾患に対する迅速な承認プロセスを導入することで、市場の成長を後押ししています。
今後の市場は、デジタル技術のさらなる統合、リアルワールドデータ(RWD)の活用拡大、そして患者中心のアプローチの強化によって形成されると見られています。ウェアラブルデバイスや遠隔モニタリング技術は、患者の負担を軽減し、より広範なデータ収集を可能にすることで、臨床試験の効率性と質を向上させるでしょう。さらに、バイオ医薬品や細胞・遺伝子治療といった先端医療の台頭は、新たな試験デザインや規制上の課題をもたらしつつも、市場全体の成長を牽引する主要なドライバーとなることが予想されます。これらの要因が複合的に作用し、臨床試験市場は今後もダイナミックな変化を遂げながら拡大していくと考えられます。
本レポートは、臨床試験市場に関する詳細な分析を提供しております。
1. 調査の定義と範囲
本調査における臨床試験市場は、製薬会社、バイオ医薬品会社、医療機器会社が後援する第I相から第IV相までの介入試験、観察試験、拡大アクセス試験における計画、実施、完了サービスから生じる収益全体と定義されています。対象となる活動には、プロトコル設計、施設および患者募集、規制当局への申請と承認、臨床試験モニタリング、データ管理と生物統計、メディカルライティング、および関連する分散型またはハイブリッド試験のサポートが含まれます。なお、動物および前臨床in-vivo研究の費用は本推定には含まれておりません。
2. 市場規模と成長予測
臨床試験市場は、2026年には959.7億米ドルに達し、2031年までに1,315.5億米ドルに成長すると予測されております。特に、適応的デザインにより用量選択と有効性確認が効率化される第II相試験は、2031年まで年平均成長率6.80%で最も速い成長を遂げると見込まれています。地域別では、中国の規制改革やインドのコスト優位性に支えられ、アジア太平洋地域が年平均成長率7.90%で最も高い成長を示すと予測されております。
3. 市場の推進要因
市場成長を牽引する主な要因は以下の通りです。
* 複雑なバイオ医薬品や精密医療の治験量の増加。
* コストとスピードの優位性から、フルサービスCROへのアウトソーシングが拡大していること。
* FDAのファストトラックやEMAのPRIMEなどの規制改革による承認経路の加速。
* パンデミックによって加速されたデジタル変革が、eClinicalソリューションの採用を促進していること。
* 患者が所有する健康データウォレットの台頭が、遠隔モニタリングを容易にしていること。
* ブロックチェーンベースの同意管理が、監査可能性とコンプライアンスを向上させていること。
4. 市場の阻害要因
一方で、市場の成長を抑制する要因も存在します。
* 腫瘍学および中枢神経系(CNS)試験における高い脱落率が、コストリスクを増大させていること。
* 厳格なデータプライバシー法(例:GDPR、中国のPIPL)が、国境を越えたデータフローを制限していること。これらの法律は、ローカライズされたデータ保存や追加の承認を必要とし、多国籍試験のタイムラインに8~18週間を追加する最大の運用上の課題となっております。
* 遺伝子治療試験に必要なGMP準拠のウイルスベクター製造能力の不足。
* 多施設試験における二酸化炭素排出量説明責任への圧力の高まり。
5. 市場のセグメンテーション
本レポートでは、市場を以下の主要なセグメントに分けて分析しております。
* フェーズ別: 第I相、第II相、第III相、第IV相。
* 研究デザイン別: 介入/治療研究、観察研究、拡大アクセス研究。
* サービスタイプ別: プロトコル設計と実現可能性、施設特定と立ち上げ、規制当局への申請と承認、臨床試験モニタリング、データ管理と生物統計、メディカルライティング、その他のサービスタイプ。
* 治療領域別: 腫瘍学、心血管疾患、神経学、感染症、代謝性疾患(糖尿病、肥満)、免疫学/自己免疫疾患、その他の治療領域。
* スポンサータイプ別: 製薬・バイオ医薬品企業、医療機器企業、学術・研究機関、政府・非営利団体。
* 地域別: 北米、ヨーロッパ、アジア太平洋、中東・アフリカ、南米の主要国および地域。
6. 競争環境
主要なサービスプロバイダーとしては、IQVIA、Labcorp、ICON、Parexel、Thermo FisherのPPD部門が挙げられ、これら5社で世界のCRO収益の約42%を占めております。その他、ACM Global Laboratories、Aragen Life Sciences Ltd.、Caidya、Charles River Laboratories International Inc.、ClinChoice、KCR S.A.、Lilly (Lilly Clinical Innovation)、Medpace Holdings Inc.、Novotech、Pfizer Inc.、Pharmaron Inc.、Syneos Health、Wuxi AppTec Co. Ltd.などがプロファイルされております。
7. 調査方法論
本調査は、ClinicalTrials.gov、WHO-ICTRP、EMAのEudraCTなどの公開レジストリや、D&B Hoovers、Dow Jones Factivaなどの有料リポジトリを用いたデスクリサーチ、およびグローバルCROの臨床業務リーダー、主要研究者、バイオ医薬品企業の調達責任者への構造化インタビューによる一次調査を組み合わせて実施されております。市場規模の推定と予測は、トップダウンアプローチとボトムアップチェックを組み合わせ、R&D支出、試験開始速度、プロトコル複雑性スコア、分散型試験の採用率、賃金動向、疾病負担の変化などの主要なモデルドライバーを用いて行われております。データは毎年更新され、重要な規制またはマクロ経済イベントによって中間更新がトリガーされます。
8. 主要な洞察
分散型試験モデルは、患者維持率を85%に向上させ、遠隔医療やウェアラブルデバイスの活用によりモニタリングコストを削減するため、注目を集めております。

1. はじめに
- 1.1 調査の前提と市場の定義
- 1.2 調査範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場概況
- 4.1 市場概要
- 4.2 市場の推進要因
- 4.2.1 広範な治験を必要とする複雑なバイオ医薬品および精密医療の増加
- 4.2.2 コストとスピードの利点のためのフルサービスCROへのアウトソーシングの拡大
- 4.2.3 承認経路を加速する規制改革(例:FDAファストトラック、EMA PRIME)
- 4.2.4 パンデミックによるデジタルトランスフォーメーションがe臨床の採用を促進
- 4.2.5 患者所有の健康データウォレットの台頭が遠隔モニタリングを促進
- 4.2.6 ブロックチェーンベースの同意管理が監査可能性とコンプライアンスを強化
- 4.3 市場の阻害要因
- 4.3.1 腫瘍学およびCNS治験における高い脱落率がコストリスクを増加
- 4.3.2 国境を越えたデータフローを制限する厳格なデータプライバシー法
- 4.3.3 遺伝子治療治験のためのGMP準拠ウイルスベクター製造能力の不足
- 4.3.4 複数施設治験における炭素排出量説明責任の圧力の増加
- 4.4 規制の見通し
- 4.5 ポーターの5つの力分析
- 4.5.1 新規参入者の脅威
- 4.5.2 買い手の交渉力
- 4.5.3 供給者の交渉力
- 4.5.4 代替品の脅威
- 4.5.5 競争の激しさ
5. 市場規模と成長予測(金額、米ドル)
- 5.1 フェーズ別
- 5.1.1 フェーズI
- 5.1.2 フェーズII
- 5.1.3 フェーズIII
- 5.1.4 フェーズIV
- 5.2 研究デザイン別
- 5.2.1 介入/治療研究
- 5.2.2 観察研究
- 5.2.3 拡大アクセス研究
- 5.3 サービスタイプ別
- 5.3.1 プロトコル設計と実現可能性
- 5.3.2 施設特定と立ち上げ
- 5.3.3 規制当局への提出と承認
- 5.3.4 臨床試験モニタリング
- 5.3.5 データ管理と生物統計
- 5.3.6 メディカルライティング
- 5.3.7 その他のサービスタイプ
- 5.4 治療領域別
- 5.4.1 腫瘍学
- 5.4.2 循環器
- 5.4.3 神経学
- 5.4.4 感染症
- 5.4.5 代謝性疾患(糖尿病、肥満)
- 5.4.6 免疫学/自己免疫
- 5.4.7 その他の治療領域
- 5.5 スポンサータイプ別
- 5.5.1 製薬・バイオ医薬品企業
- 5.5.2 医療機器企業
- 5.5.3 学術・研究機関
- 5.5.4 政府・非営利団体
- 5.6 地域
- 5.6.1 北米
- 5.6.1.1 米国
- 5.6.1.2 カナダ
- 5.6.1.3 メキシコ
- 5.6.2 ヨーロッパ
- 5.6.2.1 ドイツ
- 5.6.2.2 英国
- 5.6.2.3 フランス
- 5.6.2.4 イタリア
- 5.6.2.5 スペイン
- 5.6.2.6 その他のヨーロッパ
- 5.6.3 アジア太平洋
- 5.6.3.1 中国
- 5.6.3.2 日本
- 5.6.3.3 インド
- 5.6.3.4 韓国
- 5.6.3.5 オーストラリア
- 5.6.3.6 その他のアジア太平洋
- 5.6.4 中東およびアフリカ
- 5.6.4.1 GCC
- 5.6.4.2 南アフリカ
- 5.6.4.3 その他の中東およびアフリカ
- 5.6.5 南米
- 5.6.5.1 ブラジル
- 5.6.5.2 アルゼンチン
- 5.6.5.3 その他の南米
6. 競合情勢
- 6.1 市場集中度
- 6.2 市場シェア分析
- 6.3 企業プロファイル(グローバルレベルの概要、市場レベルの概要、主要事業セグメント、財務、従業員数、主要情報、市場ランク、市場シェア、製品およびサービス、および最近の動向の分析を含む)
- 6.3.1 ACM Global Laboratories
- 6.3.2 Aragen Life Sciences Ltd.
- 6.3.3 Caidya
- 6.3.4 Charles River Laboratories International Inc.
- 6.3.5 ClinChoice
- 6.3.6 ICON Plc
- 6.3.7 IQVIA Holdings Inc.
- 6.3.8 KCR S.A.
- 6.3.9 Laboratory Corporation Of America Holdings (Labcorp)
- 6.3.10 Lilly (Lilly Clinical Innovation)
- 6.3.11 Medpace Holdings Inc.
- 6.3.12 Novotech
- 6.3.13 Parexel International Corp.
- 6.3.14 Pfizer Inc.
- 6.3.15 Pharmaron Inc.
- 6.3.16 Syneos Health
- 6.3.17 Thermo Fisher Scientific Inc. (PPD)
- 6.3.18 Wuxi AppTec Co. Ltd.
7. 市場機会と将来展望
*** 本調査レポートに関するお問い合わせ ***

臨床試験とは、新しい医薬品、医療機器、治療法、診断法などが、人に対して安全であるか、そして期待される効果があるかを科学的かつ倫理的な手順に基づいて評価する研究活動でございます。これは、未承認の治療法が市場に導入される前に、その有効性と安全性を確認し、適切な使用方法を確立するために不可欠なプロセスです。厳格なプロトコルと規制当局の承認のもとで実施され、参加者の人権と安全が最優先されます。通常、治験薬の投与量や薬物動態を評価する第I相試験、有効性と安全性を確認する第II相試験、既存の治療法と比較して優位性を検証する大規模な第III相試験、そして市販後に長期的な安全性や稀な副作用、新たな効能などを調査する第IV相試験の段階を経て進められます。これらの段階を経て得られたデータは、医薬品や医療機器の承認申請の根拠となり、患者様への安全で効果的な医療提供に貢献いたします。
臨床試験には様々な種類がございます。最も一般的な分類は、前述の通り開発段階に応じた第I相から第IV相までのフェーズによるものです。第I相試験は少数の健康な成人を対象とすることが多く、安全性と薬物の体内動態を評価します。第II相試験では、対象疾患の患者様を数十人から数百人規模で募り、有効性の兆候と最適な投与量、副作用の有無を確認します。第III相試験は数百人から数千人規模の患者様を対象とし、既存の治療法やプラセボと比較して、その有効性と安全性を最終的に検証する、承認申請の根拠となる重要な試験です。第IV相試験は、医薬品が市販された後に行われ、長期的な安全性や新たな知見の収集、特定の集団における効果の評価などを行います。また、試験デザインの観点からは、無作為化比較対照試験(RCT)が最も信頼性の高いエビデンスを提供するものとして広く採用されており、介入群と対照群に患者様を無作為に割り付け、治療効果を比較します。その他にも、単群試験、クロスオーバー試験、適応的デザイン試験など、研究目的や対象疾患に応じて多様なデザインが用いられます。
臨床試験の用途は多岐にわたります。最も主要な用途は、新しい医薬品や医療機器が規制当局の承認を得て市場に導入されるためのエビデンスを生成することです。これにより、患者様は安全で効果的な治療法にアクセスできるようになります。また、既存の医薬品や治療法についても、新たな効能・効果の探索、より良い投与方法や併用療法の開発、特定の患者集団における効果の検証など、その価値を最大化するための研究が行われます。さらに、疾患の予防法や診断法の開発、公衆衛生上の介入策の効果評価、さらには疾患の病態生理や自然経過に関する理解を深めるための基礎研究としても活用されます。例えば、ワクチン開発のための臨床試験は感染症予防に不可欠であり、診断薬の性能評価も正確な診断と治療選択に直結します。このように、臨床試験は医療の進歩と公衆衛生の向上に不可欠な役割を担っております。
臨床試験の効率性と精度を高めるために、様々な関連技術が導入されています。データ管理においては、電子データ収集システム(EDC)や臨床試験管理システム(CTMS)が広く利用され、データの正確性、一貫性、リアルタイム性を確保しています。また、統計解析ソフトウェアや人工知能(AI)、機械学習(ML)は、膨大な臨床データを解析し、新たな知見の発見や患者層別化、試験デザインの最適化に貢献しています。患者様のモニタリングにおいては、ウェアラブルデバイスやセンサー技術が進化し、リアルタイムでの生体情報収集や遠隔モニタリングを可能にしています。これにより、患者様の負担を軽減しつつ、より多くの実世界データ(RWD)を取得できるようになりました。さらに、遠隔医療技術の進展は、分散型臨床試験(DCT)やハイブリッド型臨床試験の実現を後押しし、患者様の地理的制約を緩和し、試験へのアクセスを向上させています。ゲノム解析やオミクス技術の進展は、バイオマーカーの特定や個別化医療の実現に向けた患者層別化を可能にし、より効果的な治療法の開発に寄与しています。
臨床試験の市場背景は、グローバル規模で拡大を続けております。新薬開発の需要の高まり、特に希少疾患や難病に対するアンメットメディカルニーズの存在が市場成長の大きな要因です。製薬企業、バイオテクノロジー企業、そして臨床試験受託機関(CRO)が主要なプレイヤーであり、CROは専門的な知識とリソースを提供することで、製薬企業の開発プロセスを支援しています。市場は、厳格な規制環境(ICH-GCP、各国の規制当局によるガイドラインなど)によって統制されており、倫理的な配慮と科学的妥当性が強く求められます。一方で、臨床試験は高額な費用と長い期間を要し、患者募集の困難さや高い失敗率といった課題も抱えています。しかし、COVID-19パンデミックは、ワクチン開発の加速と分散型臨床試験の導入を促し、業界全体のデジタル化と効率化を大きく推進しました。また、個別化医療や再生医療、遺伝子治療といった先端医療の進展も、臨床試験の複雑性を増す一方で、新たな市場機会を創出しています。
将来の臨床試験は、技術革新と患者中心のアプローチによって大きく変革されると予測されます。分散型臨床試験(DCT)やハイブリッド型臨床試験は、患者様の利便性を高め、地理的な障壁を低減することで、より多様な患者層の参加を促進し、標準的な試験形態となるでしょう。人工知能(AI)と機械学習(ML)は、患者選択の最適化、データ解析の自動化、試験デザインの効率化、さらには治験薬の有効性予測など、臨床試験のあらゆる段階でその活用が拡大します。リアルワールドエビデンス(RWE)の重要性も増し、電子カルテやレジストリデータ、ウェアラブルデバイスから得られる実世界データが、従来の臨床試験データと統合され、より包括的な治療効果と安全性の評価に用いられるようになります。個別化医療の進展に伴い、特定の遺伝子型やバイオマーカーを持つ患者様を対象とした、よりターゲットを絞った臨床試験が増加するでしょう。また、適応的デザイン試験のような柔軟な試験デザインが普及し、試験期間の短縮とコスト削減に貢献すると期待されています。患者様の声や経験を試験デザインに反映させる「患者中心」のアプローチも一層強化され、より患者様にとって意義のある治療法の開発へと繋がっていくことでしょう。これらの進化は、医薬品開発のスピードと成功率を高め、最終的には患者様へのより良い医療提供に貢献すると考えられます。