認知症治療薬市場:規模・シェア分析、成長動向と将来予測 (2025年~2030年)
認知症治療薬市場レポートは、薬剤分類(コリンエステラーゼ阻害薬、NMDA受容体拮抗薬など)、適応症(アルツハイマー病、パーキンソン病認知症など)、投与経路(経口など)、流通チャネル(病院薬局など)、および地域(北米、欧州など)別に分類されます。市場予測は、金額(米ドル)で示されます。

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
認知症治療薬市場の概要
市場規模と成長予測
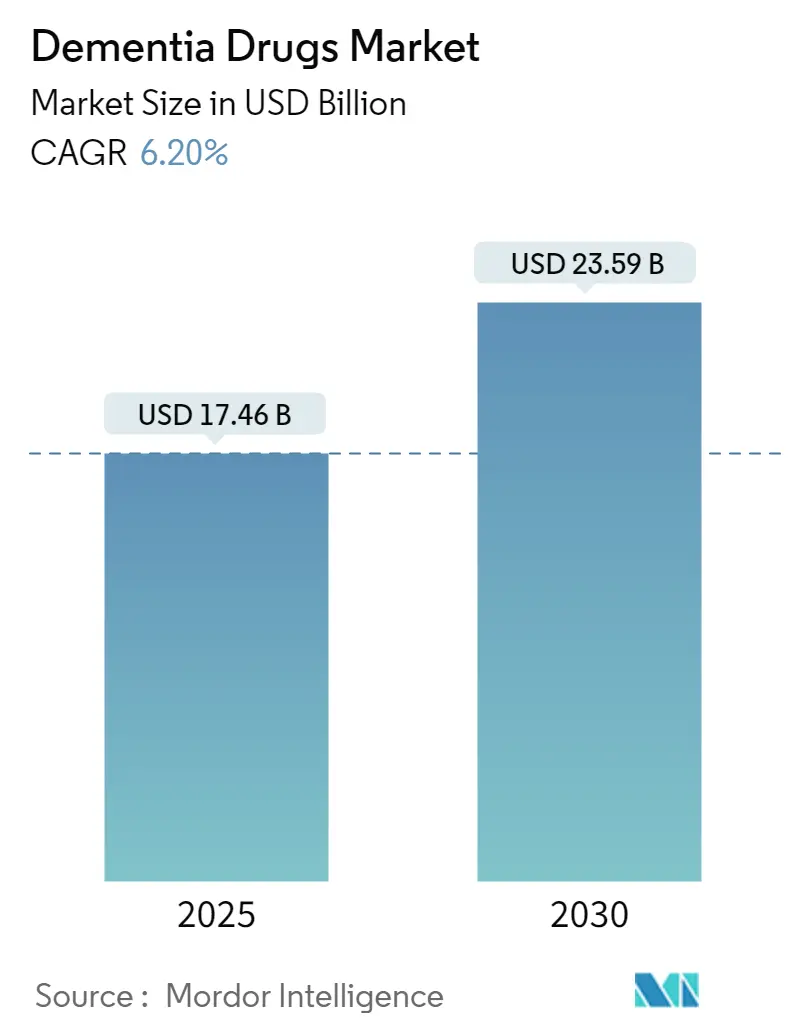
認知症治療薬市場は、2025年には174.6億米ドルと推定され、2030年までに235.9億米ドルに達すると予測されています。予測期間(2025年~2030年)における年平均成長率(CAGR)は6.20%です。この市場の成長は、疾患修飾型抗アミロイド抗体への強い需要、診断の普及拡大、および各国の認知症戦略による支援に支えられています。一方で、償還機関による価値評価基準の厳格化も進んでいます。競争は激化しており、既存企業は先行者利益を維持しようとする一方、小規模なバイオテクノロジー企業はタウ、神経炎症、遺伝子ベースの標的を探索しています。デジタル認知評価補助ツールやAIを活用した創薬プラットフォームが患者の特定とパイプラインの加速を促し、対象患者数を拡大しています。しかし、生物製剤の製造の複雑さやARIA(アミロイド関連画像異常)に関連する服薬遵守の課題が、短期的な市場の成長を抑制する要因となっています。
主要な市場動向
* 薬剤クラス別: コリンエステラーゼ阻害薬は2024年に認知症治療薬市場の50.57%を占めましたが、抗アミロイドモノクローナル抗体は2030年までに6.92%のCAGRで拡大すると予測されています。
* 適応症別: アルツハイマー病は2024年に認知症治療薬市場の61.15%を占め、軽度認知障害(MCI)は2030年までに7.10%のCAGRで成長すると予測されています。
* 投与経路別: 経口製剤が2024年の収益の56.77%を占めましたが、静脈内輸液は2030年までに7.29%と最も高いCAGRを記録すると予測されています。
* 流通チャネル別: 病院薬局が2024年の売上の54.60%を占め、市場をリードする7.48%のCAGRで成長しています。
* 地域別: アジア太平洋地域が最も急速に成長する市場であり、ヨーロッパが最大の市場です。市場の集中度は中程度です。
市場を牽引する要因
1. 高齢化と認知症有病率の急増: 65歳以上の人口が他のどの年齢層よりも速く増加しており、認知症の有病率が上昇しています。世界保健機関(WHO)は、世界の認知症患者数が2050年までに3倍になると予測しています。日本、韓国、イタリア、ドイツで短期的な有病率の急増が見られ、インド、ブラジル、インドネシアでは後期に患者数が大幅に増加すると予想されています。各国政府は早期診断、介護者支援、研究インフラに予算を割り当て、保険会社はバイオマーカーに基づく介入の償還を拡大しています。
2. 疾患修飾型抗アミロイド療法の承認: 2024年のイーライリリー社のKisunla(ドナネマブ)のFDA承認、および2025年のエーザイ社のレカネマブ(Leqembi)の欧州承認は、長年の挫折を経てアミロイド仮説を検証しました。これらの画期的な進展は、疾患修飾型治療薬に対する潜在的な需要を実際の売上へと転換させ、輸液センター、診断用PET容量、モニタリング経路の開発を促進しています。レカネマブの3年間のデータが持続的な効果を示したことも、医師の信頼をさらに強化しています。
3. 診断用バイオマーカーとPETトレーサーの採用拡大: 抗アミロイド療法開始前の必須のアミロイド確認により、PETスキャンとCSFバイオマーカーの使用が急増しています。FDAによるコンピュータ化された認知評価経路の明確化は、CognICAやCognivue Clarityなどのツールの市場アクセスを可能にし、記憶クリニック以外での地域ベースのスクリーニングを拡大しています。早期発見は、疾患修飾薬の対象となる軽度認知障害(MCI)患者のコホートを拡大し、その普及を加速させています。
4. デジタル治療薬と併用療法の登場: NeuroNation MEDなどのデジタル認知トレーニングプログラムは、現在クラスII医療機器として認識されており、薬物療法と併用して処方することが可能になっています。継続的なモニタリングは患者固有のデータを生成し、投与間隔を最適化し、ARIA関連症状を早期に検出します。製薬会社は、測定可能な機能的アウトカムに対する支払者の要求を満たすために、アプリと輸液を組み合わせ、服薬遵守を促進するバンドル型償還コードを作成しています。抗アミロイド抗体と抗タウ抗体などの併用療法は、相加的な有効性の予備的な兆候を示し、第2相試験に進んでいます。
5. 政府の認知症対策と資金提供の増加: 北米、ヨーロッパ、オーストラリア、および一部のアジア太平洋諸国では、政府の認知症対策と資金提供の勢いが増しています。
6. AIを活用した創薬プラットフォームによるR&Dサイクルの短縮: AIを活用した創薬プラットフォームは、研究開発サイクルを短縮し、市場の成長に貢献しています。
市場を抑制する要因
1. 高い臨床試験失敗率と投資リスク: アルツハイマー病の臨床試験の失敗率は90%を超え、腫瘍学や心血管疾患のベンチマークを上回っています。2024年のロシュ、セージ、大塚製薬の失敗は投資家の警戒心を再確認させ、ハードルレートを上昇させ、民間資金の流入を遅らせています。神経学的エンドポイント、プラセボ効果、異質な患者生物学が統計的検出力を複雑にし、第3相プログラムあたりのコストを10億米ドル以上に押し上げています。
2. 厳格な医療技術評価(HTA)/償還のハードル: NICEによる2024年のレカネマブとKisunlaの費用対効果に基づく承認拒否案は、ヨーロッパの厳しい価格設定環境を浮き彫りにしています。HTA機関は、QALY(質調整生存年)モデルにおいて介護者の負担や間接的な社会的コストを見落とすことが多く、長期的な疾患修飾効果を過小評価しています。
3. 有害事象による患者の服薬遵守の制限: 有害事象による患者の服薬遵守の制限は、市場の成長を抑制する要因となっています。
4. 複雑な生物製剤製造へのサプライチェーン依存: 複雑な生物製剤製造へのサプライチェーン依存は、集中リスクを伴い、市場の成長を抑制する可能性があります。
セグメント分析
* 薬剤クラス別: コリンエステラーゼ阻害薬は2024年に50.57%のシェアを維持し、軽度から中等度のアルツハイマー病の第一選択薬としての役割を確立しています。しかし、抗アミロイドモノクローナル抗体は、北米、ヨーロッパ、韓国での新規承認に支えられ、6.92%のCAGRで最も急速に拡大しています。NMDA受容体拮抗薬は中等度から重度の段階に対応していますが、差別化が限定的です。抗タウおよびキナーゼ阻害薬を中心としたパイプラインはFDAのファストトラック指定を受け、商業的な選択肢を広げています。ジョンソン・エンド・ジョンソン社のポスディネマブは2025年1月にファストトラック指定を受け、ブリストル・マイヤーズ スクイブ社はコベンフィーを精神病、興奮、認知にまたがる多適応症プラットフォームへと再配置しています。抗アミロイド薬の市場規模は2030年までに倍増すると予測されています。
* 適応症別: アルツハイマー病は2024年に61.15%の圧倒的なシェアを維持していますが、軽度認知障害(MCI)は、プライマリケアにおけるバイオマーカーガイド診断の拡大により、2030年までに7.10%のCAGRで最も急速に成長するニッチ市場として浮上しています。パーキンソン病認知症およびレビー小体型認知症は、より小規模ながらも重要な治療領域を維持しています。
* 投与経路別: 経口投与は利便性と低いモニタリング要件から2024年の売上の56.77%を占め、引き続き優位に立っています。しかし、主に抗アミロイド抗体である静脈内製剤は、7.29%のCAGRで最も急速に成長しており、認知症治療薬市場における大きな変化を示しています。病院や専門の輸液センターは、ARIA監視を目的としたメーカー資金によるMRIプログラムに支えられ、能力を拡大しています。
* 流通チャネル別: 病院薬局は2024年に総収益の54.60%を占め、2030年までに7.48%のCAGRで他のすべてのチャネルを上回ると予想されています。複雑な調製プロトコル、輸液監視、償還手続きにより、生物製剤の調剤は急性期医療施設に集中し、病院の市場における優位性を強化しています。
地域分析
* 北米: 有利な償還制度、早期の規制承認、広範な臨床研究インフラに支えられ、認知症治療薬市場をリードし続けています。メディケアによるアミロイドPETイメージングの全国的なカバレッジ決定は、重要な障壁を取り除き、より正確な患者選択を可能にしています。
* アジア太平洋: 膨大な人口規模と一人当たりの医療費の増加に支えられています。日本の超高齢社会は短期的な需要を牽引し、アミロイドおよびタウトレーサーを供給できる強力な国内診断産業に支えられています。韓国の単一支払者制度は、リスク共有償還の下でレカネマブを迅速に統合し、高価な疾患修飾療法を受け入れる制度的準備が整っていることを示しています。中国は、その巨大な患者プールが比類のない潜在的利益をもたらす一方で、進化する規制とサプライチェーンの摩擦が実行リスクをもたらしています。
* ヨーロッパ: 安定した、しかし緩やかな成長を遂げています。各国のHTA機関は引き続き薬価を抑制し、企業に機密割引や条件付き価値契約を受け入れるよう求めています。ドイツの新しい診断薬の迅速な採用は、英国やスペインでの治療薬の普及の遅さとバランスが取れています。
競争環境
市場構造は、バイオジェン、エーザイ、イーライリリーによって中程度に集中しており、これらの企業は先行者利益を持つ抗アミロイドフランチャイズによって製造経済性と臨床医の認知度を享受しています。ジョンソン・エンド・ジョンソン、ロシュ、ノバルティスがタウおよび神経炎症資産を追求し、今後5年間で既存企業のシェアを侵食する可能性があるため、競争は激化しています。ロシュのAIコラボレーションは、サブ1ナノモル効力分子のパイプラインを構築しようとしており、エーザイは日本のデジタル治療薬企業と提携してレカネマブと認知トレーニングソフトウェアをパッケージ化しています。ボイジャー・セラピューティクスのような小規模なイノベーターは、単回投与でタウ産生を停止させることを目的とした遺伝子サイレンシング構造を進めており、慢性輸液パラダイムを飛び越える可能性があります。
価格設定とアクセス戦略も同様に決定的な要素です。イーライリリーは、MMSEスコアの維持に連動した成果ベースの契約を米国の支払者と開始しており、バイオジェンは統合された薬剤と診断のバンドルに対する定額制サブスクリプションモデルを模索しています。
最近の業界動向
* 2025年1月: ジョンソン・エンド・ジョンソンは、早期アルツハイマー病を標的とするリン酸化タウモノクローナル抗体であるポスディネマブについて、FDAのファストトラック指定を受けました。
* 2025年1月: ブリストル・マイヤーズ スクイブは、アルツハイマー病関連の興奮および認知症に対するコベンフィーを位置づけ、ピーク売上高を100億米ドルと予測しました。
* 2024年7月: イーライリリーは、早期症候性アルツハイマー病治療薬Kisunla(ドナネマブ)についてFDAの承認を得ました。
このレポートは、世界の認知症治療薬市場に関する包括的な分析を提供しています。認知症は、思考、記憶、推論、行動能力といった認知機能が日常生活に支障をきたすほどに低下する状態を指し、アルツハイマー病がその最も一般的な原因です。
市場規模と成長予測に関して、認知症治療薬市場は2025年に174.6億米ドルの規模に達し、2030年には235.9億米ドルに成長すると予測されています。
市場の主要な推進要因としては、高齢化人口の増加と認知症有病率の急増が挙げられます。また、疾患修飾型抗アミロイド療法の承認、診断バイオマーカーやPETトレーサーの採用拡大、デジタル治療薬や併用療法の登場も市場を牽引しています。さらに、政府による認知症対策計画と資金提供の勢い、AIを活用した創薬プラットフォームによる研究開発サイクルの短縮も重要な要素です。
一方で、市場にはいくつかの抑制要因も存在します。高い臨床試験失敗率とそれに伴う投資リスク、厳格な医療技術評価(HTA)および償還のハードル、有害事象による患者アドヒアランスの低下、複雑な生物学的製剤製造におけるサプライチェーンへの依存などが挙げられます。
製品クラス別では、抗アミロイドモノクローナル抗体が最も急速に成長しており、新規承認された疾患修飾型治療薬の普及により、2030年までに年平均成長率(CAGR)6.92%で拡大すると見込まれています。その他、コリンエステラーゼ阻害薬、NMDA受容体拮抗薬、マルチターゲットキナーゼ阻害薬などの新興クラスも分析対象です。
適応症別では、アルツハイマー病が最も主要なセグメントであり、パーキンソン病認知症、レビー小体型認知症、前頭側頭型認知症なども含まれます。投与経路は経口、静脈内、経皮に、流通チャネルは病院薬局、小売薬局、オンライン薬局に分類されています。
地域別分析では、アジア太平洋地域が最も魅力的な成長地域として注目されています。急速な高齢化、医療費支出の拡大、日本や韓国における有利な償還決定が後押しとなり、2030年までにCAGR 7.67%で成長すると予測されています。一方、欧州では、厳格な医療技術評価基準、特に費用対効果の閾値が、高価な生物学的製剤の償還を遅らせる障壁となっています。
競争環境においては、Biogen Inc.、Eisai Co., Ltd.、Eli Lilly and Company、Novartis AG、Pfizer Inc.、Johnson & Johnson、F. Hoffmann-La Roche AG、Otsuka Pharmaceutical Co., Ltd.など、多数の主要製薬企業が市場に参入しており、市場集中度や市場シェア分析、各社のプロファイルが詳細に報告されています。
本レポートは、市場の機会と将来の展望、特に未開拓領域や満たされていないニーズの評価についても言及しており、認知症治療薬市場の全体像を深く理解するための包括的な情報を提供しています。

1. はじめに
2. 調査方法
3. エグゼクティブサマリー
4. 市場概況
- 4.1 市場概要
- 4.2 市場の推進要因
- 4.2.1 高齢化人口と認知症有病率の急増
- 4.2.2 疾患修飾型抗アミロイド療法の承認
- 4.2.3 診断バイオマーカーとPETトレーサーの採用拡大
- 4.2.4 デジタル治療薬と併用療法の登場
- 4.2.5 政府の認知症対策と資金調達の勢い
- 4.2.6 AIを活用した創薬プラットフォームによる研究開発サイクルの短縮
- 4.3 市場の阻害要因
- 4.3.1 高い臨床試験失敗率と投資リスク
- 4.3.2 厳格なHTA/償還のハードル
- 4.3.3 有害事象による患者アドヒアランスの制限
- 4.3.4 複雑な生物学的製剤製造へのサプライチェーン依存
- 4.4 バリュー/サプライチェーン分析
- 4.5 規制環境
- 4.6 技術的展望
- 4.7 ポーターの5つの力
- 4.7.1 新規参入の脅威
- 4.7.2 供給者の交渉力
- 4.7.3 買い手の交渉力
- 4.7.4 代替品の脅威
- 4.7.5 競争上の対立
5. 市場規模と成長予測(金額)
- 5.1 薬物クラス別
- 5.1.1 コリンエステラーゼ阻害薬
- 5.1.2 NMDA受容体拮抗薬
- 5.1.3 抗アミロイドモノクローナル抗体
- 5.1.4 マルチターゲットキナーゼおよびその他の新興クラス
- 5.2 適応症別
- 5.2.1 アルツハイマー病
- 5.2.2 パーキンソン病認知症
- 5.2.3 レビー小体型認知症および前頭側頭型認知症
- 5.3 投与経路別
- 5.3.1 経口
- 5.3.2 静脈内
- 5.3.3 経皮
- 5.4 流通チャネル別
- 5.4.1 病院薬局
- 5.4.2 小売薬局
- 5.4.3 オンライン薬局
- 5.5 地域別
- 5.5.1 北米
- 5.5.1.1 米国
- 5.5.1.2 カナダ
- 5.5.1.3 メキシコ
- 5.5.2 ヨーロッパ
- 5.5.2.1 ドイツ
- 5.5.2.2 英国
- 5.5.2.3 フランス
- 5.5.2.4 イタリア
- 5.5.2.5 スペイン
- 5.5.2.6 その他のヨーロッパ
- 5.5.3 アジア太平洋
- 5.5.3.1 中国
- 5.5.3.2 インド
- 5.5.3.3 日本
- 5.5.3.4 韓国
- 5.5.3.5 オーストラリア
- 5.5.3.6 その他のアジア太平洋
- 5.5.4 南米
- 5.5.4.1 ブラジル
- 5.5.4.2 アルゼンチン
- 5.5.4.3 その他の南米
- 5.5.5 中東およびアフリカ
- 5.5.5.1 GCC
- 5.5.5.2 南アフリカ
- 5.5.5.3 その他の中東およびアフリカ
6. 競合情勢
- 6.1 市場集中度
- 6.2 市場シェア分析
- 6.3 企業プロファイル(グローバル概要、市場概要、主要セグメント、利用可能な財務情報、戦略情報、主要企業の市場ランキング/シェア、製品およびサービス、最近の動向を含む)
- 6.3.1 Biogen Inc.
- 6.3.2 Eisai Co., Ltd.
- 6.3.3 Eli Lilly and Company
- 6.3.4 Novartis AG
- 6.3.5 Pfizer Inc.
- 6.3.6 Johnson & Johnson
- 6.3.7 F. Hoffmann-La Roche AG
- 6.3.8 Otsuka Pharmaceutical Co., Ltd.
- 6.3.9 Lundbeck A/S
- 6.3.10 Merck & Co., Inc.
- 6.3.11 AbbVie Inc.
- 6.3.12 Amgen Inc.
- 6.3.13 AC Immune SA
- 6.3.14 Cassava Sciences, Inc.
- 6.3.15 Cognition Therapeutics
- 6.3.16 BioArctic AB
- 6.3.17 Sun Pharma Advanced Research Company
7. 市場機会と将来展望
*** 本調査レポートに関するお問い合わせ ***

認知症治療薬とは、認知症の症状を緩和したり、病気の進行を遅らせたりすることを目的とした薬剤の総称でございます。認知症は、脳の機能が徐々に低下し、記憶、思考、判断力などに障害が生じる疾患であり、その原因は多岐にわたります。現在、最も一般的なアルツハイマー型認知症をはじめ、レビー小体型認知症、血管性認知症など、様々なタイプが存在し、それぞれに合わせた治療薬の開発が進められております。これらの薬剤は、患者様の生活の質の維持・向上を目指し、症状の管理と病態の改善に貢献することが期待されております。
現在、認知症治療薬として主に用いられているのは、対症療法薬と呼ばれるものでございます。これらは、脳内の神経伝達物質のバランスを調整することで、認知機能の改善や精神症状の緩和を図ります。代表的なものとして、コリンエステラーゼ阻害薬とNMDA受容体拮抗薬がございます。コリンエステラーゼ阻害薬には、ドネペジル、ガランタミン、リバスチグミンなどがあり、脳内のアセチルコリンという神経伝達物質の分解を抑えることで、記憶や学習に関わる神経機能を高めます。これらは主に軽度から中等度のアルツハイマー型認知症に用いられ、ドネペジルはレビー小体型認知症の認知機能障害にも適応がございます。一方、NMDA受容体拮抗薬であるメマンチンは、脳内のグルタミン酸の過剰な興奮を抑制し、神経細胞の損傷を防ぐことで、中等度から重度のアルツハイマー型認知症の症状進行を遅らせる効果が期待されております。これらの薬剤は、認知症の根本的な原因を取り除くものではなく、あくまで症状の進行を一時的に抑制したり、症状を緩和したりする目的で使用されます。
近年、大きな注目を集めているのが、疾患修飾薬と呼ばれる新しいタイプの治療薬でございます。これらは、認知症、特にアルツハイマー型認知症の根本原因と考えられている病態メカニズムに直接作用し、病気の進行そのものを遅らせることを目指しております。その代表的なターゲットは、脳内に蓄積する異常なタンパク質であるアミロイドβとタウでございます。アミロイドβを標的とする抗体医薬としては、アデュカヌマブ、レカネマブ、ドンレネマブなどが開発され、一部は既に承認されております。これらの薬剤は、脳内のアミロイドβプラークを除去することで、病気の進行を抑制する効果が示されております。タウ蛋白を標的とする薬剤の開発も進められており、神経細胞の変性や死滅を防ぐことが期待されております。さらに、神経炎症、シナプス機能不全、ミトコンドリア機能障害など、多岐にわたる病態メカニズムを標的とした薬剤の研究開発も活発に行われております。
認知症治療薬の用途は、主にアルツハイマー型認知症の軽度から中等度の症状における認知機能の維持や進行抑制、レビー小体型認知症における認知機能障害や幻視などの精神症状の改善でございます。血管性認知症に対しては、特異的な治療薬はまだ確立されておりませんが、高血圧や糖尿病などの基礎疾患の管理、脳梗塞や脳出血の再発予防が重要となります。これらの薬物療法は、リハビリテーション、生活習慣の改善、適切なケアといった非薬物療法と組み合わせて行われることが一般的でございます。早期に診断し、適切な時期に治療を開始することが、患者様の予後や生活の質に大きく影響すると考えられております。
認知症治療薬の開発を支える関連技術も目覚ましい進歩を遂げております。最も重要なのは、バイオマーカーの開発でございます。脳脊髄液や血液検査によって、アミロイドβやタウ蛋白の異常を検出する技術は、認知症の超早期診断や治療効果の判定に不可欠でございます。また、PET検査による脳内のアミロイド蓄積やタウ蓄積の可視化は、病態の進行度を客観的に評価する上で極めて有用でございます。画像診断技術では、MRIやPETスキャンが脳の萎縮や病変の特定に用いられ、病態の理解を深めております。遺伝子解析技術の進歩により、APOE4などの認知症リスク遺伝子が特定され、個別化医療への応用が期待されております。さらに、AIやビッグデータ解析は、膨大な研究データから新たな創薬ターゲットを探索したり、臨床試験の効率化を図ったりする上で重要な役割を担っております。脳血液関門を通過させるDDS(Drug Delivery System)技術の開発も、脳疾患治療薬の課題解決に向けた重要な研究分野でございます。
認知症治療薬の市場背景は、世界的な高齢化の進展に伴い、認知症患者数が爆発的に増加していることにあります。これにより、認知症治療薬に対するアンメットメディカルニーズは非常に高く、巨大な市場が形成されつつあります。しかし、新薬開発は極めて困難であり、多くの候補薬が臨床試験で失敗してきた歴史がございます。既存の対症療法薬は症状緩和に留まるため、疾患の進行を根本的に抑制する疾患修飾薬への期待は非常に大きいものでした。近年承認された抗体医薬は、その効果が期待される一方で、高額な薬価が医療経済に与える影響も懸念されております。また、早期診断の重要性が高まるにつれて、診断薬や診断技術の市場も拡大しており、治療薬と診断薬が一体となった開発が進められております。
将来展望として、認知症治療薬はさらなる進化を遂げることが期待されております。まず、バイオマーカーのさらなる進化と普及により、認知症の発症前や超早期段階での診断が可能となり、より効果的な介入が実現するでしょう。これにより、病態が進行する前の段階で治療を開始し、発症を遅らせたり、症状の発現を予防したりする「予防医療」へのシフトが進む可能性があります。次に、遺伝子情報やバイオマーカーに基づいた「個別化医療」が確立され、患者様一人ひとりの病態や遺伝的背景に合わせた最適な治療法が選択できるようになるでしょう。治療ターゲットも、アミロイドβやタウだけでなく、神経炎症、シナプス機能不全、ミトコンドリア機能障害など、複数の病態メカニズムを標的とする複合療法が主流となる可能性もございます。薬物療法だけでなく、デジタルセラピューティクスやVR/ARを活用した認知機能訓練など、非薬物療法の進化も期待されます。長期的には、再生医療や遺伝子治療といった最先端の医療技術が認知症治療に応用される可能性も秘めており、認知症の克服に向けた研究開発は今後も加速していくことでしょう。