皮膚毒性試験市場の規模とシェア分析 – 成長トレンドと予測(2025-2030年)
皮膚毒性試験市場レポートは、試験タイプ(インビトロ、インシリコ、エクスビボ、インビボ)、毒性評価項目(皮膚刺激性、腐食性、感作性、吸収、光毒性)、エンドユーザー(化粧品、医薬品、化学品、CRO、学術機関)、および地域(北米、欧州、アジア太平洋、MEA、南米)別に分類されます。市場予測は金額(米ドル)で提供されます。

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
皮膚毒性試験市場の概要
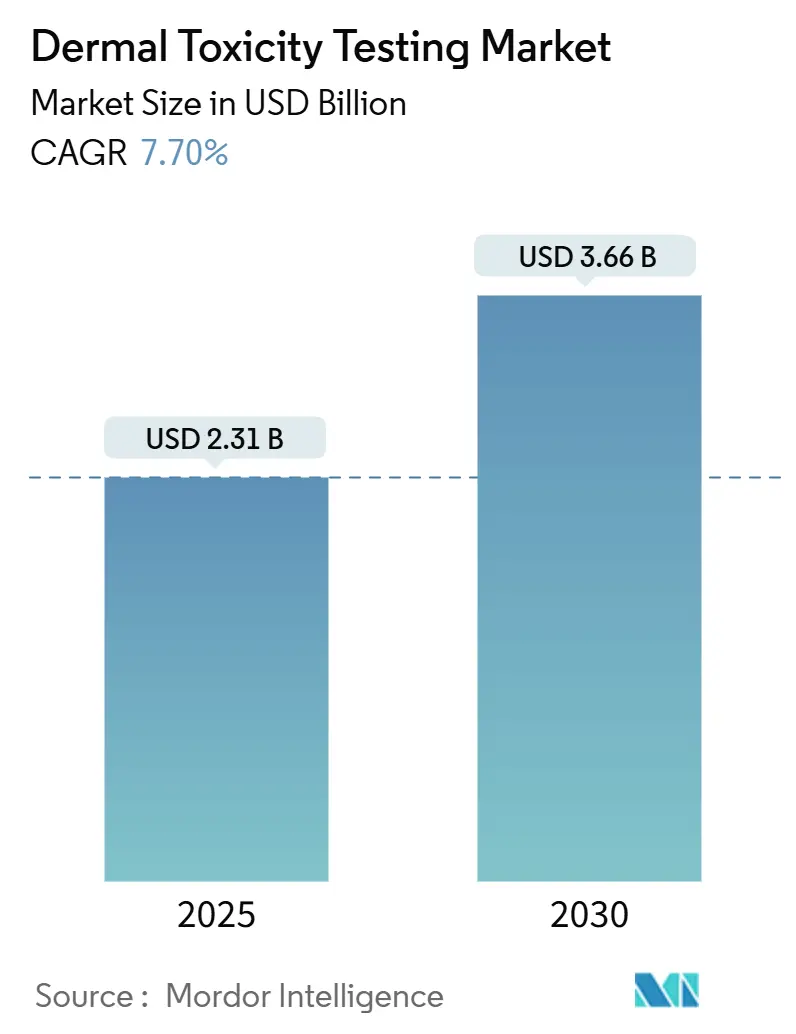
皮膚毒性試験市場は、2025年に23.1億米ドルに達し、2030年までに年平均成長率(CAGR)7.7%で拡大し、36.6億米ドルに達すると予測されています。この市場の成長は、動物実験を行わない安全性データに対する規制圧力の高まり、再構築ヒト表皮(RHE)システムの迅速な検証、そしてAI駆動型インシリコモデルにおける画期的な進歩によって総合的に支えられています。特に、ESG(環境・社会・ガバナンス)に関する義務の強化により、「動物実験なし」の表示を求める化粧品業界のリーダー企業による支出が増加しています。また、米国食品医薬品局(FDA)が2025年4月に新しいアプローチ手法(NAMs)に基づく申請を合理化するロードマップを発表したことで、製薬企業はパイロットプログラムを加速させています。
地域別では、北米が先行者利益を維持していますが、アジア太平洋地域は中国や日本の規制当局が代替試験ガイドラインを法制化しているため、最も速い収益成長を記録しています。市場の競争は激化しており、既存企業はバイオプリンティングや計算モジュールを追加しています。しかし、OECDのリング試験結果が40以上の国家当局の承認を得る必要があるため、検証のハードルは依然として高い状況です。
主要な市場動向と洞察
市場を牽引する要因:
1. 化粧品における動物実験の規制禁止(CAGRへの影響:+2.10%)
* 複数の法域で動物実験禁止が法制化され、皮膚毒性試験市場に構造的な需要シフトをもたらしています。2024年までに米国では12州が包括的な禁止措置を施行し、欧州連合の10年来の販売制限に追随しています。カナダも2023年12月に同様の法律を制定し、北米全体でこの動きが加速しています。規制の焦点は化学物質や医薬品にも広がり、米国環境保護庁(EPA)は2024年末までに皮膚毒性評価のための140の代替方法を承認し、FDAの2025年ロードマップは治験薬申請(IND)におけるNAMsの利用を正式に奨励しています。日本も2024年に非動物プロトコルに関するガイダンスを発表し、アジア太平洋地域での連携を確認しました。これらの動きは、NAMデータを持たない企業にとってコンプライアンスリスクを高め、試験予算を検証済みのインビトロおよびインシリコサービスへと振り向けています。
2. FDAおよびOECDによるインビトロ・インシリコアッセイの承認加速(CAGRへの影響:+1.80%)
* FDAの2025年4月の「前臨床安全性試験における動物実験削減ロードマップ」は、オルガンオンチップ、AIベースのモデリング、仮想患者シミュレーションを支持し、早期導入企業に合理化された審査経路を提供しています。OECDは2024年に試験ガイドライン497および496の更新を迅速化し、オミクスベースの読み出しとデータ共有フレームワークを統合しました。カナダは2024年9月にCEPAに基づく補完的なドラフト戦略を発表し、2035年までにNAMsへの完全移行を目指しています。この迅速な承認は、歴史的なボトルネックであった規制の不確実性を解消し、皮膚毒性試験市場に深く根ざしたプラットフォームプロバイダーの研究開発投資に対するリターンを増幅させています。
3. バイオプリンティングされた3Dヒト皮膚モデルの成長(CAGRへの影響:+1.40%)
* バイオプリンティングの進歩により、細胞外マトリックスの複雑さと灌流可能な微小血管を持つ組織構造が実現され、インビトロとインビボの翻訳ギャップが縮小しています。グラーツ大学の研究者らは2025年4月に、堅牢な機械的特性を持つ生細胞を含む3Dプリント皮膚を実証しました。EPISKINは2024年にSkinEthic RHEポートフォリオを拡張し、真皮と皮下組織を含むフォーマットを追加しました。FDAはバイオプリンティングされた皮膚製品を用いた初のヒト臨床試験を承認し、安全性スクリーニングのための3D組織評価に対する規制当局の準備が整っていることを示しています。単位コストは依然として高いものの、北米には約75の活発なバイオプリンティング企業が存在し、スケールアップの革新を加速させています。
4. AIを活用した刺激性スクリーニングのための高含量イメージング(CAGRへの影響:+1.20%)
* 機械学習アルゴリズムは、分子記述子を解析するLSTMネットワークを用いて、刺激性プロファイリングで80%の予測精度を実現しています。MolToxPredプラットフォームは、ランダムフォレストとLightGBM分類器を組み合わせることで87.76%のAUROCを達成し、アルゴリズムアンサンブルによる競争優位性を浮き彫りにしています。高含量イメージングシステムは細胞形態分析を自動化し、アッセイ期間を数週間から数日に短縮し、グローバルなラボネットワーク全体で出力を標準化しています。FDAの2025年ロードマップはAI駆動型計算毒性学を優先事項として挙げていますが、開発者は患者の安全性リスクに比例した詳細なモデル文書を提供する必要があります。
市場を抑制する要因:
1. 一部のインビトロアッセイにおけるヒト結果との予測相関の限定性(CAGRへの影響:-1.60%)
* 規制当局は、特に先天性免疫と適応免疫が関与する皮膚感作のような複雑なエンドポイントにおいて、アッセイ結果が臨床観察と乖離する場合、依然として慎重な姿勢を崩していません。ヒトの予測パッチテストデータは、現在のRHEモデルが再現に苦慮する変動性を示しています。OECDはガイドライン承認前に多施設リング試験を要求しており、商業化のタイムラインを長期化させています。小規模な開発者は、これらの研究資金を調達するための高いハードルに直面しています。オミクスレベルの分析を3D組織と統合することで、より豊富なメカニズム的洞察が期待されますが、標準プロトコルはまだ調和の途上にあります。
2. 3D組織培養プラットフォームの高い設備投資コスト(CAGRへの影響:-1.20%)
* バイオリアクター、無菌処理スイート、GMPグレードの品質システムにかかる設備投資は、多くの中堅ラボの予算を圧迫し、富裕な多国籍企業以外でのNAM導入を制限しています。Charles River Laboratoriesは、完全に装備された3D組織施設が初期費用で1,000万米ドルを超える可能性があると推定しています。さらに、自動処理下での細胞生存率維持におけるスケールアップの課題が運用コストを上昇させています。長期的には動物実験を行わない試験が経済的に有利であるものの、短期的な資金負担が投資を遅らせており、特に熟練労働者が不足している新興市場で顕著です。
セグメント分析
* 試験タイプ別:インビトロが優勢、計算手法が急成長
* インビトロRHEシステムは、OECD TG 439およびTG 431の承認に支えられ、2024年の皮膚毒性試験市場シェアの41.8%を占め、最大となりました。RHEプラットフォームの市場規模は、血管化構造の検証パイプラインが最終段階に入るにつれて着実に進展すると予測されています。インシリコアッセイは、数百万の化学情報記録を取り込むAIライブラリに牽引され、2030年までに最も速い15.8%のCAGRを記録すると見込まれています。
* RHEの成熟は、その再現可能なバリア機能測定とGLPラボへの移行の容易さに起因しています。iPSC由来のケラチノサイト調達などの反復的な改善は、ドナー変動リスクを低減し、無制限の細胞バンクを確保します。迅速なインシリコスクリーニングと確認的なRHE試験を組み合わせるハイブリッド戦略は、開発サイクルを短縮し、試薬コストを削減するため、グローバルポートフォリオを拡大する企業にとって魅力的な提案です。しかし、3Dバイオプリンティングされた皮膚は依然としてスループットのボトルネックに直面しており、優れた生理学的関連性にもかかわらず、短期的なシェア拡大は限定的です。
* OECDによるex-vivo皮膚(MUG-hOSEC)の承認は、免疫応答性アッセイにおけるニッチな採用を確固たるものにしています。皮下脂肪層の組み込みは代謝忠実度を高め、より単純な組織では検出できない界面活性剤誘発性脂質障害を明らかにします。並行して、化学情報学アルゴリズムは、経験的データが不足している新規UVフィルターの予測毒性学を可能にしています。この二重の軌跡、すなわち生物学的洗練とデジタルシミュレーションは、皮膚毒性試験市場を、ウェットラボとドライラボの二者択一ではなく、統合された試験エコシステムとして位置づけています。
* 毒性エンドポイント別:刺激性が先行、感作性が加速
* 皮膚刺激性プロトコルは、すべての化粧品および化学物質の申請にこのエンドポイントが義務付けられているため、2024年の収益の38.5%を占め、皮膚毒性試験市場規模の最大のシェアを確保しました。しかし、皮膚感作は、複数のインビトロおよびインシリコのエントリーポイントを開いたOECDの有害性発現経路に推進され、2030年までに最も速い14.4%のCAGRを記録すると予測されています。
* 従来の腐食性アッセイは二値的な読み出しを提供するため、緩やかな成長を示しています。光毒性試験は、日焼け止めや全身性薬剤市場にUV相乗反応に関する認識が浸透するにつれて徐々に増加しています。ベンゾフェノン-4の次世代リスク評価は、NAMsが動物モデルなしで規制当局の書類を完成させることができる方法を強調しています。クロスエンドポイントプラットフォームが支持を集めており、単一の3Dモデルで刺激性、腐食性、および予備的な吸収を定量化できるようになり、サンプル使用量と分析時間を最小限に抑えています。その結果、統一されたプラットフォームで複数のアッセイを実行できるベンダーは、皮膚毒性試験市場全体で顧客維持と経常収益を強化しています。
* エンドユーザー別:化粧品が依然として最大、製薬が加速
* 欧州連合および州レベルの禁止措置によりNAMsへの完全移行が義務付けられたため、化粧品およびパーソナルケア製品メーカーは2024年に44.3%の収益を維持しました。彼らの早期導入は、大規模な社内ラボを構築しましたが、ティア2ブランド向けの堅牢なアウトソーシングチャネルも確立しました。製薬およびバイオテクノロジー企業は、規模は小さいものの、FDAの2025年ガイドラインがIND安全性セクションでオルガンチップデータを明示的に認識したことに触発され、2030年までに13.6%の成長経路をたどっています。
* 化学および農薬企業は、REACH更新に準拠するため、ドレイズ試験やウサギ刺激性試験の着実な代替を進めています。SGS、Charles River、Eurofinsなどの受託研究機関(CROs)は、多分野にわたる需要の急増に対応するためNAMsの能力を拡大し、規制当局を安心させるグローバルなGLP拠点の構築に投資しています。ESG駆動型の調達ポリシーは現在、役員レベルのリスクマトリックスに浸透しており、企業は主要小売店での棚スペースを確保するために、動物実験を行わない試験を文書化する必要があります。このような圧力はセグメント全体に統合され、皮膚毒性試験業界をニッチな地位を超えて高める採用の基盤を織りなしています。
地域分析
* 北米: 2024年の41.2%のシェアは、成熟したCRO環境、積極的なFDAの姿勢、豊富なベンチャーキャピタルを反映しています。この地域はまた、バイオプリンティングスタートアップの最も密度の高いクラスターを擁し、高度な組織フォーマットの継続的なパイプラインを供給しています。米国のテクノロジーハブはAIの才能を活用して毒性アルゴリズムを改良しており、カナダの2023年の化粧品禁止措置はNAMsの需要をさらに定着させています。
* 欧州: ホライズン助成金の下での業界と学術界の共同コンソーシアムを通じて堅調な成長を維持しています。フランスは組織工学サプライチェーンの多くを支えており、EPISKINのリヨン施設はSkinEthic RHEキットを世界中に輸出しています。皮膚毒性試験市場は、EUの相互承認制度の恩恵を受けており、加盟国間での試験の移植性を可能にし、重複試験の費用を削減しています。
* アジア太平洋: 規制当局が代替試験基準に収束しているため、最も速い13.2%のCAGRを記録しています。中国の2025年2月の規定は、非動物データによる成分登録を合理化し、2025年5月の包括的な安全性規則と7月の実施スケジュールは、国内ラボの能力向上を促しています。日本は2025年後半に予定されている化学物質審査規制法の更新についてパブリックコメントを募集しており、OECD TGの改訂と連携しています。細胞培養毒性学者のトレーニングプログラムが需要に追いついていないため、能力の制約は依然として存在し、欧米のCROとの合弁事業の機会を生み出しています。それにもかかわらず、RHEキットの現地生産の増加は、輸入依存度を緩和し、アジア全体の皮膚毒性試験市場の足跡を深めることになると予想されます。
* ラテンアメリカおよび中東・アフリカ: まだ初期段階にあります。ブラジルはANVISAとOECD TG 439との連携を通じて地域での採用を推進していますが、規制の断片化が均一な採用を妨げています。湾岸協力会議(GCC)諸国は、特に高級化粧品の輸入に動物実験を行わない認証が求められる場合、関心を示しています。技術移転パートナーシップや移動式試験ユニットは、インフラのギャップを埋め、段階的な収益を促進する可能性があります。
競争環境
皮膚毒性試験市場は中程度の断片化を示しています。グローバルCRO(SGS、Charles River、Eurofins Scientific)は多エンドポイントサービススイートを指揮する一方、専門の組織およびAI開発者はニッチな差別化を図っています。参入障壁には、高い検証コスト、GLP認定、および数十年にわたる規制当局との関係が含まれます。MatTekとEPISKINは、独自の細胞株とOECDへの組み込みを活用し、商業用RHEキット供給においてリーダーシップを維持しています。
戦略的提携が活発化しています。ロレアルによるガルデルマへの2024年8月の10%出資は、コスメシューティカル生物学と臨床皮膚科学のパイプラインを統合し、トランスレーショナルリサーチの範囲を拡大しています。CROは、デジタル毒性学のバリューチェーンを獲得するためにAI企業を合併または買収しています。US BioTekによるRealTime Laboratoriesの2024年3月の買収は、診断カバレッジを広げ、地理的範囲を拡大しました。MolToxPredのようなスタートアップは、社内データサイエンスを持たない既存企業に計算エンジンをライセンス供与し、化合物ごとのサブスクリプションモデルを通じて収益化しています。
テクノロジーロードマップは、刺激性、感作性、吸収性試験を単一の組織構造で実行し、生画像をクラウドAIダッシュボードに供給できる統合プラットフォームを支持しています。OECD GLPおよびISO 9001認証は市場の前提条件であり、既存企業のシェアを保護するコンプライアンスの堀を形成しています。小児皮膚科モデル、マイクロバイオームを含む皮膚、および個別化医療に合致する遺伝子型特異的組織には、依然として未開拓の領域が存在します。NAM対応の検証でこれらのギャップに対処するベンダーは、今後5年間で皮膚毒性試験市場において大きな利益を確保する可能性があります。
主要企業
* Eurofins Scientific
* SGS SA
* Charles River Laboratories
* Labcorp Drug Development
* Intertek Group
最近の業界動向
* 2025年4月: FDAはNAMsを支持するロードマップを発表し、規制当局への提出書類におけるオルガンオンチップおよびAI毒性学を正式に承認しました。
* 2025年4月: グラーツ工科大学とヴェロール工科大学の研究者らが、化粧品ナノ粒子の試験用に3Dプリントされた生体皮膚モデルを開発しました。これらのモデルは安定しており、細胞毒性がなく、皮膚組織を成長させることができ、動物実験に代わる実行可能な選択肢を提供します。
* 2025年2月: 中国国家薬品監督管理局(NMPA)は、2025年2月6日発効の新しい規則を導入し、代替皮膚毒性試験方法を奨励しています。これらの変更は、安全性評価を簡素化し、化粧品市場における非動物試験の迅速な採用を促進します。
皮膚毒性試験市場に関する本レポートは、その包括的な分析を通じて、市場の現状、成長予測、主要な推進要因と阻害要因、そして将来の展望を詳細に示しています。
市場規模は、2025年には23億ドルに達し、2030年までには36.6億ドルに成長すると予測されています。この成長は、主に以下の要因によって推進されています。
第一に、化粧品分野における動物実験の規制強化が進んでおり、特に欧州連合をはじめとする多くの国で動物実験が禁止されています。
第二に、FDA(米国食品医薬品局)やOECD(経済協力開発機構)がin-vitro(生体外)およびin-silico(計算科学)アッセイの承認を加速させている点です。
第三に、バイオプリンティング技術を用いた3Dヒト皮膚モデルの発展が、より生理学的に関連性の高い試験モデルを提供しています。
第四に、AI(人工知能)を活用した高含有イメージング技術が刺激性スクリーニングに導入され、予測精度と効率が向上しています。
第五に、皮膚科用医薬品のパイプラインが増加しており、開発の早期段階での皮膚安全性評価のニーズが高まっています。
最後に、ESG(環境・社会・ガバナンス)への意識の高まりから、クルエルティフリー(動物実験を行わない)製品に対する消費者の需要が増大していることも、市場を牽引する重要な要素となっています。
試験タイプ別では、再構築ヒト表皮を用いたin-vitroモデルが2024年の収益の41.8%を占め、最も大きなシェアを誇っています。また、AIを活用した機械学習プラットフォームは、刺激性予測において最大87.76%のAUROC(受信者操作特性曲線下面積)を達成し、試験期間を数週間から数日に短縮するなど、評価プロセスに革新をもたらしています。
一方、市場の成長を阻害する要因としては、一部のin-vitroアッセイにおけるヒトへの予測相関の限界、3D組織培養プラットフォームの高額な初期投資費用、新興市場における熟練した細胞培養毒性学者の不足、およびグローバルな規制ガイドラインの不調和が挙げられます。特に、GMP(医薬品製造管理および品質管理基準)に準拠したバイオプリンティングインフラの高コストは、中小規模の研究所にとって大きな課題となっています。
エンドユーザー別では、医薬品・バイオテクノロジー企業が年間平均成長率(CAGR)13.6%で最も高い成長を示すと予測されており、これらの企業は非動物試験法(NAMs)の採用を急速に進めています。
地域別では、アジア太平洋地域が13.2%のCAGRで最も急速に成長しています。これは、中国や日本の規制当局が2025年までに非動物試験法を推奨するガイダンスを発表したことが主な要因です。
競争環境においては、Eurofins Scientific、SGS SA、Charles River Laboratories、Labcorp Drug Developmentなど、多数の主要企業が市場に存在し、市場の集中度や各社の市場シェア、製品・サービス、最近の動向などが詳細に分析されています。
本レポートは、市場の機会、将来の展望、未開拓のニーズについても評価しており、皮膚毒性試験市場の全体像を把握し、戦略的な意思決定を行うための重要な情報を提供しています。

1. はじめに
- 1.1 調査の前提と市場の定義
- 1.2 調査範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場概況
- 4.1 市場概要
- 4.2 市場の推進要因
- 4.2.1 化粧品における動物実験の規制禁止
- 4.2.2 FDAおよびOECDによるin vitroおよびin silicoアッセイの承認加速
- 4.2.3 バイオプリントされた3Dヒト皮膚モデルの成長
- 4.2.4 刺激スクリーニングのためのAI対応高含有イメージング
- 4.2.5 増加する皮膚科医薬品パイプラインにおける早期皮膚安全性評価の必要性
- 4.2.6 ESG主導のクルエルティフリー製品要求
- 4.3 市場の阻害要因
- 4.3.1 一部のin vitroアッセイにおけるヒトの結果との予測相関の限定性
- 4.3.2 3D組織培養プラットフォームの高額な初期費用
- 4.3.3 新興市場における熟練した細胞培養毒性学者の不足
- 4.3.4 調和されたグローバルな規制ガイドラインの欠如
- 4.4 サプライチェーン分析
- 4.5 規制状況
- 4.6 技術的展望
- 4.7 ポーターの5つの力分析
- 4.7.1 供給者の交渉力
- 4.7.2 買い手の交渉力
- 4.7.3 新規参入の脅威
- 4.7.4 代替品の脅威
- 4.7.5 競争上の対抗関係
5. 市場規模と成長予測(金額)
- 5.1 試験タイプ別
- 5.1.1 インビトロ(2D & 3D再構築ヒト表皮)
- 5.1.2 インシリコ / 計算
- 5.1.3 エクスビボヒト皮膚
- 5.1.4 インビボ動物
- 5.2 毒性エンドポイント別
- 5.2.1 皮膚刺激性
- 5.2.2 皮膚腐食性
- 5.2.3 皮膚感作性
- 5.2.4 経皮吸収
- 5.2.5 光毒性 & 光アレルギー
- 5.3 エンドユーザー別
- 5.3.1 化粧品・パーソナルケア企業
- 5.3.2 製薬・バイオテクノロジー企業
- 5.3.3 化学・農薬メーカー
- 5.3.4 CROおよび独立毒性試験ラボ
- 5.3.5 学術・政府研究機関
- 5.4 地域別
- 5.4.1 北米
- 5.4.1.1 米国
- 5.4.1.2 カナダ
- 5.4.1.3 メキシコ
- 5.4.2 欧州
- 5.4.2.1 ドイツ
- 5.4.2.2 英国
- 5.4.2.3 フランス
- 5.4.2.4 イタリア
- 5.4.2.5 スペイン
- 5.4.2.6 その他の欧州諸国
- 5.4.3 アジア太平洋
- 5.4.3.1 中国
- 5.4.3.2 日本
- 5.4.3.3 インド
- 5.4.3.4 韓国
- 5.4.3.5 オーストラリア
- 5.4.3.6 その他のアジア太平洋諸国
- 5.4.4 中東 & アフリカ
- 5.4.4.1 GCC
- 5.4.4.2 南アフリカ
- 5.4.4.3 その他の中東・アフリカ諸国
- 5.4.5 南米
- 5.4.5.1 ブラジル
- 5.4.5.2 アルゼンチン
- 5.4.5.3 その他の南米諸国
6. 競合情勢
- 6.1 市場集中度
- 6.2 市場シェア分析
- 6.3 企業プロファイル {(グローバルレベルの概要、市場レベルの概要、主要セグメント、利用可能な財務情報、戦略的情報、主要企業の市場ランク/シェア、製品&サービス、および最近の動向を含む)}
- 6.3.1 Eurofins Scientific
- 6.3.2 SGS SA
- 6.3.3 Charles River Laboratories
- 6.3.4 Labcorp Drug Development (Covance)
- 6.3.5 Intertek Group
- 6.3.6 In-Vitro International
- 6.3.7 MatTek Corporation
- 6.3.8 IIVS -Institute for In-Vitro Sciences
- 6.3.9 SenzaGen AB
- 6.3.10 XCellR8 Ltd
- 6.3.11 MB Research Laboratories
- 6.3.12 BioReliance (Merck KGaA)
- 6.3.13 Cyprotex (Evotec)
- 6.3.14 WuXi AppTec
- 6.3.15 Pacific BioLabs
- 6.3.16 CellSystems Biotechnologie
- 6.3.17 Epithelix Sàrl
- 6.3.18 SkinEthic (L’Oréal)
- 6.3.19 CELLnTec Advanced Cell Systems
- 6.3.20 Phenion
7. 市場機会&将来展望
*** 本調査レポートに関するお問い合わせ ***

皮膚毒性試験は、化学物質や製品が皮膚に接触した際に引き起こす可能性のある有害作用を評価する重要な安全性試験です。具体的には、皮膚刺激性、皮膚腐食性、皮膚感作性(アレルギー性)、光毒性、経皮吸収性などを評価し、ヒトの健康や環境へのリスクを特定します。医薬品、化粧品、化学物質、農薬、医療機器、日用品など、多岐にわたる製品の安全性確保に不可欠であり、消費者保護や作業者の安全衛生管理において極めて重要な役割を担っています。製品の安全な使用条件を確立し、有害事象の発生を未然に防ぐことが目的です。
皮膚毒性試験には、評価する毒性エンドポイントに応じて様々な種類があります。皮膚刺激性試験は、化学物質が皮膚に接触した際に生じる紅斑や浮腫などの可逆的な炎症反応を評価し、再構築ヒト表皮モデルを用いたin vitro試験が広く採用されています。皮膚腐食性試験は、皮膚組織に不可逆的な損傷を引き起こす可能性を評価するもので、これも再構築ヒト表皮モデルを用いたin vitro試験が代替法として確立されています。皮膚感作性試験は、アレルギー性接触皮膚炎を引き起こす可能性を評価し、in vivoのLLNAやGPMTに加え、in chemico/in vitroのDPRA、KeratinoSens、h-CLATなどの非動物試験法が国際的に承認されています。経皮吸収性試験は、皮膚から体内に吸収される物質の量を評価し、全身毒性や標的臓器への影響を予測するために実施されます。in vitroでは、ヒトや動物の皮膚を用いたフランツ拡散セル法が一般的であり、in vivoでは、動物に被験物質を塗布し、血液や尿中の濃度を測定する方法が用いられます。
これらの皮膚毒性試験は、製品開発の初期段階から最終製品の安全性評価に至るまで、様々な段階で実施されます。特に、化粧品や医薬品の開発においては、皮膚への影響が直接的な懸念事項となるため、これらの試験結果は製品の処方設計や使用方法の決定に不可欠です。また、化学物質の登録・評価制度においても、皮膚毒性データはリスク評価の重要な要素となります。近年では、動物福祉の観点から、動物実験代替法の開発と導入が積極的に進められており、in vitro試験やin silico(計算科学)による予測モデルの活用が拡大しています。これにより、より迅速かつ倫理的な安全性評価が可能となり、製品の市場投入までの期間短縮にも貢献しています。