電子治験マスターファイル市場 規模・シェア分析 – 成長トレンド・予測 (2025-2030年)
グローバル電子治験マスターファイル(ETMF)市場は、製品タイプ(ソフトウェア、サービス)、エンドユーザー(製薬・バイオテクノロジー企業、医薬品開発業務受託機関(CRO)、その他)、および地域(北米、欧州、アジア太平洋、世界のその他の地域)によってセグメント化されています。本レポートは、上記セグメントの価値(米ドル)を提供します。

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
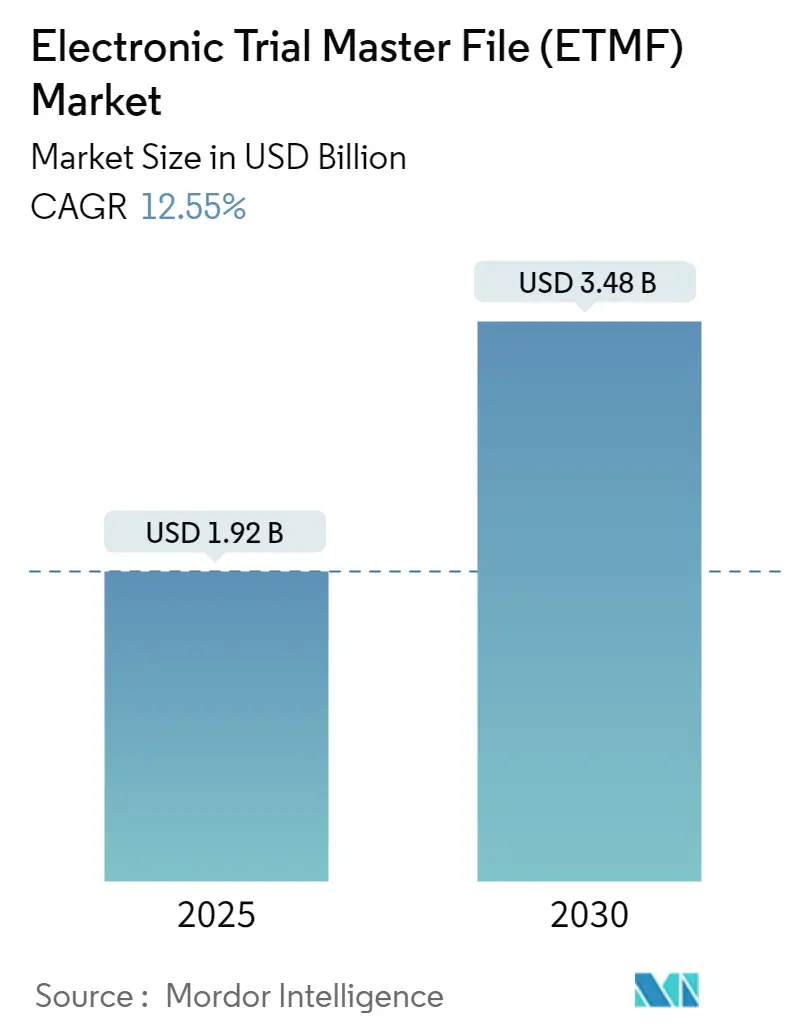
電子治験マスターファイル(ETMF)市場は、2025年に19.2億米ドルと推定され、2030年までに34.8億米ドルに達すると予測されており、予測期間(2025-2030年)中の年平均成長率(CAGR)は12.55%に上ると見込まれています。この市場は、北米が最大の市場であり、アジア太平洋地域が最も急速に成長する市場となるでしょう。市場の集中度は中程度です。
市場概要
ETMFは、臨床試験の文書のセットアップ、収集、保管、追跡、アーカイブを支援するソフトウェアおよびサーバー技術を活用した革新的なアプリケーションです。世界中で臨床試験が増加する中、臨床データを安全に保ち、容易にアクセス・理解できる形式で管理することが不可欠となっています。
COVID-19パンデミックは、世界中で臨床試験の数を急増させました。主要企業はCOVID-19の予防と治療のためのワクチンや治療法の開発に注力し、その結果、臨床試験に関するデータ生成が大幅に増加しました。例えば、clinicaltrials.govの2022年のデータによると、150カ国から8,283件以上の研究が登録されており、これには約777件のワクチン研究と2,155件の薬剤研究が含まれていました。このデータ量の増加に対応するため、パンデミック中に生成された臨床試験データを追跡するためにETMFの利用が増加し、市場の著しい成長を後押ししました。
市場の主要企業による取り組みも成長を促進しています。例えば、2021年4月には、Phlexglobalが、世界のトップ10製薬企業のうち5社を含む多くの製薬企業が、M&Aにおける潜在的な規制リスクを特定し軽減し、査察準備を改善するために、同社の革新的なTMF品質レビューソリューションを利用していると発表しました。
また、ヘルスケア業界は、先進国および発展途上国全体でデジタル化の変革を経験しており、これがETMFのようなソフトウェアの採用を加速させています。Clinicaltrials.govが2022年に発表したデータによると、現在までに全50州と221カ国にわたる約423,514件の臨床試験がリストされています。医療業界における情報技術の採用が進むにつれて、ETMFの利用も増加しています。ETMFは一度インストールすれば複数回再利用できるという利点があり、臨床試験が進展・拡大するにつれて発生する膨大なデータ管理の負担を軽減できます。
主要機関によるイニシアチブも、このような技術の成長に好ましい環境を提供すると期待されています。例えば、米国食品医薬品局(FDA)は2023年3月15日に、「臨床調査における電子システム、電子記録、電子署名:質疑応答(2023年ドラフトガイダンス)」と題するドラフトガイダンスを発行しました。このガイダンスは、電子記録、スポンサーまたはその他の規制対象エンティティが所有または管理する電子システム、情報技術サービスプロバイダーとサービス、デジタルヘルス技術、および電子署名の5つのセクションにわたる質問と回答をまとめています。FDAは、Part 11の狭く実用的な解釈を維持しつつ、追加の考慮事項と推奨事項を通じて、検証に対するリスクベースのアプローチを強化しています。このようなガイドラインは、ETMFのようなプラットフォームへのより良いサポートを提供し、予測期間中の市場成長を促進すると期待されています。
しかし、予算の制約は市場成長を妨げる要因となる可能性があります。したがって、世界的な臨床試験の増加と研究開発活動の活発化により、ETMFの採用が拡大しているため、予測期間中にETMFの需要は増加すると予測されます。一方で、医療提供者や企業の予算制約が市場の成長を抑制する可能性があります。
世界の電子治験マスターファイル(ETMF)市場の動向と洞察
製薬・バイオテクノロジー企業セグメントの著しい成長
製薬・バイオテクノロジー企業セグメントは、研究開発活動への投資増加を主な要因として、市場で著しい成長を示すと予想されています。インドブランドエクイティ財団(IBEF)の2021年報告書によると、2021年には製薬業界に約12.06億米ドルが投資されました。このような巨額の投資は、実施される臨床試験の数を促進し、本市場の推進要因となっています。
さらに、試験数の増加に伴い、患者や薬剤に関するデータを管理するためのETMFシステムが必要とされています。欧州医薬品庁によると、2021年には欧州で37,293件の臨床試験が登録されました。これらの要因が、製薬・バイオ製薬企業におけるETMFシステムの需要を押し上げると予想されます。
また、Biogenが2022年7月に発表した報告書によると、エーザイとBiogenはアルツハイマー病治療薬を開発し、アミロイドと呼ばれるタンパク質の毒性プラークを除去する能力に基づいて迅速承認を求めています。同様に、2022年から2023年にかけて様々な製薬・バイオテクノロジー企業によって複数の臨床試験が計画されており、これらが本市場の推進要因となっています。
北米市場の優位性
北米は、研究開発への投資増加と関連研究の多さから、電子治験マスターファイル(ETMF)市場において支配的な地域であり、予測期間中もその地位を維持すると予想されています。
米国製薬研究製造業者協会(PhRMA)によると、2021年の研究開発費において米国が約58%と最大のシェアを占めました。また、同情報源によると、米国のバイオ製薬企業による研究開発費は約1023億米ドルに達しています。
さらに、2023年4月23日現在、米国では約139,632件の研究が登録されており、この数は2023年4月末までにさらに増加する見込みです。米国だけで登録された研究拠点の31%を占めています。これは、国内で膨大な数の臨床試験が行われていることを示しており、研究者がデータを追跡し、効果的に保存するための適切なツールが必要となるため、本市場にとって有利な状況です。
加えて、米国ではヘルスケア情報技術の採用が進んでおり、毎年臨床試験を通じて生成される膨大なデータの作業を容易にするソフトウェアの需要が高まっています。したがって、米国での試験数が増加するにつれて、国内でのETMFソフトウェアの需要が加速すると考えられています。これらの要因により、本市場は強力なシェアを維持すると考えられています。
競争環境
電子治験マスターファイル(ETMF)市場は中程度の競争があり、Veeva Systems、Aris Global LLC、Master Control, Inc.、Clinevo Technology、Oracle Corporation、Phlexglobal、TransPerfect、Aurea Software、Labcorp (Covance, Inc.)、Sureclinicalなどが主要な企業として知られています。
最近の業界動向
* 2023年2月、臨床研究機関(CRO)であるVialは、Egnyteと提携契約を締結し、EgnyteのライフサイエンスeTMF(電子治験マスターファイル)ソリューションをVialのプラットフォームに統合しました。Egnyte eTMFは、21 CFR Part 11に準拠したプラットフォームであり、文書とデータの処理時間を短縮し、コンプライアンスを維持し、ライフサイエンス企業の監査準備を強化するとされています。
* 2022年9月、Montriumは専門家主導の治験マスターファイル(TMF)サービスと、新しいTMF成熟度教育トレーニングを開始しました。これらの革新的な提供は、臨床開発プロセスのあらゆる段階で臨床運用チームとTMFチームをサポートするように設計されています。
このレポートは、グローバル電子治験マスターファイル(ETMF)市場に焦点を当てた包括的な分析を提供しています。ETMFは、臨床試験に関連する文書、画像、その他のコンテンツを構造的に整理、保存、管理するための重要なシステムであり、治験の効率性、品質、および規制遵守を確保する上で不可欠な役割を果たしています。本報告書では、市場の定義、調査範囲、調査方法論、主要な市場動向、セグメンテーション、競争環境、および将来の機会とトレンドについて詳細に解説しています。
市場の概要として、ETMF市場は堅調な成長を続けています。2024年には市場規模が16.8億米ドルと推定されており、2025年には19.2億米ドルに達すると予測されています。さらに、2025年から2030年の予測期間において、年平均成長率(CAGR)12.55%という高い成長率で拡大し、2030年には34.8億米ドル規模に達すると見込まれています。この顕著な成長は、主にETMFシステムの採用が世界的に増加していること、および製薬・バイオテクノロジー業界における研究開発活動が活発化していることに起因しています。臨床試験の複雑化とデータ量の増大に伴い、効率的な文書管理とリアルタイムでの情報共有の必要性が高まっており、ETMFの導入が加速しています。
市場の成長を促進する主要な要因としては、ETMFシステムの導入拡大と研究開発活動の増加が挙げられます。これらの要因は、臨床試験の管理を最適化し、規制要件への対応を強化する上でETMFが提供する価値を反映しています。一方で、市場の成長を抑制する可能性のある要因として、予算の制約が指摘されています。特に中小規模の企業や新興市場においては、ETMFシステムの導入にかかる初期投資や運用コストが課題となる場合があります。本レポートでは、ポーターのファイブフォース分析を用いて、新規参入の脅威、買い手/消費者の交渉力、サプライヤーの交渉力、代替製品の脅威、および競争の激しさといった側面から市場の競争環境を深く掘り下げて分析しています。
ETMF市場は、製品タイプ、エンドユーザー、および地域という主要なセグメントに分類され、それぞれの市場規模が米ドル建てで提供されています。製品タイプ別では、「サービス」と「ソフトウェア」の二つに大別されます。エンドユーザー別では、「製薬・バイオテクノロジー企業」、「医薬品開発業務受託機関(CRO)」、および「その他のエンドユーザー」に細分化されており、各業界におけるETMFの利用状況が分析されています。地域別では、北米(米国、カナダ、メキシコ)、欧州(ドイツ、英国、フランス、イタリア、スペイン、その他欧州)、アジア太平洋(中国、日本、インド、オーストラリア、韓国、その他アジア太平洋)、および世界のその他の地域にわたる広範な地理的分析が行われています。
地域別の市場動向を見ると、2025年時点では北米がETMF市場において最大の市場シェアを占めると予測されています。これは、同地域における高度な医療インフラ、大規模な製薬企業群、および活発な研究開発投資が背景にあります。一方、アジア太平洋地域は、予測期間(2025年~2030年)において最も高い年平均成長率(CAGR)で成長すると推定されています。この成長は、同地域における臨床試験の増加、医療費支出の拡大、およびデジタル化への投資意欲の高まりによって牽引されると見られています。
競争環境のセクションでは、市場で活動する主要なプレイヤーの詳細な企業プロファイルが提供されています。これには、Veeva Systems、Aris Global LLC、Master Control, Inc.、Clinevo Technology、Oracle Corporation、Phlexglobal、Transperfect、Aurea Software、Labcorp (Covance, Inc.)、Sureclinicalなどが含まれます。これらの企業は、ビジネス概要、財務状況、提供製品と戦略、および最近の事業展開に基づいて分析されており、市場における競争の激しさと主要企業の戦略的ポジショニングが明確にされています。
最後に、本レポートは市場の機会と将来のトレンドについても言及しており、ETMF市場が今後どのように進化していくかについての貴重な洞察を提供しています。全体として、ETMF市場は臨床試験のデジタル変革を推進する重要な要素として、今後も持続的な成長が期待されています。

1. はじめに
- 1.1 調査の前提条件と市場の定義
- 1.2 調査範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場の動向
- 4.1 市場概要
-
4.2 市場の推進要因
- 4.2.1 ETMFシステムの導入増加
- 4.2.2 研究開発活動の増加
-
4.3 市場の阻害要因
- 4.3.1 予算の制約
-
4.4 ポーターの5つの力分析
- 4.4.1 新規参入者の脅威
- 4.4.2 買い手/消費者の交渉力
- 4.4.3 供給者の交渉力
- 4.4.4 代替品の脅威
- 4.4.5 競争の激しさ
5. 市場セグメンテーション (金額別市場規模 – 米ドル)
-
5.1 製品タイプ別
- 5.1.1 サービス
- 5.1.2 ソフトウェア
-
5.2 エンドユーザー別
- 5.2.1 製薬・バイオテクノロジー企業
- 5.2.2 医薬品開発業務受託機関
- 5.2.3 その他のエンドユーザー
-
5.3 地域
- 5.3.1 北米
- 5.3.1.1 米国
- 5.3.1.2 カナダ
- 5.3.1.3 メキシコ
- 5.3.2 ヨーロッパ
- 5.3.2.1 ドイツ
- 5.3.2.2 イギリス
- 5.3.2.3 フランス
- 5.3.2.4 イタリア
- 5.3.2.5 スペイン
- 5.3.2.6 その他のヨーロッパ
- 5.3.3 アジア太平洋
- 5.3.3.1 中国
- 5.3.3.2 日本
- 5.3.3.3 インド
- 5.3.3.4 オーストラリア
- 5.3.3.5 韓国
- 5.3.3.6 その他のアジア太平洋
- 5.3.4 その他の地域
6. 競合情勢
-
6.1 企業プロファイル
- 6.1.1 Veeva Systems
- 6.1.2 Aris Global LLC
- 6.1.3 Master Control, Inc.
- 6.1.4 Clinevo Technology
- 6.1.5 Oracle Corporation
- 6.1.6 Phlexglobal
- 6.1.7 Transperfect
- 6.1.8 Aurea Software
- 6.1.9 Labcorp (Covance, Inc.)
- 6.1.10 Sureclinical
- *リストは網羅的ではありません
7. 市場機会と将来のトレンド
*** 本調査レポートに関するお問い合わせ ***

電子治験マスターファイル(eTMF: electronic Trial Master File)とは、医薬品や医療機器の臨床試験(治験)において発生する、あらゆる文書や記録を電子的に管理・保存するためのシステムまたはリポジトリを指します。治験の計画段階から実施、終了、そしてその後のアーカイブに至るまで、治験のライフサイクル全体にわたる「治験の真実の記録」として機能し、治験の品質、完全性、信頼性、および規制要件への準拠を保証するために不可欠なツールです。従来の紙ベースのTMFが抱えていた物理的な保管スペースの制約、文書の検索や共有の困難さ、紛失リスク、バージョン管理の複雑さといった課題を解決し、治験プロセスの効率化と透明性の向上を目的として導入が進められています。
eTMFに格納される文書は多岐にわたり、その種類によって治験の各フェーズや関係者の役割に応じた分類がなされます。主な構成要素としては、治験実施計画書、同意説明文書、治験薬概要書、治験責任医師・分担医師の履歴書や資格証明書、治験実施医療機関の倫理委員会承認書、契約書、治験薬の製造・供給に関する文書、被験者の同意書、症例報告書(CRF)の最終版、有害事象報告書、監査報告書、査察対応記録などが挙げられます。これらの文書は、ICH-GCP(医薬品規制調和国際会議のGCPガイドライン)や各国の規制要件(例:FDA 21 CFR Part 11)に準拠し、その真正性、完全性、機密性、および利用可能性が確保される必要があります。eTMFシステムは、これらの要件を満たすための厳格なアクセス管理、監査証跡(Audit Trail)機能、バージョン管理機能などを備えています。
eTMFの主な用途は、治験文書の一元管理とリアルタイムな進捗管理にあります。治験依頼者、CRO(医薬品開発業務受託機関)、治験実施医療機関など、治験に関わる全ての関係者が、場所を問わず安全に文書にアクセスし、共同作業を行うことを可能にします。これにより、文書の提出状況、レビュー状況、承認状況をリアルタイムで把握し、治験の進捗を可視化することができます。また、ICH-GCPや規制要件への準拠を支援し、文書の品質管理とコンプライアンスを強化します。特に、監査や査察の際には、要求された文書を迅速かつ正確に提示できるため、査察準備や対応にかかる時間と労力を大幅に削減し、効率的な対応を可能にします。治験終了後の文書の長期保存とアーカイブも効率的に行われ、将来的な参照や再利用に備えることができます。
eTMFは、他の治験関連システムと密接に連携することで、その価値を最大化します。例えば、症例報告書データを電子的に収集・管理するEDC(Electronic Data Capture)システムとは、CRFの最終版やデータマネジメント計画書などの関連文書をeTMFで管理する形で連携します。治験のプロジェクト管理、進捗管理、予算管理を行うCTMS(Clinical Trial Management System)とは、文書のステータスや関連情報を共有し、治験全体の効率的な運営を支援します。また、治験実施医療機関側で管理される文書を電子化したeISF(Electronic Investigator Site File)は、eTMFの一部として、あるいは連携して機能することがあります。近年では、文書の自動分類、メタデータ抽出、品質チェックなどにAIや機械学習の技術が応用され始めており、文書管理のさらなる効率化が期待されています。文書の真正性や改ざん防止、監査証跡の信頼性向上にはブロックチェーン技術の応用も検討されており、多くのeTMFシステムはクラウドコンピューティングを基盤として提供され、スケーラビリティ、アクセシビリティ、コスト効率を高めています。文書の承認プロセスにおいては、法的有効性を持つ電子署名が不可欠な技術として活用されています。
eTMFの市場背景としては、まずICH-GCP E6(R2)などの改訂により、治験の品質管理とリスクベースドアプローチが重視され、文書管理の重要性が増している点が挙げられます。治験のグローバル化と複雑化も、複数の国や地域で実施される治験における文書の共有と管理の必要性を高めています。医薬品開発プロセス全体のデジタルトランスフォーメーション(DX)推進の中で、eTMFはその中核をなす要素の一つとして位置づけられています。また、紙ベースの文書管理にかかるコスト(印刷、保管、輸送、検索)と時間、人的リソースを削減し、治験全体の効率を高めたいというニーズも高まっています。特に、COVID-19パンデミックの影響により、リモートワークやリモートモニタリングの必要性が加速し、デジタル文書管理システムの導入が一段と進みました。
将来展望として、eTMFはEDC、CTMS、RTSM(Randomization and Trial Supply Management)など他の治験関連システムとさらに密接に統合され、治験プロセス全体をカバーする単一のプラットフォームへと進化していくと予想されます。AIや自動化技術の進展により、文書の自動分類、メタデータ付与、品質チェック、規制要件とのギャップ分析など、AIによる自動化機能が強化され、人間の介入を最小限に抑える方向へ進むでしょう。文書のステータスや品質に関するリアルタイムの洞察を提供し、リスクベースドアプローチに基づくモニタリングをさらに支援する機能も強化される見込みです。ユーザーエクスペリエンスの向上も重要な要素であり、直感的で使いやすいインターフェース、モバイル対応の強化などにより、治験関係者の利便性が向上すると考えられます。ブロックチェーン技術の本格的な導入により、文書の真正性、監査証跡の透明性、データ共有のセキュリティがさらに高まる可能性もあります。将来的には、規制当局がeTMFシステムに直接アクセスして査察を行うような、より効率的な査察モデルが登場することも考えられます。文書の種類やメタデータの標準化も進み、異なるシステム間での互換性やデータ交換がよりスムーズになることが期待されています。これらの進化により、eTMFは治験の品質、効率、透明性を一層向上させるための中心的な役割を担い続けるでしょう。