非ヒト霊長類用ゲノム編集ツール市場:市場規模・シェア分析、成長動向と予測 (2025-2030年)
非ヒト霊長類向け遺伝子編集ツール市場レポートは、業界をテクノロジー別(CRISPR/Cas9、転写活性化因子様エフェクターヌクレアーゼ(TALENs)、ジンクフィンガーヌクレアーゼ(ZFNs)、その他)、用途別(医学生物学研究、トランスジェニックモデル開発、医薬品開発、遺伝子治療研究)、エンドユーザー別(研究機関など)、および地域別に分類しています。

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
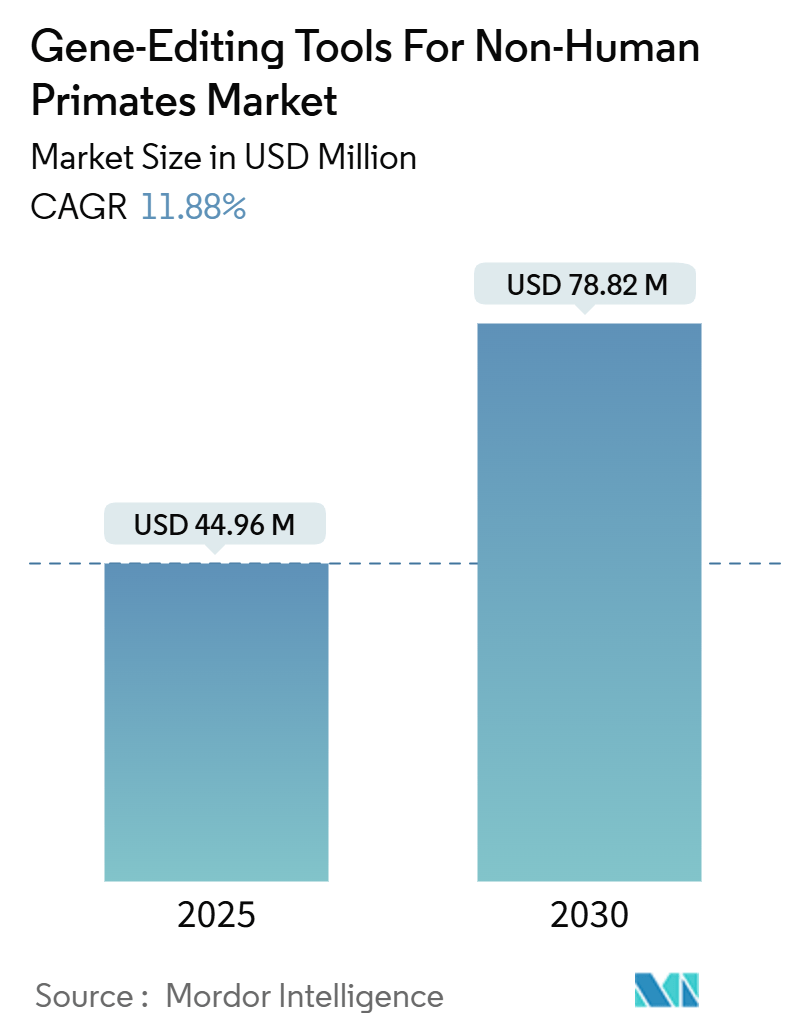
「非ヒト霊長類向け遺伝子編集ツール市場予測2030」と題された本レポートは、非ヒト霊長類向け遺伝子編集ツール市場の詳細な分析を提供しています。調査期間は2020年から2030年で、市場規模は2025年に4,496万米ドルと推定され、2030年には7,882万米ドルに達すると予測されており、予測期間(2025年~2030年)における年平均成長率(CAGR)は11.88%です。
市場は、テクノロジー(CRISPR/Cas9、転写活性化因子様エフェクターヌクレアーゼ(TALENs)、ジンクフィンガーヌクレアーゼ(ZFNs)、その他)、アプリケーション(生物医学研究、トランスジェニックモデル開発、医薬品開発、遺伝子治療研究)、エンドユーザー(研究機関など)、および地域に分類されています。北米が最大の市場であり、アジア太平洋地域が最も急速に成長する市場とされています。市場の集中度は中程度です。
この市場を牽引する主な要因は、遺伝子編集技術の進歩、バイオテクノロジー研究への投資の増加、個別化医療への需要の高まり、遺伝性疾患の有病率の増加、および主要企業による戦略的活動の活発化です。例えば、鎌状赤血球症や嚢胞性線維症といった遺伝性疾患の有病率が高まるにつれて、これらの疾患を研究するための効果的な動物モデルの需要が増加しています。非ヒト霊長類はヒトと遺伝的・生理学的に類似しているため、新規遺伝子治療法の開発と試験において極めて重要であり、これが市場を牽動しています。嚢胞性線維症財団の2024年1月更新データによると、2023年には米国で約4万人の小児および成人が嚢胞性線維症を患っており、このような遺伝性疾患の蔓延が、新規治療法開発のための非ヒト霊長類における遺伝子ツールの利用を促進しています。
さらに、新規医薬品開発のための遺伝子ツールへの投資増加も市場を牽引しています。例えば、2024年10月には、米国国立衛生研究所(NIH)がペンシルベニア大学ペレルマン医学部(Penn)とフィラデルフィア小児病院(CHOP)における希少代謝性疾患(尿素サイクル異常症)の遺伝子編集治療法に対し、1,400万米ドルの資金を提供しました。これは、非ヒト霊長類における遺伝子編集ツールの利用を増加させると期待されています。また、遺伝子編集分野における研究活動の増加も市場成長に寄与しており、2023年10月にはPrime Medicine, Inc.が、非ヒト霊長類(NHP)およびマウスモデルにおいて、肝臓を標的としたプライムエディターがグリコーゲン貯蔵病1b(GSD1b)の最も一般的な疾患原因変異の一つを効率的かつ正確に修正する能力を示す前臨床データを発表しました。
しかし、非ヒト霊長類の使用に関する倫理的懸念が、予測期間中の市場成長を抑制する可能性があります。
市場トレンドと洞察
CRISPR/Cas9セグメントが予測期間中に大きな市場シェアを占めると予想されます。
CRISPR-Cas9は、ゲノムの一部を編集し、DNA配列のセクションを除去、追加、または変更することを可能にする独自の技術です。このセグメントの成長を牽引する主な要因は、CRISPR/Cas9技術への投資の増加と、市場の主要企業による戦略的活動です。CRISPR-Cas9技術の臨床応用が増加することで、様々な疾患の効率的な理解と新規医薬品開発への需要が高まり、セグメントを牽引しています。例えば、2024年8月にRetrovirology誌に掲載された記事によると、CRISPR-Cas9遺伝子編集技術は、非ヒト霊長類(NHP)HIVモデルを明確にし、HIV複製に影響を与える遺伝的要因を調査し、HIV感染に対する遺伝的障壁を利用する細胞療法(CCR5への変異導入など)を設計する機会を提供しています。
さらに、主要企業による製品発売などの戦略的活動の増加も、非ヒト霊長類におけるCRISPR-Cas9技術を用いた遺伝子編集分野の研究活動を加速させ、市場を牽引しています。2023年12月には、Vertex社とCRISPR Therapeutics社が、鎌状赤血球症(SCD)および輸血依存性βサラセミア(TDT)の治療薬として、CRISPR/Cas9遺伝子編集療法であるCASGEVY(exagamglogene autotemcel)が英国医薬品医療製品規制庁(MHRA)から承認されたと報告しました。
北米が予測期間中に大きな市場シェアを占めると予想されます。
北米の非ヒト霊長類向け遺伝子編集ツール市場は、高度な研究インフラ、遺伝性疾患の有病率の上昇、個別化医療への関心の高まり、遺伝子編集ツールの技術進歩、および主要企業による戦略的活動の活発化といった要因によって牽引されています。遺伝子編集技術における技術進歩の高まりは、様々な研究目的でのこの技術の利用可能性を高め、市場を牽引しています。例えば、2023年12月、バイオテクノロジーのスタートアップ企業であるTome Biosciences社は、Arch Venture Partners、GV、Longwood Fundから2億1,300万米ドルのベンチャー資金を調達しました。この資金は、マサチューセッツ工科大学からライセンス供与された研究に基づき、DNAを損傷することなくゲノムのどこにでも様々なサイズの遺伝物質を挿入できる新しい遺伝子編集技術「プログラム可能なゲノム統合(PGI)」の開発に充てられました。
さらに、主要企業による新規製品の発売などの戦略的活動の増加も市場を牽引しています。2024年5月、中枢神経系(CNS)疾患の新規遺伝子治療候補を開発するバイオテクノロジー企業Latus Bio, Inc.は、シリーズA資金調達で5,400万米ドルの初期クローズを発表し、事業を開始しました。Latus社の独自技術は、非ヒト霊長類で直接、新規AAVカプシドの並行かつ偏りのないスクリーニングを可能にします。これらの前臨床NHPモデルにおいて、Latus社のカプシド変異体は、標的細胞特異性を持ち、オフターゲット組織活性が最小限または皆無で、正確なCNS部位で高い遺伝子発現を示しました。
競争環境
非ヒト霊長類向け遺伝子編集ツール市場は、多くのグローバルおよび地域プレーヤーが存在するため、半統合型です。市場の主要企業は、合併、コラボレーション、新規ソリューション開発のための資金調達など、様々な戦略的活動を採用しています。市場の主要プレーヤーには、Editas Medicine、Intellia Therapeutics、Cellectis、Regeneron Pharmaceuticals、Sangamo Therapeuticsなどが含まれます。
最近の業界動向
2024年1月には、プログラム可能なゲノム統合(PGI)を専門とするTome Biosciences, Inc.が、小規模DNA配列の正確な挿入および削除のための革新的なPGI手法の開発に焦点を当てた非公開バイオテクノロジー企業Replace Therapeutics Inc.を買収しました。Replace社の技術は、CRISPR/Cas9の部位特異的精度とDNAリガーゼ酵素の書き込み能力を活用しています。
2023年11月には、Vertex Pharmaceuticals IncorporatedとCRISPR Therapeuticsが、英国医薬品医療製品規制庁(MHRA)が、鎌状赤血球症(SCD)および輸血依存性βサラセミア(TDT)の治療薬として、CRISPR/Cas9遺伝子編集療法であるCASGEVY(exagamglogene autotemcel [exa-cel])に条件付き販売承認を与えたと報告しました。
本レポートは、「非ヒト霊長類向け遺伝子編集ツール市場」に関する詳細な分析を提供しています。遺伝子編集とは、細胞や生物のゲノムにおいてDNAを挿入、削除、改変、または置換する遺伝子工学の一種です。この技術は、非ヒト霊長類に新たな特性を導入したり、特定のゲノム領域を除去してヒト疾患研究に適したモデルを提供するために活用されています。
市場規模は、2024年には3,962万米ドルと推定されており、2025年には4,496万米ドルに達すると予測されています。さらに、2025年から2030年にかけて年平均成長率(CAGR)11.88%で力強く成長し、2030年には7,882万米ドルに達すると見込まれております。
市場の成長を牽引する主な要因としては、遺伝子編集技術の継続的な進歩と、バイオテクノロジー研究への投資増加が挙げられます。これらの要因が、非ヒト霊長類を用いた研究の需要を高めています。一方で、非ヒト霊長類の使用に関する倫理的懸念が、市場の成長を抑制する可能性のある要因として指摘されています。また、本レポートではポーターのファイブフォース分析も実施されており、新規参入の脅威、買い手の交渉力、サプライヤーの交渉力、代替品の脅威、競争の激しさといった側面から、市場の競争環境が詳細に評価されています。
市場は、技術、アプリケーション、エンドユーザー、および地域という主要なセグメントに基づいて詳細に分析されています。
技術別では、CRISPR/Cas9、転写活性化因子様エフェクターヌクレアーゼ(TALENs)、ジンクフィンガーヌクレアーゼ(ZFNs)、およびその他の技術に分類されます。
アプリケーション別では、生物医学研究、トランスジェニックモデル開発、医薬品開発、遺伝子治療研究が主要な分野として挙げられています。
エンドユーザー別では、研究機関とバイオテクノロジー企業が主な市場参加者です。
地域別では、北米、ヨーロッパ、アジア太平洋、中東・アフリカ、南米に区分され、世界の主要地域にわたる17カ国の市場規模とトレンドが推定されています。特に、2025年には北米が最大の市場シェアを占めると予測されており、アジア太平洋地域は予測期間(2025年~2030年)において最も高いCAGRで成長すると見込まれております。
競争環境のセクションでは、市場で活動する主要企業のプロファイルが提供されています。主な企業には、Editas Medicine、Intellia Therapeutics、CRISPR Therapeutics、Cellectis、Caribou Biosciences、Regeneron Pharmaceuticals、Sangamo Therapeutics、Precision BioSciences、Beam Therapeutics、Abeona Therapeutics、Spark Therapeutics、Bluebird Bioなどが挙げられます。これらの企業は、事業概要、財務状況、製品と戦略、最近の動向に基づいて詳細に分析されており、市場における各社の位置付けが明確にされています。
本レポートはまた、市場の機会と将来のトレンドについても言及しており、今後の市場発展の方向性や潜在的な成長分野に関する洞察を提供しています。

1. はじめに
- 1.1 調査の前提条件と市場の定義
- 1.2 調査範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場の動向
- 4.1 市場概要
-
4.2 市場促進要因
- 4.2.1 遺伝子編集技術の進歩
- 4.2.2 バイオテクノロジー研究への投資増加
-
4.3 市場抑制要因
- 4.3.1 ヒト以外の霊長類の使用に関する倫理的懸念
-
4.4 ポーターの5つの力分析
- 4.4.1 新規参入の脅威
- 4.4.2 買い手/消費者の交渉力
- 4.4.3 供給者の交渉力
- 4.4.4 代替品の脅威
- 4.4.5 競争の激しさ
5. 市場セグメンテーション (金額別市場規模 – 米ドル)
-
5.1 テクノロジー別
- 5.1.1 CRISPR/Cas9
- 5.1.2 転写活性化因子様エフェクターヌクレアーゼ (TALENs)
- 5.1.3 ジンクフィンガーヌクレアーゼ (ZFNs)
- 5.1.4 その他
-
5.2 用途別
- 5.2.1 生体医科学研究
- 5.2.2 遺伝子組み換えモデル開発
- 5.2.3 医薬品開発
- 5.2.4 遺伝子治療研究
-
5.3 エンドユーザー別
- 5.3.1 研究機関
- 5.3.2 バイオテクノロジー企業
-
5.4 地域別
- 5.4.1 北米
- 5.4.1.1 アメリカ合衆国
- 5.4.1.2 カナダ
- 5.4.1.3 メキシコ
- 5.4.2 ヨーロッパ
- 5.4.2.1 ドイツ
- 5.4.2.2 イギリス
- 5.4.2.3 フランス
- 5.4.2.4 イタリア
- 5.4.2.5 スペイン
- 5.4.2.6 その他のヨーロッパ
- 5.4.3 アジア太平洋
- 5.4.3.1 中国
- 5.4.3.2 日本
- 5.4.3.3 インド
- 5.4.3.4 オーストラリア
- 5.4.3.5 韓国
- 5.4.3.6 その他のアジア太平洋
- 5.4.4 中東およびアフリカ
- 5.4.4.1 GCC
- 5.4.4.2 南アフリカ
- 5.4.4.3 その他の中東およびアフリカ
- 5.4.5 南米
- 5.4.5.1 ブラジル
- 5.4.5.2 アルゼンチン
- 5.4.5.3 その他の南米
6. 競合情勢
-
6.1 企業プロファイル
- 6.1.1 エディタス・メディシン
- 6.1.2 インテリシア・セラピューティクス
- 6.1.3 CRISPRセラピューティクス
- 6.1.4 セレクティス
- 6.1.5 カリブー・バイオサイエンス
- 6.1.6 リジェネロン・ファーマシューティカルズ
- 6.1.7 サンガモ・セラピューティクス
- 6.1.8 プレシジョン・バイオサイエンス
- 6.1.9 ビーム・セラピューティクス
- 6.1.10 アベオナ・セラピューティクス
- 6.1.11 スパーク・セラピューティクス
- 6.1.12 ブルーバード・バイオ
- *リストは網羅的ではありません
7. 市場機会と将来のトレンド
*** 本調査レポートに関するお問い合わせ ***

非ヒト霊長類用ゲノム編集ツールとは、サルやマーモセットといった非ヒト霊長類のゲノム(全遺伝情報)を、特定の目的のために正確に改変する技術やそのために用いられる分子生物学的ツール群を指します。これらのツールは、遺伝子の特定部位を切断したり、塩基を置換したり、新たな遺伝子を挿入したりすることで、生物の遺伝的特性を操作することを可能にします。非ヒト霊長類は、ヒトと生理学的、遺伝学的、行動学的に高い類似性を持つため、ヒトの疾患メカニズムの解明や治療法開発において、非常に重要なモデル動物として位置づけられています。ゲノム編集技術を非ヒト霊長類に応用することで、ヒトの複雑な疾患をより忠実に再現したモデル動物を作製し、その病態生理を詳細に解析したり、新たな治療戦略を評価したりすることが可能になります。
この分野で主に用いられるゲノム編集技術には、いくつかの種類があります。最も広く普及しているのは、CRISPR/Cas9(クリスパー・キャスナイン)システムです。これは、ガイドRNAと呼ばれる短いRNA分子が標的DNA配列を認識し、Cas9酵素がその部位を切断するというメカニズムに基づいています。CRISPR/Cas9は、その簡便性、高い編集効率、そして複数の遺伝子を同時に編集できる多重編集能力から、非ヒト霊長類研究において革命的な進歩をもたらしました。しかし、標的以外の部位を切断してしまう「オフターゲット効果」が課題となることもあります。次に、TALEN(Transcription Activator-Like Effector Nucleases)は、特定のDNA配列に結合するタンパク質ドメインと、DNAを切断するヌクレアーゼを組み合わせた人工酵素です。CRISPR/Cas9に比べて設計や作製に手間がかかるものの、高い特異性を持つことが特徴です。さらに、ZFN(Zinc Finger Nucleases)は、亜鉛フィンガーと呼ばれるDNA結合ドメインとヌクレアーゼを組み合わせた、ゲノム編集技術の初期に開発されたツールです。ZFNも高い特異性を持ちますが、設計の難しさやコストの高さから、現在ではCRISPR/Cas9が主流となっています。近年では、特定の塩基を別の塩基に直接変換する「ベース編集」や、より長いDNA配列を正確に挿入・置換できる「プライム編集」といった次世代のゲノム編集技術も開発されており、非ヒト霊長類への応用が期待されています。
非ヒト霊長類用ゲノム編集ツールの用途は多岐にわたります。最も重要な用途の一つは、ヒトの疾患モデルの作製です。例えば、アルツハイマー病、パーキンソン病、自閉症スペクトラム障害、統合失調症、HIV感染症、がんなどの複雑な疾患において、原因遺伝子を改変することで、ヒトの病態をより正確に再現したモデル動物を作製し、その発症メカニズムや進行過程を詳細に解析することが可能になります。これにより、疾患の根本的な理解が深まり、新たな診断法や治療法の開発に繋がります。また、遺伝子治療の研究においても重要な役割を果たします。疾患の原因となる遺伝子を修正したり、治療効果を持つ遺伝子を導入したりする技術の安全性と有効性を、ヒトに近いモデルで評価することができます。基礎生物学研究においては、特定の遺伝子の機能をノックアウト(破壊)したり、ノックイン(挿入)したりすることで、発生、分化、神経機能、免疫応答など、様々な生命現象における遺伝子の役割を解明するために利用されます。さらに、創薬研究においては、ゲノム編集された非ヒト霊長類モデルを用いて、新規薬剤のスクリーニング、薬効評価、安全性・毒性評価を行うことで、より効率的かつ正確な医薬品開発に貢献しています。
関連技術としては、まず生殖補助医療技術が挙げられます。ゲノム編集された胚を非ヒト霊長類の体内に移植し、個体として発生させるためには、体外受精や胚操作、核移植といった高度な技術が不可欠です。これらの技術は、ゲノム編集された遺伝子改変動物を効率的に作製するために重要な役割を果たします。次に、iPS細胞(人工多能性幹細胞)技術も密接に関連しています。非ヒト霊長類由来のiPS細胞を樹立し、これにゲノム編集を施すことで、in vitro(試験管内)での細胞レベルの研究が可能になります。さらに、ゲノム編集されたiPS細胞を分化誘導して特定の組織や細胞を作製し、疾患モデルとして利用したり、キメラ動物作製に応用したりする研究も進められています。また、ゲノム編集の効果や疾患モデルの表現型を詳細に解析するためには、MRI、PET、CTスキャンといった高度なイメージング技術や、光学顕微鏡、電子顕微鏡などの細胞・組織観察技術が不可欠です。加えて、ゲノム、トランスクリプトーム、プロテオーム、メタボロームといった「オミクス解析」技術を用いることで、ゲノム編集が生物全体に与える影響や、疾患メカニズムを多角的に、網羅的に評価することが可能になります。
市場背景としては、CRISPR/Cas9の登場以来、非ヒト霊長類を用いたゲノム編集研究は世界中で急速に活発化しています。特に、米国、欧州、日本、中国などの先進国において、大学、国立研究機関、製薬企業、バイオベンチャーがこの分野の研究開発を牽引しています。政府からの研究費助成や、ベンチャーキャピタルからの投資も活発であり、技術開発と応用研究の両面で大きな期待が寄せられています。しかし、非ヒト霊長類を用いた研究は、倫理的・社会的な課題も抱えています。動物福祉への配慮、研究の透明性の確保、そしてヒトへの応用に関する議論は常に重要視されており、各国で動物実験に関する厳格な法規制やゲノム編集技術の利用ガイドラインが設けられています。これらの規制やガイドラインを遵守しつつ、研究の必要性と動物福祉のバランスを取りながら、社会の理解を得て研究を進めることが求められています。
将来展望としては、ゲノム編集技術のさらなる高度化が期待されます。オフターゲット効果のさらなる低減、編集効率の向上、そしてより精密な遺伝子改変を可能にする次世代技術(ベース編集、プライム編集など)の普及により、非ヒト霊長類モデルの作製はより正確かつ効率的になるでしょう。これにより、これまで再現が困難であった複雑な多因子疾患や、遺伝子と環境要因の相互作用が関わる疾患のモデル化も進む可能性があります。また、新たな応用分野として、宇宙生物学研究における環境適応メカニズムの解明や、絶滅危惧種の保全に向けた研究など、幅広い分野での活用が期待されています。倫理的議論は今後も深化し、研究の必要性と動物福祉のバランス、そして社会受容性の向上に向けた対話が不可欠となるでしょう。国際的な協力体制を構築し、研究の標準化や倫理ガイドラインの共有を進めることで、責任ある研究開発が推進されることが望まれます。最終的には、ゲノム編集非ヒト霊長類モデルから得られた知見が、ヒトの難病に対する画期的な診断法や治療法の開発へと橋渡しされ、人類の健康と福祉に大きく貢献することが期待されています。