ヒトES細胞市場 規模・シェア分析 – 成長トレンドと予測 (2025年~2030年)
ヒトES細胞市場レポートは、用途別(再生医療、幹細胞生物学研究、組織工学、毒性試験)、製品タイプ別(hESC株、培養培地・試薬、機器・消耗品)、および地域別(北米、欧州、アジア太平洋、中東・アフリカ、南米)に分類されます。市場予測は、金額(米ドル)で提供されます。

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
ヒト胚性幹細胞市場の概要
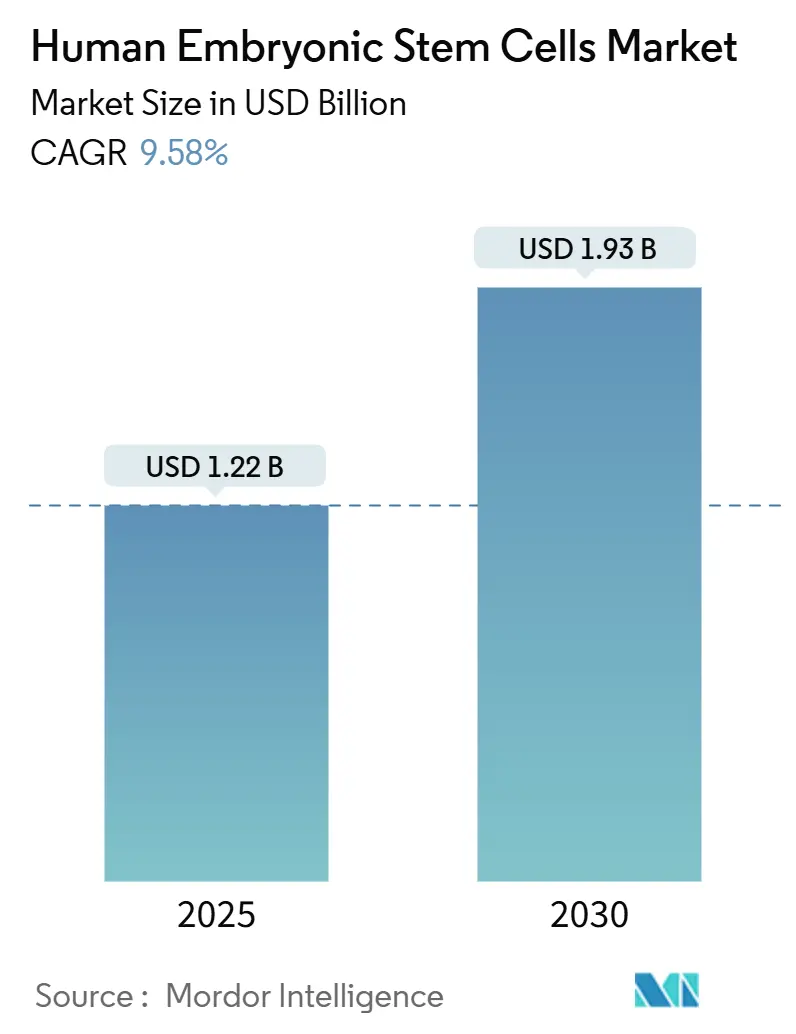
ヒト胚性幹細胞(hESC)市場は、2025年には12.2億米ドルと推定され、2030年までに19.3億米ドルに達し、予測期間(2025年~2030年)中に年平均成長率(CAGR)9.58%で成長すると予測されています。この市場は、再生医療、幹細胞生物学研究、組織工学、毒性試験といったアプリケーション、およびhESCライン、培養培地・試薬、機器・消耗品といった製品タイプにセグメント化されています。地域別では北米が最大の市場であり、アジア太平洋地域が最も急速に成長すると見込まれています。
# 市場の全体的な動向
CRISPR技術による細胞株工学の進展、倫理的に調達された余剰体外受精(IVF)胚の着実な増加、そしてゼノフリーGMP培養システムの商業的利用可能性が、心臓、網膜、内分泌疾患など、幅広い治療領域における可能性を拡大しています。自動化されたクローズドシステムによるバイオプロセシングは、汚染リスクを低減し、バッチ処理能力を倍増させることで、産業界での採用を促進し、市場における先行企業の競争力を高めています。FDAのRMATパスウェイや日本の迅速承認制度に代表される規制当局の支援は、臨床から市場投入までの期間を短縮し、多額の資金流入を促しています。また、遺伝子編集のパイオニアと製造スペシャリスト間の分野横断的な協力は、開発サイクルを短縮し、知的財産権の防御範囲を広げています。倫理的活動の高まりやコスト圧力は引き続き注視すべき点ですが、技術主導の生産性向上により、短期的な逆風は相殺される見込みです。
# 主要なレポートのポイント
* アプリケーション別: 再生医療が2024年にヒト胚性幹細胞市場の58.57%を占め、幹細胞生物学研究は2030年までに10.86%のCAGRで進展すると予測されています。
* 製品タイプ別: hESCラインが2024年に市場規模の53.12%を占め、培養培地および試薬は2025年から2030年の間に11.69%のCAGRで拡大すると予測されています。
* 地域別: 北米が2024年に42.16%の収益シェアで市場をリードし、アジア太平洋地域は2030年までに11.41%のCAGRで最も速い成長を遂げると予測されています。
# 市場のトレンドと洞察:成長要因
市場の成長を牽引する主な要因は以下の通りです。
* 心臓病および悪性疾患の高い有病率: 世界的に心血管疾患と癌が死亡原因の大部分を占めており、多系統修復ソリューションに対する持続的な臨床需要を生み出しています。hESC由来の心臓スフェロイドは、ブタの梗塞モデルで収縮性を回復させ、ヒトでの虚血性心筋症治験に入っています。hESC由来の膵島細胞(VX-880)は、12人の1型糖尿病患者のうち10人でインスリン非依存性を達成し、幅広い応用可能性を示しています。心臓ケアへの人口レベルの支出が3,500億米ドルを超える中、心臓代謝プログラムは市場における主要な価値ドライバーとして位置づけられています。
* 再生医療への需要増加: 米国で1,200件以上の細胞・遺伝子治療治験が進行中であることは、再生医療が最先端医療へと移行していることを示しています。hESCに依存する同種異系プラットフォームは、既製の投与を可能にし、自家治療の歴史的な規模の限界を解決します。日本の60件以上のiPS細胞研究は、一貫した政策、償還の明確化、製造インセンティブが採用を加速させる方法を示しています。
* 政府および民間資金プログラムの拡大: 米国ではCIRMの50億米ドルの基金が、トランスレーショナル研究のための豊富な資金環境を支えています。公的助成金は初期研究のリスクを低減し、ベンチャーキャピタルや戦略的製薬パートナーシップを市場に呼び込んでいます。日本の条件付き承認制度は、国が支援するインフラ投資を補完し、グローバル企業がより迅速な市場参入のために東京近郊にGMP施設を設置するよう促しています。
* CRISPRを活用したhESCライン工学: CRISPRプライム編集は、多能性細胞において36~73%のオンターゲット効率を達成し、同質遺伝子疾患モデルや低免疫原性治療ラインの迅速な構築を可能にします。Cas12aマルチプレックスシステムは、複数の編集の同時挿入を可能にし、候補スクリーニングサイクルを加速させます。ユニバーサルドナー細胞の可能性も示されています。
* ゼノフリーGMP培養システムによる汚染リスクの低減: ゼノフリーGMP培養システムは、汚染リスクを低減し、製品の安全性と信頼性を向上させることで、市場の成長を促進しています。
* 余剰IVF胚による倫理的なhESC供給の拡大: 倫理的に調達可能な余剰体外受精(IVF)胚の供給拡大は倫理的に調達可能な余剰体外受精(IVF)胚の供給拡大は、研究および治療用途におけるヒトES細胞の利用を促進し、倫理的懸念を軽減する上で重要な役割を果たしています。これらの進展は、日本が再生医療分野、特に幹細胞治療において世界的なリーダーとしての地位を確立するための強固な基盤を築いています。政府の支援、革新的な技術、そして倫理的な枠組みが一体となり、患者への新しい治療法の提供を加速させています。
ヒト胚性幹細胞(hESC)は、胚盤胞の内部細胞塊から抽出される多能性幹細胞であり、様々な疾患の治療に利用される重要な分野です。本レポートは、このヒト胚性幹細胞市場について、その研究仮定、市場定義、および調査範囲を明確にしています。市場は、用途別(再生医療、幹細胞生物学研究、組織工学、毒性試験)、製品タイプ別(hESC株、培養培地・試薬、機器・消耗品)、および地域別(北米、欧州、アジア太平洋、中東・アフリカ、南米)に詳細に分析されています。
市場規模は、2025年には12.2億米ドルに達すると予測されており、2030年までには年平均成長率(CAGR)9.58%で着実に拡大し、19.3億米ドルに達すると見込まれています。
市場の成長を牽引する主な要因としては、心臓疾患や悪性疾患の高い罹患率、再生医療への需要の高まりが挙げられます。また、政府および民間による資金提供プログラムの増加、CRISPR技術を活用したhESC株の工学的な改良、汚染リスクを低減するゼノフリーGMP培養システムの導入、そして余剰な体外受精(IVF)胚による倫理的なhESC供給の拡大も、市場を後押ししています。
一方で、市場の成長を阻害する要因も存在します。高額な治療費と生産コスト、世界的に厳格かつ多様な規制、急速に成長しているiPSC(人工多能性幹細胞)代替品による資金の競合、そしてソーシャルメディアを介した倫理的活動が普及を妨げている点が挙げられます。特に、GMP製造コストは1回あたりの投与量を10万米ドル以上に押し上げており、主要なコスト障壁となっていますが、AIを活用した自動化により生産費用を最大50%削減できる可能性も示されています。
用途別では、再生医療が2024年に58.57%の最大収益シェアを占めており、心臓、網膜、内分泌プログラムの進展に支えられています。地域別では、アジア太平洋地域が2030年までに11.41%のCAGRで最も速い成長を遂げると予測されています。これは、日本の迅速な承認プロセスと中国の研究インフラの拡大が主な要因です。
技術面では、CRISPRプライム編集技術が36~73%の高い編集効率を実現し、低免疫原性のユニバーサルドナー細胞株や高精度な疾患モデルの開発を可能にし、臨床応用を加速させています。
競争環境においては、Astellas Pharma Inc.、Thermo Fisher Scientific Inc.、Merck KGaA、Takara Bio Inc.など、多数の主要企業が市場に参入しており、市場集中度、戦略的動向、市場シェア分析、および各企業の詳細なプロファイルが本レポートで提供されています。本レポートは、市場の機会と将来の展望についても言及しており、未開拓の領域や満たされていないニーズの評価を通じて、今後の発展の可能性を探っています。

1. はじめに
- 1.1 調査の前提と市場の定義
- 1.2 調査範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場概況
- 4.1 市場概要
-
4.2 市場の推進要因
- 4.2.1 心臓病および悪性疾患の高い有病率
- 4.2.2 再生医療への需要の高まり
- 4.2.3 政府および民間資金提供プログラムの増加
- 4.2.4 CRISPRによるhESC株の工学
- 4.2.5 キセノフリーGMP培養システムによる汚染リスクの低減
- 4.2.6 余剰IVF胚による倫理的なhESC供給の拡大
-
4.3 市場の阻害要因
- 4.3.1 高い治療費と生産コスト
- 4.3.2 厳格かつ多様な国際規制
- 4.3.3 急成長するiPSC代替品による資金の奪い合い
- 4.3.4 ソーシャルメディア主導の倫理的活動が採用を抑制
- 4.4 規制環境
- 4.5 技術的展望
-
4.6 ポーターのファイブフォース
- 4.6.1 新規参入の脅威
- 4.6.2 買い手/消費者の交渉力
- 4.6.3 供給者の交渉力
- 4.6.4 代替品の脅威
- 4.6.5 競争の激しさ
5. 市場規模と成長予測(金額 – 米ドル)
-
5.1 用途別
- 5.1.1 再生医療
- 5.1.2 幹細胞生物学研究
- 5.1.3 組織工学
- 5.1.4 毒性試験
-
5.2 製品タイプ別
- 5.2.1 hESC株
- 5.2.2 培地および試薬
- 5.2.3 機器および消耗品
-
5.3 地域別
- 5.3.1 北米
- 5.3.1.1 米国
- 5.3.1.2 カナダ
- 5.3.1.3 メキシコ
- 5.3.2 南米
- 5.3.2.1 ブラジル
- 5.3.2.2 アルゼンチン
- 5.3.2.3 南米のその他の地域
- 5.3.3 ヨーロッパ
- 5.3.3.1 ドイツ
- 5.3.3.2 イギリス
- 5.3.3.3 フランス
- 5.3.3.4 イタリア
- 5.3.3.5 スペイン
- 5.3.3.6 ヨーロッパのその他の地域
- 5.3.4 アジア太平洋
- 5.3.4.1 中国
- 5.3.4.2 日本
- 5.3.4.3 インド
- 5.3.4.4 オーストラリア
- 5.3.4.5 韓国
- 5.3.4.6 アジア太平洋のその他の地域
- 5.3.5 中東およびアフリカ
- 5.3.5.1 GCC
- 5.3.5.2 南アフリカ
- 5.3.5.3 中東およびアフリカのその他の地域
6. 競争環境
- 6.1 市場集中度
- 6.2 戦略的動き
- 6.3 市場シェア分析
-
6.4 企業プロファイル(グローバルレベルの概要、市場レベルの概要、主要セグメント、利用可能な財務情報、戦略情報、主要企業の市場ランク/シェア、製品&サービス、および最近の動向を含む)
- 6.4.1 Astellas Pharma Inc.
- 6.4.2 Thermo Fisher Scientific Inc.
- 6.4.3 Merck KGaA
- 6.4.4 STEMCELL Technologies Inc.
- 6.4.5 Takara Bio Inc.
- 6.4.6 Lineage Cell Therapeutics Inc.
- 6.4.7 PeproTech Inc.
- 6.4.8 PromoCell GmbH
- 6.4.9 Vertex Pharmaceuticals
- 6.4.10 Lonza Group AG
- 6.4.11 BD Biosciences
- 6.4.12 GE HealthCare
- 6.4.13 ViaCyte Inc.
- 6.4.14 Fate Therapeutics
- 6.4.15 BlueRock Therapeutics
- 6.4.16 Cynata Therapeutics
- 6.4.17 Pluri Inc.
- 6.4.18 Organovo Holdings Inc.
- 6.4.19 Samsung Biologics
- 6.4.20 Cell Engineering Corp.
- 6.4.21 Janssen (Cell Therapy Grp)
7. 市場機会&将来展望
*** 本調査レポートに関するお問い合わせ ***

ヒトES細胞、すなわちヒト胚性幹細胞は、多能性幹細胞の一種であり、私たちの体のあらゆる種類の細胞へと分化する能力(多能性)と、無限に増殖する能力(自己複製能)を併せ持つ細胞です。この細胞は、受精卵が着床する前の初期胚である胚盤胞の内部細胞塊から作製されます。内部細胞塊は将来的に胎児となる部分であり、そこから細胞を取り出して培養することで、未分化な状態を保ちながら増殖させることが可能となります。ヒトES細胞の研究は、生命の初期発生メカニズムの解明に貢献するだけでなく、再生医療や創薬研究において極めて大きな可能性を秘めている一方で、受精卵を利用することから倫理的な議論が常に伴います。
ヒトES細胞そのものに厳密な「種類」があるわけではありませんが、その作製方法や由来によっていくつかの系統(セルライン)が存在します。また、多能性幹細胞という大きなカテゴリーの中では、人工多能性幹細胞(iPS細胞)との比較が不可欠です。iPS細胞は、体細胞に特定の遺伝子を導入することで作製されるため、受精卵を破壊する必要がなく、倫理的なハードルが低いという大きな利点があります。しかし、ヒトES細胞は、多能性の「ゴールドスタンダード」として、iPS細胞の多能性を評価する際の比較対象となるなど、基礎研究において依然として重要な役割を担っています。また、iPS細胞の作製過程で導入される遺伝子や、その後の培養環境による影響を排除した、より「自然な」多能性細胞として、発生学的な研究において独自の価値を持っています。
ヒトES細胞の主な用途は多岐にわたります。最も期待されているのは再生医療分野です。心筋梗塞で損傷した心臓組織、脊髄損傷による神経障害、パーキンソン病やアルツハイマー病といった神経変性疾患、糖尿病における膵臓のインスリン産生細胞の補充など、様々な疾患や損傷に対して、ヒトES細胞を特定の細胞へと分化誘導し、移植することで機能回復を目指す研究が進められています。次に、創薬研究への応用も重要です。特定の疾患を持つ患者由来のES細胞(またはiPS細胞)を用いて、その疾患の病態を試験管内で再現する「疾患モデル」を作製し、新たな薬剤候補のスクリーニングや、既存薬の毒性評価を行うことができます。これにより、動物実験では得られにくいヒト特有の反応を評価し、より効率的かつ安全な薬剤開発に繋げることが期待されています。さらに、ヒトの初期発生や細胞分化のメカニズムを解明するための基礎研究にも不可欠です。ヒトES細胞を用いることで、これまで直接観察することが困難であったヒトの発生初期段階の細胞の挙動や遺伝子発現の変化を詳細に解析することが可能となります。
関連する技術としては、まず「分化誘導技術」が挙げられます。ヒトES細胞を目的の細胞(神経細胞、心筋細胞、肝細胞など)へと効率的かつ高純度に分化させるための培養条件や因子を特定する技術は、再生医療応用の鍵となります。次に、「ゲノム編集技術」も重要です。CRISPR/Cas9などの技術を用いて、ヒトES細胞の特定の遺伝子を改変することで、遺伝性疾患のメカニズムを解明したり、治療法を開発したりする研究が進められています。また、免疫拒絶反応を避けるために、HLA型を調整したES細胞株の作製も試みられています。さらに、「3D培養・オルガノイド技術」も注目されています。これは、ヒトES細胞から試験管内で臓器様の立体構造(ミニ臓器、オルガノイド)を構築する技術であり、より生体に近い環境で疾患モデルを研究したり、薬剤の有効性や毒性を評価したりすることが可能になります。これらのオルガノイドは、脳、肝臓、腎臓、腸など様々な臓器の機能を部分的に再現できるため、創薬や発生研究に新たな道を開いています。
市場背景としては、ヒトES細胞の研究は世界中で活発に行われていますが、その利用には倫理的な課題が常に付きまといます。受精卵の破壊を伴うため、各国で法規制やガイドラインが設けられており、研究の進展に影響を与えています。例えば、日本では「ヒトES細胞の樹立に関する指針」や「ヒトES細胞の使用に関する指針」が定められ、厳格な審査と管理の下で研究が進められています。米国や欧州でも、国や地域によって規制の度合いが異なり、研究資金の提供にも制限がある場合があります。このような倫理的・法的制約から、iPS細胞の登場以降、再生医療や創薬研究の主流はiPS細胞へとシフトしつつあります。iPS細胞は患者自身の体細胞から作製できるため、倫理的な問題が少なく、また免疫拒絶反応のリスクも低いという大きな利点があるからです。しかし、前述の通り、ヒトES細胞は多能性の「ゴールドスタンダード」としての価値や、iPS細胞では再現しにくい特定の発生現象の解明において、依然として重要な研究対象であり続けています。そのため、両者の強みを活かした研究の共存が進められています。実用化に向けては、細胞の大量培養技術、品質管理、安全性評価、そしてコストの問題など、多くの課題が残されています。
将来展望として、ヒトES細胞の研究は、iPS細胞研究との相補的な関係を深めながら、今後も発展していくと考えられます。再生医療分野では、特定の疾患に対する臨床応用がさらに進み、より多くの患者に恩恵をもたらすことが期待されます。特に、iPS細胞では作製が難しい特定の細胞種や、より初期発生に近い状態での研究において、ヒトES細胞が重要な役割を果たすでしょう。創薬研究においては、より精緻な疾患モデルの構築や、個別化医療の実現に向けた薬剤スクリーニングの精度向上に貢献することが期待されます。また、ゲノム編集技術との組み合わせにより、遺伝性疾患の根本治療に向けた研究も加速するでしょう。倫理的な議論は今後も継続されますが、技術の進歩と社会の理解が深まるにつれて、より適切な利用方法が模索されていくはずです。国際的な協力体制の構築や、研究の標準化も、ヒトES細胞研究の健全な発展には不可欠です。最終的には、ヒトES細胞とiPS細胞、それぞれの特性を最大限に活かし、難病の克服や健康寿命の延伸に貢献することが、この分野の究極的な目標と言えるでしょう。