検査機関向け外部精度管理市場 規模・シェア分析 – 成長動向と予測 (2025-2030年)
臨床検査精度管理市場は、産業分野別(臨床診断、微生物学、医薬品・バイオ医薬品など)、技術別(クロマトグラフィー、分光光度法、免疫測定法など)、プロバイダータイプ別(独立系/第三者プロバイダー、機器メーカープログラムなど)、および地域別(北米、欧州など)に区分されます。市場予測は、金額(米ドル)で提供されます。

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
ラボラトリー能力試験市場の概要:成長トレンドと予測(2025年~2030年)
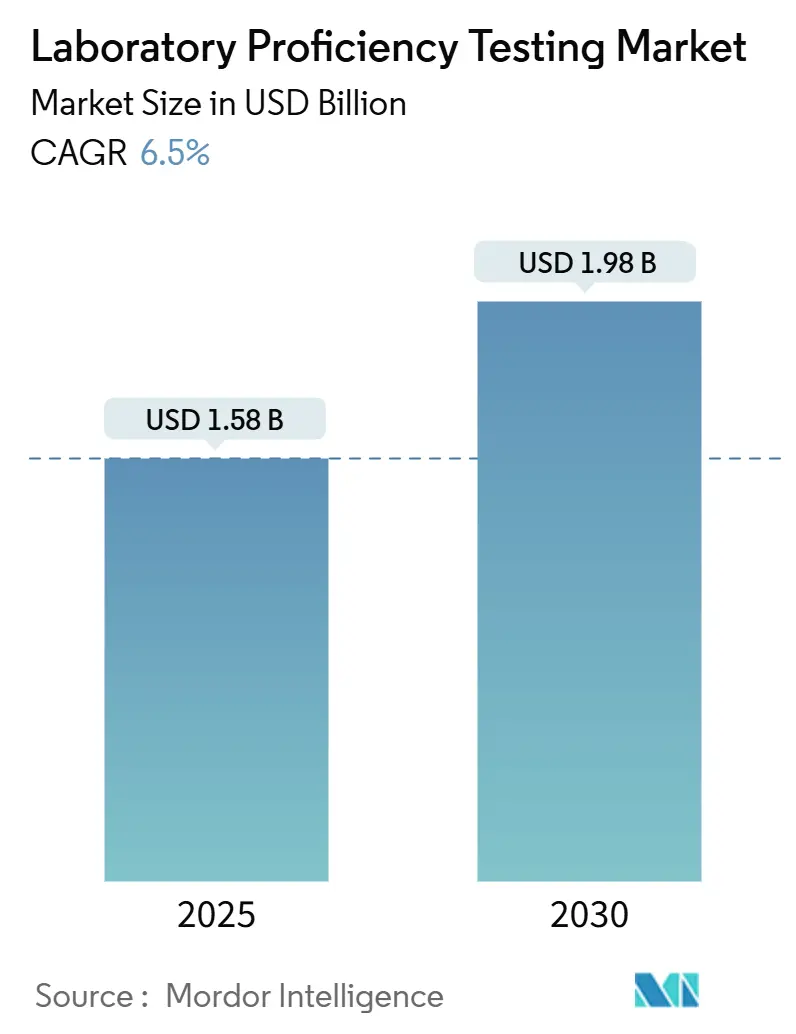
ラボラトリー能力試験市場は、2025年には15.8億米ドルに達し、2030年までに19.8億米ドルへと成長し、予測期間中に年平均成長率(CAGR)6.5%を記録すると予測されています。この成長は、規制当局による分析性能基準の厳格化や、より高度な分子・細胞ベースのアッセイの導入に伴い、単なるコンプライアンス遵守から戦略的な品質差別化へと市場の焦点が移行していることを反映しています。
例えば、2025年1月に発効した血中アルコールおよび血中鉛検査に関するCLIA(Clinical Laboratory Improvement Amendments)の改訂グレーディングは、北米の臨床検査室における精度への期待を高めています。また、FDAのLAAFプログラムやEPAの新しいPFAS(パーフルオロアルキル化合物およびポリフルオロアルキル化合物)分析法の下で、食品、水、環境検査ラボも同様の圧力に直面しており、検証済みの外部品質評価(EQA)に対する需要が加速しています。プロバイダーの選好はベンダーニュートラルなスキームへと傾き続け、デジタルプラットフォームは結果分析を効率化し始めており、ラボラトリー能力試験市場が規制上の義務から運用上のパフォーマンス向上ツールへと変化していることを示唆しています。
# 主要なレポートのポイント
* 産業別: 2024年には臨床診断がラボラトリー能力試験市場シェアの38.67%を占め、最大となりました。医薬品・バイオロジクス分野は、2030年までに7.65%のCAGRで最も速い成長を遂げると予測されています。
* 技術別: 2024年には細胞培養ベースアッセイがラボラトリー能力試験市場規模の27.54%を占めました。PCR・分子法は、2030年まで7.23%のCAGRで成長すると見込まれています。
* プロバイダータイプ別: 2024年には独立/第三者プロバイダーがラボラトリー能力試験市場シェアの54.45%を占め、2030年まで8.12%のCAGRで拡大すると予測されています。
* 地域別: 2024年には北米が収益シェアの42.34%を占め、最大となりました。アジア太平洋地域は、2030年までに8.34%のCAGRで最も速い成長を記録すると予測されています。
# グローバルラボラトリー能力試験市場のトレンドと洞察
促進要因
1. ISO/IEC 17025および17043認定要件の厳格化:
ISO/IEC 17025:2017およびISO/IEC 17043の2023年改訂版へのグローバルな整合は、ラボラトリーに手続き的コンプライアンスではなく、定量的な能力を実証するよう促しています。香港のHKASは2024年11月に新しい17043基準を採用し、カナダのStandards Councilは2024年5月に同様のアップグレードを施行しました。認定機関は不適合ラボの認定を停止する可能性があり、これにより市場の統合が促進され、統計的に堅牢な外部品質評価への需要が高まっています。ISOの収束が新興市場に拡大するにつれて、認定更新に紐づく義務的な参加条項を通じて、ラボラトリー能力試験市場は勢いを増しています。
2. 慢性疾患の負担増に伴う臨床診断量の増加:
糖尿病、心血管疾患、腫瘍検査の発生率増加は、米国のラボラトリーにおける平均検査項目数を増やし、次世代シーケンシングパネルへの参加も拡大しています。CLIA規則は、中程度および高難度検査を行うすべてのラボに承認されたプログラムへの登録を義務付けており、CMSは2025年に新しい細胞診スキームを承認しました。Quest Diagnosticsのような大規模ネットワークが2023年に93億ドルの収益を報告したことは、規模が複数のサイトにわたる能力試験の購読をいかに増幅させるかを示しています。したがって、ラボラトリー能力試験市場は、特に高度な分子アッセイが個別化された外部品質評価を必要とする場合、診断量に直接比例して拡大します。
3. 世界的な食品・水安全規制の強化:
FDAは2024年6月にLAAFプログラムの下でのマイコトキシン検査の十分な能力を宣言し、自主的なスキームを義務的な認定チェックポイントへと転換しました。2024年4月に発行されたEPAのPFASに関する並行規則は、環境ラボに結果受諾前に分析法の能力を検証するよう義務付けています。安全飲料水法の下では、飲料水監視は2025年1月よりPFASおよび塩素の迅速分析法を許可していますが、ラボが継続的な能力を文書化することが条件です。これらの進展は、ラボラトリー能力試験市場を農業食品および環境分野における裁量のない支出へと変えています。
4. バイオロジクス製造の活況と検証済み分析法の需要:
モノクローナル抗体、細胞療法、遺伝子ベクターが拡大するにつれて、規制当局はグローバルサイト間でのアッセイ同等性の証明を要求しています。FDAの分析手順に関するガイダンスは、外部能力試験ラウンドを通じて頻繁に実証される効力、純度、および同一性のベンチマークを強調しています。Labcorpは2023年のFDA承認の90%に検査を提供しており、大規模ネットワーク全体で調和された品質データへの需要を証明しています。したがって、ラボラトリー能力試験市場はバイオロジクスのライフサイクル管理に不可欠であり、分析検証をGMP(Good Manufacturing Practice)コンプライアンスに直接結びつけています。
抑制要因
1. 中小規模ラボにとっての高い購読コスト:
公衆衛生ラボ協会(APHL)による独立調査によると、年間能力試験費用は、低容量ラボの場合、総収益の3%を超える可能性があり、特に発展途上国での参加を制約しています。2023年8月のUSPスキームの終了は切り替えコストを上昇させ、市場からの撤退が小規模施設への価格圧力をいかに高めるかを浮き彫りにしています。
2. 新興地域におけるサンプル物流と安定性の課題:
アフリカ、東南アジア、ラテンアメリカの一部地域では、コールドチェーンのギャップ、通関の遅延、限られた宅配ネットワークがサンプルの完全性を危うくしています。プログラムはしばしば材料を再送する必要があり、ターンアラウンドタイムを延長し、コストを上昇させます。APHLの調査では、安定性不良がユーザーの苦情の上位3つにランクされています。これらの課題は、好ましい規制トレンドにもかかわらず、高成長地域における即座の需要を抑制しています。
# セグメント分析
産業別:臨床診断が優勢、医薬品が加速
臨床診断は、CLIAの義務化と慢性疾患検査量の増加により、2024年にラボラトリー能力試験市場シェアの38.67%を占め、プログラムへの登録を維持しました。ラボは通常、血液学、化学、感染症パネルの能力試験市場規模を複数のプロバイダーに分割し、予測可能な更新収益を強化しています。一方、医薬品・バイオロジクス分野は、モノクローナル抗体効力およびmRNAワクチン放出における厳格な分析法検証に牽引され、7.65%のCAGRで最も速い成長を記録しました。
ラボラトリー能力試験業界は、食品安全と臨床細菌学ラボからの二重の需要に牽引され、微生物学分野でも一貫した採用が見られます。FDAのMoCRA(Modernization of Cosmetics Regulation Act)施行日である2024年7月以降、化粧品・パーソナルケア分野からの問い合わせが増加し、重金属および微生物チャレンジに関する新しいスキームが促されました。大麻およびサイケデリックスの検査ラウンドは適用範囲を広げ、新興ニッチ市場では、差別化された外部品質評価が正式な規制命令に先行する可能性があることを示しています。
技術別:細胞培養がリードを維持するも、分子法が急増
細胞培養ベースアッセイは、継続的なバイオロジクス効力試験およびウイルス除去確認を反映し、2024年にラボラトリー能力試験市場規模の27.54%を占めました。しかし、PCR・分子法は、精密腫瘍学、病原体ゲノミクス、廃水ベースの疫学が核酸の精度ベンチマークを要求するため、7.23%のCAGRで上回ると予測されています。
クロマトグラフィーおよび質量分析ラウンドは、医薬品不純物プロファイリングおよびPFAS定量において中核的な関連性を維持し、分光光度法は大規模なルーチン臨床化学プログラムに貢献しています。ラボラトリー能力試験業界は、特にシーケンシングファイルにおいてデジタルデータ交換をますます統合しており、ピア比較分析を改善し、単純な合否指標を超えてスキームの価値を拡大しています。
プロバイダータイプ別:独立プロバイダーが客観性を定義
独立/第三者プロバイダーは、2024年にラボラトリー能力試験市場シェアの54.45%を支配し、ラボラトリー能力試験市場をプラットフォーム全体にわたる分析能力の公平な仲裁者へと転換させました。彼らの8.12%の成長率は、品質監視を機器ベンダーから切り離したいという顧客の選好を反映しています。
メーカー提携スキームは、高度に専門化されたハードウェアにとって重要性を維持していますが、客観性に対する懐疑的な見方に直面しています。一方、政府または認定機関プログラムは、水質や新生児スクリーニングなどの公衆衛生ミッションに焦点を当てています。いくつかの独立プロバイダーは現在、ワークフロー分析ダッシュボードをバンドルし、ラボに内部品質管理システムを強化するリアルタイムのパフォーマンス傾向を提供しています。
# 地域分析
北米は、26万を超える米国のラボに対するCLIAベースの義務的登録と、カナダの調和された認定システムに支えられ、2024年の収益の42.34%を占めました。この地域のラボラトリー能力試験市場は、州レベルでの合法化が続く大麻検査におけるニッチな需要からも恩恵を受けています。LabcorpやBioReferenceのような商業的なスーパーネットワーク間の統合は、単価が交渉の対象となる中でも、量の堅牢性を支えています。
アジア太平洋地域は、中国のCNAS認定要件、日本の食品衛生法検査義務、インドの拡大するバイオ製造回廊を反映し、2030年までに8.34%の最速CAGRを記録すると予測されています。APACの相互承認協定は、国境を越えた受諾をさらに拡大し、冗長な検査コストを削減し、洗練された外部品質管理の採用を促進しています。東南アジアの一部地域では物流上の制約が依然として足かせとなっていますが、デジタル報告プラットフォームが物理的な流通ギャップを部分的に補っています。
ヨーロッパは、EN ISO/IEC 17025の実施と、2024年7月の欧州薬局方における大麻花の追加などの進化するモノグラフの下で、成熟した着実な成長を維持しています。Brexitの複雑さは管理上のオーバーヘッドをわずかに増加させましたが、相互承認協定が維持されているため、ラボラトリー能力試験市場を減速させるには至っていません。ラテンアメリカおよび中東・アフリカは、コールドチェーンと通関のボトルネックが解消されれば長期的な上昇の可能性を秘めており、地域政府はすでにISO規範との整合を示しています。
# 競争環境
ラボラトリー能力試験市場は中程度の集中度を示しており、技術的障壁、認定承認、および物流インフラが新規参入者の急速な入れ替わりを妨げています。独立プロバイダーはベンダーニュートラルな信頼性を活用し、機器メーカーはアフターマーケットサービスを強化するためにスキームを統合しています。EurofinsによるViraCor-IBT(2024年5月)およびInfinity Laboratories(2025年2月)の買収は、感染症および材料科学の専門知識を拡大する水平的な追加を示しています。
戦略的テーマには、デジタル化(クラウドポータルが分析結果をQCダッシュボードに自動ロード)、サイケデリックス、在宅サンプルキット、AI支援組織病理学などのホワイトスペースへの拡大が含まれます。2023年12月に更新された米国国防総省の環境検査基準は、契約資格のために能力試験への参加を義務付けており、ベースライン需要を確立しています。ベンダーの差別化は、価格だけでなく、ターンアラウンド速度、統計的深度、および多マトリックスポートフォリオの幅広さにますます依存しています。
統合は続いており、Labcorpは2024年9月から2025年5月の間に3件の資産取引を発表し、腫瘍学および女性の健康分野のカバー範囲を強化しました。グローバルな物流ネットワークを持たないプロバイダーはニッチなスキームから撤退する可能性があり、市場の選択肢を制限する一方で、主要プレイヤーが指標を標準化する場所ではラウンド間の比較可能性を向上させる可能性があります。
ラボラトリー能力試験業界の主要プレイヤー
* Bio-Rad Laboratories, Inc.
* FAPAS
* LGC Limited
* Merck KGaA
* Trilogy Analytical Laboratory
最近の業界動向
* 2025年3月: Labcorpは、BioReference Healthの特定の腫瘍学資産の買収を発表し、がん診断能力を拡大しました。
* 2025年2月: EurofinsはInfinity Laboratoriesの買収を完了し、材料試験における分析範囲を拡大しました。
* 2025年1月: EPAは安全飲料水法の下でPFASおよび塩素の迅速分析法を承認し、代替手順に対する義務的な能力試験を強化しました。
以上が、ラボラトリー能力試験市場の現状と将来予測に関する詳細な概要です。
このレポートは、検査室技能試験市場に関する詳細な分析を提供しています。
市場の定義と範囲
本調査における検査室技能試験市場は、外部プロバイダーが特性評価済みの試験品を認定または申請中の検査室ネットワークに配布し、その結果を統計的に比較することで、臨床診断、微生物学、医薬品・バイオ医薬品、食品、水、飲料、化粧品などの分野における分析能力を検証する、有料のスキームを指します。研究開発や機器評価のみを目的とした企業内でのラウンドロビントライアルは、独立したプロバイダーが関与しないため、商業的市場価値を反映しないとして除外されています。Mordor Intelligenceによると、2025年の世界市場収益は15.8億米ドルに達しました。
市場規模と成長予測
2025年から2030年にかけて、この市場は年平均成長率(CAGR)6.5%で成長すると予測されています。
市場の推進要因
市場の成長を牽引する主な要因は以下の通りです。
* ISO/IEC 17025および17043認定要件の厳格化
* 慢性疾患の負担増大に伴う臨床診断量の増加
* 世界的な食品および水安全規制の強化
* 検証済み分析手法を求めるバイオ医薬品製造の活況
* 大麻およびサイケデリックスの合法化によるニッチな技能試験スキームの出現
* 遠隔・在宅検査の台頭によるデジタル技能試験の機会創出
市場の抑制要因
一方で、市場の成長を妨げる要因も存在します。
* 中小規模の検査室にとってのサブスクリプション費用の高さ
* 新興地域における検体ロジスティクスと安定性の課題
* 統合による主要な技能試験プログラムの中止
* データプライバシー規制による検査室間のデータ共有分析の制限
市場のセグメンテーション
市場は以下の主要なセグメントに分類されています。
* 産業別: 臨床診断、微生物学、医薬品・バイオ医薬品、食品・動物飼料、水・環境、商業飲料、化粧品・パーソナルケア、その他。
* 技術別: クロマトグラフィー、分光光度法、免疫測定法、PCR・分子法、細胞培養ベースアッセイ、その他の新興技術。
* プロバイダータイプ別: 独立系/第三者プロバイダー、機器メーカープログラム、政府・認定機関スキーム。
* 地域別: 北米、欧州、アジア太平洋、南米、中東・アフリカ。特に北米は、米国、カナダ、メキシコを含み、欧州は英国、ドイツ、フランス、イタリア、スペインなどが含まれます。
競争環境
市場には、College of American Pathologists (CAP)、LGC Limited、Bio-Rad Laboratories、Randox Laboratories、AOAC Internationalなど、多数の主要企業が存在し、市場集中度や市場シェア分析が行われています。独立系プロバイダーは、検査室が公平性と幅広いマルチプラットフォームベンチマークへのアクセスを求めるため、シェアを拡大しています。
調査方法論
本レポートでは、トップダウンとボトムアップを組み合わせたハイブリッドアプローチを採用しています。一次調査では、北米、欧州、アジア太平洋地域の技能試験スキーム管理者、検査室品質担当者、認定評価者へのインタビューを実施しました。二次調査では、世界保健機関、米国CDC、Eurofins、ISO/IEC 17043認定登録簿、AOACなどの業界団体、税関データベース、D&B Hoovers、Dow Jones Factivaなどの公開情報源を広範に活用しました。データは、2段階のアナリストレビューと、必要に応じた再連絡により検証され、毎年更新されます。
レポートの主な質問への回答
* 2025年以降の市場成長は、ISO認定の厳格化、臨床診断量の増加、新たな食品・水安全規制の導入によって推進され、2030年までに6.5%のCAGRが見込まれます。
* 最も急速に成長している産業セグメントは、バイオ医薬品製造と手法検証の強化により、医薬品・バイオ医薬品分野であり、7.65%のCAGRが予測されています。
* 北米は2024年に世界収益の42.34%を占め、CLIA参加義務やFDA、EPAプログラムの需要に支えられています。
* 独立系技能試験プロバイダーは、検査室が利益相反を避け、より広範なマルチプラットフォームベンチマークにアクセスできるベンダーニュートラルなプログラムを好むため、シェアを拡大しています。

1. はじめに
- 1.1 調査の前提条件 & 市場の定義
- 1.2 調査範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場概況
- 4.1 市場概要
-
4.2 市場の推進要因
- 4.2.1 より厳格なISO/IEC 17025 & 17043認定義務
- 4.2.2 慢性疾患の負担の中での臨床診断量の増加
- 4.2.3 世界的な食品 & 水の安全規制の強化
- 4.2.4 検証済み分析手法を要求するバイオ医薬品製造のブーム
- 4.2.5 大麻 & 幻覚剤の合法化がニッチなPTスキームを促進
- 4.2.6 リモート/在宅検査の台頭がデジタルPTの機会を創出
-
4.3 市場の阻害要因
- 4.3.1 中小規模の検査機関にとっての高額な購読料
- 4.3.2 新興地域におけるサンプル物流 & 安定性の課題
- 4.3.3 統合による主要PTプログラムの中止
- 4.3.4 研究室間のデータ共有分析を制限するデータプライバシー規則
- 4.4 バリューチェーン分析
- 4.5 規制環境
- 4.6 技術的展望
-
4.7 ポーターの5つの力分析
- 4.7.1 新規参入者の脅威
- 4.7.2 代替品の脅威
- 4.7.3 買い手の交渉力
- 4.7.4 供給者の交渉力
- 4.7.5 競争上の対抗関係
5. 市場規模 & 成長予測(価値)
-
5.1 産業別
- 5.1.1 臨床診断
- 5.1.2 微生物学
- 5.1.3 医薬品・バイオ医薬品
- 5.1.4 食品・動物飼料
- 5.1.5 水・環境
- 5.1.6 市販飲料
- 5.1.7 化粧品・パーソナルケア
- 5.1.8 その他
-
5.2 技術別
- 5.2.1 クロマトグラフィー
- 5.2.2 分光光度法
- 5.2.3 免疫測定法
- 5.2.4 PCR・分子生物学的手法
- 5.2.5 細胞培養ベースアッセイ
- 5.2.6 その他の新興技術
-
5.3 プロバイダータイプ別
- 5.3.1 独立系/第三者プロバイダー
- 5.3.2 機器メーカープログラム
- 5.3.3 政府・認定機関スキーム
-
5.4 地域別
- 5.4.1 北米
- 5.4.1.1 米国
- 5.4.1.2 カナダ
- 5.4.1.3 メキシコ
- 5.4.2 欧州
- 5.4.2.1 英国
- 5.4.2.2 ドイツ
- 5.4.2.3 フランス
- 5.4.2.4 イタリア
- 5.4.2.5 スペイン
- 5.4.2.6 その他の欧州
- 5.4.3 アジア太平洋
- 5.4.3.1 中国
- 5.4.3.2 インド
- 5.4.3.3 日本
- 5.4.3.4 韓国
- 5.4.3.5 オーストラリア
- 5.4.3.6 その他のアジア太平洋
- 5.4.4 南米
- 5.4.4.1 ブラジル
- 5.4.4.2 アルゼンチン
- 5.4.4.3 その他の南米
- 5.4.5 中東・アフリカ
- 5.4.5.1 GCC
- 5.4.5.2 南アフリカ
- 5.4.5.3 その他の中東・アフリカ
6. 競合情勢
- 6.1 市場集中度
- 6.2 市場シェア分析
-
6.3 企業プロファイル(グローバルレベルの概要、市場レベルの概要、主要セグメント、利用可能な財務情報、戦略情報、主要企業の市場順位/シェア、製品&サービス、および最近の動向を含む)
- 6.3.1 米国病理医協会 (CAP)
- 6.3.2 LGC Limited
- 6.3.3 バイオ・ラッド・ラボラトリーズ
- 6.3.4 ランドックス・ラボラトリーズ
- 6.3.5 AOACインターナショナル
- 6.3.6 アメリカン・プロフィシエンシー・インスティテュート
- 6.3.7 ウォーターズERA (ウォーターズ・コーポレーション)
- 6.3.8 UK NEQAS
- 6.3.9 フェラ・サイエンス (Fapas)
- 6.3.10 プロフィシエンシー・テスティング・オーストラリア
- 6.3.11 QACSラボ
- 6.3.12 QSE GmbH
- 6.3.13 欧州技能試験サービス (EPTIS)
- 6.3.14 AAFCO技能試験プログラム
- 6.3.15 Inpas SL
- 6.3.16 Bipea
- 6.3.17 NSIラボソリューションズ
- 6.3.18 グローバル・プロフィシエンシー Ltd.
- 6.3.19 フェノバ
- 6.3.20 アブソリュート・スタンダード社
- 6.3.21 FSS技能試験
7. 市場機会&将来展望
*** 本調査レポートに関するお問い合わせ ***

検査機関向け外部精度管理とは、臨床検査、食品検査、環境検査など、様々な分野の検査機関が日常的に実施している検査の結果が、どれほど正確で信頼できるものであるかを客観的に評価し、その品質を保証するための重要な仕組みでございます。これは、第三者の専門機関が提供する、測定対象成分の濃度や有無が不明な「管理検体」を、参加する検査機関が通常の検査と同様に測定し、その結果を第三者機関に報告することで成り立ちます。第三者機関は、報告された各機関の測定結果を統計的に解析し、他の参加機関の結果や設定された基準値と比較して、各機関の測定能力や精度に関する詳細な評価レポートを提供いたします。このプロセスを通じて、検査機関は自らの検査プロセスの弱点を特定し、改善を図ることができ、最終的には検査結果の信頼性向上、標準化、そして患者様や顧客への安心・安全の提供に貢献いたします。
この外部精度管理には、対象となる検査分野や検体の種類、評価方法によって様々な種類がございます。対象分野別では、医療機関で行われる生化学、血液学、免疫学、微生物学、遺伝子検査などの「臨床検査」が最も一般的ですが、その他にも食品の安全性に関わる「食品検査」、水質や大気などの「環境検査」、工業製品の品質管理に関わる検査など、多岐にわたります。検体の種類も、血清、尿、髄液といった生体由来のものから、食品サンプル、水サンプル、DNA/RNAなど、検査対象に応じて多種多様です。評価方法としては、数値データ(濃度、活性値など)を統計的に評価する「定量的精度管理」と、陽性/陰性、菌種同定といった質的な結果の一致度を評価する「定性的精度管理」が主なものです。また、提供機関も、日本医師会や日本臨床検査技師会のような国内の公的・専門機関、CAP(米国病理学会)やUK NEQAS(英国外部精度管理スキーム)のような国際的な機関、そして民間の専門機関などがあり、それぞれが特定の分野や地域に特化したプログラムを提供しております。
検査機関向け外部精度管理の用途と重要性は非常に高く、検査機関の運営において不可欠な要素となっております。第一に、検査結果の信頼性を向上させることです。客観的な評価を受けることで、検査機関は自らの検査結果が正確であることを証明でき、誤診や誤った判断のリスクを低減し、患者様や顧客の安全を確保いたします。第二に、検査結果の標準化と一貫性を確保することです。複数の検査機関が同じ精度管理プログラムに参加することで、異なる施設で検査を受けても同等の結果が得られることを保証し、医療連携や国際的なデータ比較を可能にします。第三に、品質保証と品質改善の推進です。外部精度管理は、検査プロセスの潜在的な問題点や弱点を特定するための客観的なデータを提供し、内部精度管理と連携して検査機関の品質マネジメントシステムの中核をなします。これにより、継続的な品質改善活動が促進されます。第四に、法的・規制要件への適合です。多くの国や地域において、検査機関が認定や許認可を得るための必須要件となっており、例えばISO 15189のような国際規格の取得には外部精度管理への参加が求められます。最後に、検査技師の教育・トレーニングの機会提供としても機能し、新しい検査法の導入時の評価ツールとしても活用されます。
関連技術としては、まず「検体調製技術」が挙げられます。安定した均質な管理検体を作成するためには、凍結乾燥技術、安定化剤の選定、均質化技術などが不可欠です。次に、参加機関から報告される膨大なデータを効率的に処理し、統計的評価を行うための「統計解析ソフトウェア」が重要です。このソフトウェアは、Zスコア、CV値、Youden Plotなどの指標を用いて、各機関のパフォーマンスを可視化し、詳細なレポートを生成します。また、「情報通信技術(ICT)」は、オンラインでの結果報告システム、評価レポートの電子配信、データセキュリティとプライバシー保護、さらにはAIや機械学習を用いた異常値検出やトレンド分析に活用され、精度管理プログラムの効率化と高度化を支えています。検体の追跡と識別の自動化には「バーコードやRFID」が用いられ、測定のトレーサビリティを確保するためには「標準物質や認証標準物質(CRM)」が不可欠です。
市場背景としては、いくつかの要因が外部精度管理の需要を牽引しております。最も大きな要因は、医療分野における患者安全への意識の高まり、食品安全、環境保護に関する法規制の強化です。ISO 15189のような国際規格の普及も、検査機関に外部精度管理への参加を促しています。また、医療の高度化と個別化が進む中で、新しいバイオマーカーや遺伝子検査の登場により、精度管理の対象が拡大しています。グローバル化の進展に伴い、国際的な検査結果の相互承認の必要性が高まり、国際的な精度管理プログラムへの参加が増加傾向にあります。さらに、検査業務を外部の専門機関に委託するケースが増えており、委託先の品質保証の重要性が高まっています。技術革新も市場を動かす要因であり、次世代シーケンサーなどの新しい検査技術に対応した精度管理プログラムの開発が求められています。
将来展望としては、外部精度管理はさらなる進化を遂げると予想されます。まず、「AIとビッグデータの活用」が挙げられます。精度管理データのより高度な解析により、異常トレンドの早期発見や参加機関のパフォーマンス予測、さらには個別化された改善提案が可能になるでしょう。次に、従来の定期的なプログラムに加え、日常検査データを用いた「リアルタイム精度管理」の導入が進む可能性があります。これにより、問題発生時の迅速な対応が可能となります。また、「デジタル化と自動化」は、検体管理、結果報告、データ解析、レポート生成のさらなる効率化を促進し、ブロックチェーン技術を用いたデータの信頼性・改ざん防止も検討されるかもしれません。新しい検査技術への対応も引き続き重要であり、遺伝子編集、プロテオミクス、メタボロミクスといった最先端の検査技術に対応した精度管理プログラムの開発が加速するでしょう。POCT(Point-of-Care Testing)機器の普及に伴い、その精度管理の重要性も増大します。国際連携の強化により、国際的な精度管理プログラムの標準化と相互承認が推進され、環境・食品分野での需要も、気候変動や食の安全への関心の高まりからさらに拡大すると見込まれます。最終的には、検査機関の規模、専門分野、使用機器に応じた、より柔軟で「カスタマイズされたプログラム」の提供が主流となるでしょう。これらの進化は、検査結果の信頼性を一層高め、社会全体の安全と安心に貢献していくものと考えられます。