高分子医薬品CDMO市場:規模・シェア分析、成長トレンドと予測 (2025年~2030年)
高分子CDMO市場は、サービス(受託開発{細胞株・プロセス開発}など)、ソース(哺乳類など)、分子タイプ(モノクローナル抗体、組換えタンパク質など)、エンドユーザー(製薬・バイオテクノロジー企業など)、および地域(北米、欧州、アジア太平洋など)によってセグメント化されています。市場規模と予測は、金額(米ドル)で提供されます。

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
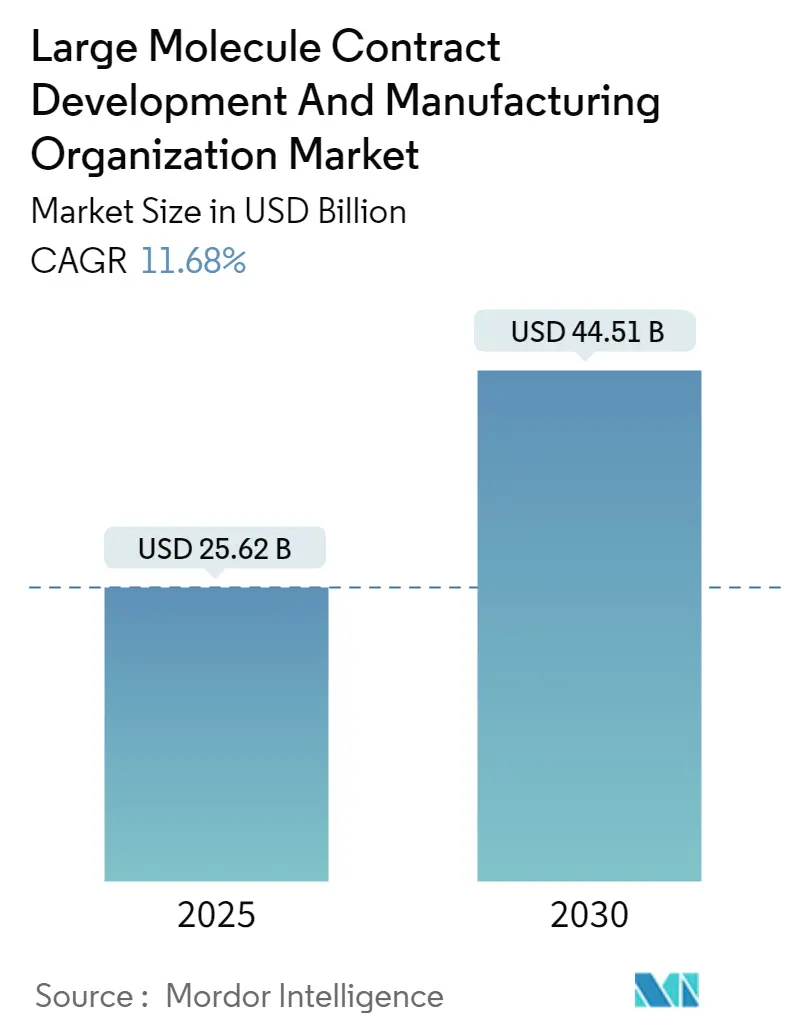
ラージ分子CDMO(医薬品開発製造受託機関)市場は、2025年に256.2億米ドル、2030年には445.1億米ドルに達すると予測されており、予測期間中の年平均成長率(CAGR)は11.68%と見込まれています。この成長は、複雑なバイオ医薬品の承認増加、バイオシミラーの普及拡大、資産を軽量化する製造戦略への明確な移行、大手製薬会社による既存施設の売却、新興バイオテクノロジー企業への記録的なベンチャー資金流入など、複数の要因によって推進されています。また、アジア太平洋地域におけるデジタル化されたシングルユース製造能力の拡大は、地理的な障壁を取り除き、費用対効果の高いスケールアップオプションを提供しています。規制当局による監視の強化は、実績のある品質記録を持つプロバイダーに有利に働き、資本力のあるグローバルプレイヤーへの活動集中をさらに促しています。
主要なレポートのポイント
サービス別では、2024年に契約製造が74.1%の市場シェアを占め、契約開発は2030年までに14.1%のCAGRで成長すると予測されています。供給源別では、哺乳類発現プラットフォームが2024年に63.5%の市場規模を占め、微生物システムは2030年までに18.2%のCAGRで拡大する見込みです。分子タイプ別では、モノクローナル抗体が2024年に51.3%の収益シェアを占め、RNA治療薬が16.5%のCAGRで最も急速な成長を記録しています。エンドユーザー別では、大手製薬会社が2024年に70.4%の需要を生み出し、研究機関および学術機関は2030年まで12.3%のCAGRで成長しています。地域別では、北米が2024年に36.5%の収益シェアを占める最大の市場であり、アジア太平洋地域は2025年から2030年の間に13.6%のCAGRで最も速い成長を遂げると予測されています。
市場の成長要因
ラージ分子CDMO市場の成長を牽引する主な要因は以下の通りです。
* 規制主導の大型分子承認: FDAの画期的治療薬指定や欧州のPRIME制度のような迅速承認経路は、新規バイオ医薬品の審査期間を短縮し、製品が第III相をクリアした後のアウトソーシング需要を即座に高めています。2024年のCDER承認の半分以上が希少疾患を対象としており、CDMO市場への急なスケールアップ要件を生み出しています。
* バイオ医薬品およびバイオシミラー需要の加速: 治療用モノクローナル抗体の売上は2025年までに3150億米ドルに達すると予測されており、下流精製工程の製造作業量が倍増しています。契約製造業者およびハイブリッド事業者は、2028年までに世界のバイオ医薬品生産能力の54%を占めると予測されており、アウトソーシングへの移行の深さを示しています。
* 大手製薬会社の複雑なモダリティへのR&Dシフト: 1,200以上の細胞・遺伝子治療研究が進行中であり、大手製薬会社は専門的な製造をアウトソーシングの優先事項としています。ロシュがロンザに12億米ドルで施設を売却した事例は、固定資産の所有から柔軟なベンダー活用モデルへの転換を示しています。
* AIを活用したバイオプロセス最適化: 規制当局は継続的なデータ駆動型レビューを奨励しており、AIモデルによる重要な品質属性予測に関するガイダンスも発表されています。デジタルツインや機械学習制御ループを導入するプロバイダーは、15%高い収率と30%短い技術移転サイクルを報告しており、市場成長をさらに後押ししています。
* 資金制約のあるバイオテックスタートアップによるアウトソーシングの増加: 資金が限られているバイオテクノロジー企業は、開発から商業生産まで、外部のプラットフォームに依存する傾向が強まっています。
* 新興地域におけるプラグアンドプレイのシングルユース施設: アジア太平洋地域を中心に、迅速に導入可能なシングルユース製造施設が増加しており、コスト効率の高い生産オプションを提供しています。
市場の抑制要因
一方で、市場の成長を抑制する要因も存在します。
* cGMP/バリデーション負担の増大: 改訂されたEU GMP Annex 1は、アイソレーターや高度な汚染管理戦略の広範な採用を義務付けており、小規模プロバイダーには高コストな改修を強いています。FDAの査察データでは、特に新規バイオ医薬品施設において、公式措置指示書(Official Action Indicated letters)の増加が見られます。
* 樹脂および原材料サプライチェーンの不安定性: プロテインA樹脂のスループットは、上流の力価が上昇するにつれて逼迫し、次亜塩素酸ナトリウムの原料はアジアからの輸送ボトルネックに直面しています。世界のAPI前駆体の75%以上が米国以外に存在するため、欧米のCDMOは地政学的な摩擦にさらされています。
* バイオプロセスエンジニアの人材不足: 特に先進国市場で、バイオプロセスエンジニアの専門知識を持つ人材の不足が課題となっています。
* 大型バイオリアクター設備のリードタイム長期化: 大規模なバイオリアクター設備の調達には長いリードタイムが必要であり、これが生産能力の迅速な拡大を妨げる要因となっています。
セグメント分析
* サービス別: 契約製造は2024年に74.1%の収益を上げ、市場の中心的な位置を占めています。これは、ステンレス鋼設備の設置、無菌スイート、集中的なバリデーションサイクルに関連する高い参入障壁があるためです。一方、契約開発は、複雑なモダリティがより深い細胞株およびプロセスエンジニアリングの専門知識を必要とするため、14.1%のCAGRで成長すると予測されています。
* 供給源別: 哺乳類細胞培養は、堅牢なグリコシル化により2024年に63.5%のシェアを維持していますが、合成生物学の革新供給源別: 哺乳類細胞培養は、堅牢なグリコシル化により2024年に63.5%のシェアを維持していますが、合成生物学の革新により、微生物や植物細胞、無細胞システムといった代替の供給源が、より迅速で費用対効果の高い生産方法として注目を集めています。
* 製品別: モノクローナル抗体は、その幅広い治療用途と確立された市場により、2024年に50.2%の市場シェアを占めています。一方、細胞・遺伝子治療は、個別化医療への需要の高まりと画期的な治療法の開発により、予測期間中に最も高いCAGRで成長すると予想されています。
* エンドユーザー別: 製薬・バイオ医薬品企業は、自社の研究開発活動と製造ニーズを外部委託する傾向が強いため、2024年に市場の主要なエンドユーザーとして浮上しています。学術・研究機関も、初期段階の研究開発においてCDMOサービスを利用することで、市場成長に貢献しています。
地域分析
* 北米: 確立されたバイオテクノロジー産業、強力な研究開発インフラ、主要な製薬企業の存在により、北米は2024年に市場を支配しています。政府の支援と投資も、この地域の成長を後押ししています。
* 欧州: 厳格な規制基準と熟練した労働力により、欧州は市場で重要な位置を占めています。特にドイツ、英国、フランスは、バイオ医薬品製造のハブとして知られています。
* アジア太平洋地域: 中国とインドが主導するアジア太平洋地域は、低コストの製造能力、政府の支援、そしてバイオ医薬品需要の増加により、予測期間中に最も急速に成長する地域となるでしょう。この地域は、グローバルなサプライチェーンにおける重要な役割を担っています。
競争環境
バイオ医薬品CDMO市場は、少数の大手企業と多数の中小企業が存在する、競争の激しい市場です。主要なプレーヤーは、市場シェアを拡大し、競争優位性を獲得するために、M&A、戦略的提携、新技術への投資、生産能力の拡大に注力しています。例えば、Lonza、Catalent、FUJIFILM Diosynth Biotechnologies、Samsung Biologics、WuXi Biologicsなどが市場の主要企業として挙げられます。これらの企業は、幅広いサービスポートフォリオとグローバルなプレゼンスを通じて、顧客の多様なニーズに応えています。
結論
バイオ医薬品CDMO市場は、バイオ医薬品の需要増加、複雑なモダリティの開発、そして製造コスト削減への圧力により、今後も力強い成長が期待されます。しかし、サプライチェーンの脆弱性、人材不足、規制の複雑さといった課題も存在します。CDMOは、これらの課題を克服し、イノベーションを推進することで、バイオ医薬品開発の加速に不可欠な役割を果たし続けるでしょう。
このレポートは、大型分子の医薬品開発から製造までの一連のサービスを包括的に提供するCDMO(Contract Development and Manufacturing Organization)市場に焦点を当てています。CDMOは、第三者プロジェクトを効率的に統合し、その専門知識、高度な開発能力、および製造インフラを提供することで、バイオ医薬品産業において不可欠な役割を担っています。本レポートでは、特に大型分子の開発および製造活動のアウトソーシングに特化し、その市場動向を詳細に分析しています。
市場規模は、2025年には256.2億米ドルと評価されており、2030年までには445.1億米ドルに達すると予測されており、堅調な成長が見込まれています。
市場の成長を牽引する主な要因としては、以下の点が挙げられます。
* 規制当局による大型分子の承認増加。
* バイオ医薬品およびバイオシミラーに対する需要の加速。
* 大手製薬会社が複雑なモダリティへと研究開発の焦点を移していること。
* AIを活用したバイオプロセス最適化による遊休生産能力の活用。
* 新興地域におけるプラグアンドプレイ型のシングルユース施設の導入。
* 資金に制約のあるバイオテクノロジー系スタートアップ企業によるアウトソーシングの増加。
一方で、市場の成長を阻害する要因も存在します。
* CGMP(Current Good Manufacturing Practice)およびバリデーションに関する負担の増大。
* 樹脂や原材料のサプライチェーンの不安定性。
* バイオプロセスエンジニアの人材不足。
* 大規模バイオリアクター設備のリードタイムの長期化。
市場は、サービス、供給源、分子タイプ、エンドユーザー、および地域によって詳細にセグメント化されています。
* サービス別: 契約開発(細胞株開発、プロセス開発)と契約製造(前臨床、臨床、商業生産)に分けられます。特に、細胞株開発やプロセス開発を含む契約開発は、2030年まで年平均成長率14.1%で最も急速に成長する分野と予測されており、その重要性が増しています。
* 供給源別: 哺乳類細胞、微生物、昆虫・植物由来のシステムに分類されます。
* 分子タイプ別: モノクローナル抗体、二重特異性抗体およびフラグメント、組換えタンパク質、ワクチン、細胞・遺伝子治療、RNA治療薬など、多岐にわたる分子タイプが対象です。
* エンドユーザー別: 製薬・バイオテクノロジー企業、研究機関・学術機関が主な顧客層です。
* 地域別: 北米、欧州、アジア太平洋、中東・アフリカ、南米に区分され、世界の主要地域における17カ国の市場規模とトレンドが推定されています。特にアジア太平洋地域は、Samsung BiologicsやLotte Biologicsによる大規模な設備投資、政府の積極的なインセンティブ、そしてモジュール型施設の出現により、最も魅力的な成長軌道を描くと見なされています。
技術面では、デジタルツイン、AI駆動のプロセス制御、大規模シングルユースバイオリアクターなどの先進技術が、収率向上、バッチ不良削減、技術移転期間短縮に大きく貢献し、CDMOの競争優位性を高めています。規制面では、改訂されたEU GMP Annex 1のような厳格なcGMP要件がコンプライアンスコストを増加させる一方で、高度な汚染管理システムを持つ経験豊富なプロバイダーに有利に働いています。
競争環境については、市場集中度、市場シェア分析、およびLonza Group、Samsung Biologics、WuXi Biologics、Thermo Fisher Scientific、Catalentなど、主要なグローバル企業のプロファイル(事業概要、財務、製品・戦略、最近の動向を含む)が詳細に分析されています。
本レポートは、市場の機会と将来の展望についても評価しており、未開拓の分野や満たされていないニーズを特定することで、今後の市場戦略策定に資する情報を提供しています。

1. 序論
- 1.1 調査の前提と市場の定義
- 1.2 調査範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場概況
- 4.1 市場概要
-
4.2 市場の推進要因
- 4.2.1 規制主導型の大分子承認
- 4.2.2 バイオ医薬品およびバイオシミラーの需要加速
- 4.2.3 大手製薬会社のR&Dが複雑なモダリティへシフト
- 4.2.4 AIを活用したバイオプロセス最適化による遊休能力の解放
- 4.2.5 新興地域におけるプラグアンドプレイ型シングルユース施設
- 4.2.6 資金制約のあるバイオテックスタートアップによるアウトソーシングの増加
-
4.3 市場の阻害要因
- 4.3.1 CGMP/バリデーション負担の増大
- 4.3.2 不安定な樹脂および原材料のサプライチェーン
- 4.3.3 バイオプロセスエンジニアの人材不足
- 4.3.4 大規模バイオリアクター装置の長いリードタイム
- 4.4 サプライチェーン分析
- 4.5 規制環境
- 4.6 技術的展望
-
4.7 ポーターの5つの力分析
- 4.7.1 供給者の交渉力
- 4.7.2 買い手の交渉力
- 4.7.3 新規参入の脅威
- 4.7.4 代替品の脅威
- 4.7.5 競争上の対抗関係
5. 市場セグメンテーション
-
5.1 サービス別
- 5.1.1 契約開発
- 5.1.1.1 細胞株開発
- 5.1.1.2 プロセス開発
- 5.1.2 契約製造
- 5.1.2.1 前臨床
- 5.1.2.2 臨床
- 5.1.2.3 商業
-
5.2 供給源別
- 5.2.1 哺乳類
- 5.2.2 微生物
- 5.2.3 昆虫および植物由来
-
5.3 分子タイプ別
- 5.3.1 モノクローナル抗体
- 5.3.2 二重特異性抗体およびフラグメント
- 5.3.3 組換えタンパク質
- 5.3.4 ワクチン
- 5.3.5 細胞・遺伝子治療
- 5.3.6 RNA治療薬
-
5.4 エンドユーザー別
- 5.4.1 製薬・バイオテクノロジー企業
- 5.4.2 研究機関および学術機関
-
5.5 地域別
- 5.5.1 北米
- 5.5.1.1 米国
- 5.5.1.2 カナダ
- 5.5.1.3 メキシコ
- 5.5.2 欧州
- 5.5.2.1 ドイツ
- 5.5.2.2 英国
- 5.5.2.3 フランス
- 5.5.2.4 イタリア
- 5.5.2.5 スペイン
- 5.5.2.6 その他の欧州
- 5.5.3 アジア太平洋
- 5.5.3.1 中国
- 5.5.3.2 日本
- 5.5.3.3 インド
- 5.5.3.4 韓国
- 5.5.3.5 オーストラリア
- 5.5.3.6 その他のアジア太平洋
- 5.5.4 中東・アフリカ
- 5.5.4.1 GCC
- 5.5.4.2 南アフリカ
- 5.5.4.3 その他の中東・アフリカ
- 5.5.5 南米
- 5.5.5.1 ブラジル
- 5.5.5.2 アルゼンチン
- 5.5.5.3 その他の南米
6. 競合情勢
- 6.1 市場集中度
- 6.2 市場シェア分析
-
6.3 企業プロファイル (グローバルレベルの概要、市場レベルの概要、主要セグメント、財務、戦略情報、市場ランク/シェア、製品・サービス、および最近の動向を含む)
- 6.3.1 ロンザグループ
- 6.3.2 サムスンバイオロジクス
- 6.3.3 ウーシーバイオロジクス
- 6.3.4 サーモフィッシャーサイエンティフィック
- 6.3.5 カタレント
- 6.3.6 レンチュラーバイオファーマ
- 6.3.7 AGCバイオロジクス
- 6.3.8 富士フイルムダイオシンス
- 6.3.9 ベーリンガーインゲルハイム
- 6.3.10 ジークフリート
- 6.3.11 レシファーム
- 6.3.12 キュリア
- 6.3.13 KBIバイオファーマ
- 6.3.14 シンジェンインターナショナル
- 6.3.15 ロッテバイオロジクス
- 6.3.16 アブゼナ
- 6.3.17 ジャスト – エボテックバイオロジクス
- 6.3.18 ミリポアシグマ
- 6.3.19 ユーロフィンサイエンティフィック
7. 市場機会と将来展望
*** 本調査レポートに関するお問い合わせ ***

高分子医薬品CDMOとは、バイオ医薬品、核酸医薬品、遺伝子治療薬、細胞治療薬といった複雑な構造を持つ高分子医薬品の開発から製造までを一貫して受託する専門企業を指します。CDMOはContract Development and Manufacturing Organizationの略であり、医薬品開発におけるプロセス開発、分析法開発、治験薬製造、そして商業生産に至るまで、幅広いサービスを提供します。特に高分子医薬品は、低分子医薬品と比較して分子量が大きく、構造が複雑で、製造プロセスも高度な技術と専門知識を要するため、これに特化したCDMOの存在は、製薬企業にとって不可欠なパートナーとなっています。製薬企業は、自社で大規模な製造設備や専門人材を抱えることなく、CDMOの専門性と設備を活用することで、開発期間の短縮、コスト削減、そして市場投入までのリスク低減を図ることが可能となります。
高分子医薬品CDMOが取り扱う医薬品の種類は多岐にわたります。主なものとしては、抗体医薬品(モノクローナル抗体、二重特異性抗体など)、核酸医薬品(アンチセンス、siRNA、mRNA、アプタマーなど)、遺伝子治療薬(アデノ随伴ウイルス(AAV)やレンチウイルスなどのウイルスベクター、非ウイルスベクター)、細胞治療薬(CAR-T細胞療法、iPS/ES細胞由来の治療薬など)、組換えタンパク質、そしてワクチン(組換えタンパク質ワクチン、ウイルスベクターワクチン、mRNAワクチンなど)が挙げられます。CDMOが提供するサービスも、これらの医薬品の種類に応じて専門化されています。具体的には、細胞株開発、培養プロセス開発、精製プロセス開発といった原薬製造プロセスの最適化、品質管理のための分析法開発とバリデーション、無菌製剤化を含む製剤開発、そして治験薬製造から商業生産に至るまでのGMP(Good Manufacturing Practice)に準拠した製造サービスが含まれます。さらに、各国の規制当局への申請支援といったレギュラトリーサポートも重要なサービスの一つです。
高分子医薬品は、その高い特異性と有効性から、がん、自己免疫疾患、感染症、希少疾患、遺伝性疾患、神経変性疾患など、これまで治療が困難であった多くの疾患領域で画期的な治療法を提供しています。例えば、抗体医薬品は特定のがん細胞を標的としたり、免疫反応を調節したりすることで、副作用を抑えつつ高い治療効果を発揮します。核酸医薬品は、疾患の原因となる遺伝子の発現を抑制したり、新たな遺伝子を導入したりすることで、根本的な治療を目指します。遺伝子治療薬や細胞治療薬は、遺伝子異常や細胞機能不全に直接アプローチし、一度の治療で長期的な効果が期待されるものもあります。製薬企業が高分子医薬品CDMOを利用する主な理由は、これらの複雑な医薬品の開発・製造には高度な専門知識、特殊な設備、そして厳格な品質管理体制が不可欠であるためです。CDMOは、これらの要件を満たすことで、製薬企業が研究開発に集中できる環境を提供し、新薬の迅速な市場投入を支援します。
高分子医薬品の開発・製造には、多岐にわたる最先端技術が不可欠です。プロセス開発においては、高生産性細胞株の樹立技術(例:CHO細胞)、シングルユースバイオリアクターを含む培養技術、そしてクロマトグラフィー(アフィニティークロマトグラフィー、イオン交換クロマトグラフィーなど)や限外ろ過・透析ろ過(UF/DF)といった高度な精製技術が用いられます。分析技術では、質量分析、高速液体クロマトグラフィー(HPLC)、キャピラリー電気泳動、ELISA、qPCR、フローサイトメトリーなどを用いて、医薬品の構造、純度、力価、安全性などを詳細に評価します。製剤化においては、凍結乾燥技術や無菌充填技術が重要です。特に遺伝子治療薬や細胞治療薬の分野では、ウイルスベクターの製造技術、細胞培養・増殖技術、凍結保存技術などが専門的に発展しています。近年では、プロセス分析技術(PAT)やデータ解析、AI/機械学習を活用したプロセス最適化、自動化技術の導入も進んでおり、製造効率と品質の一層の向上に貢献しています。
高分子医薬品CDMO市場は、近年急速な成長を遂げています。この成長の背景には、いくつかの主要な要因があります。第一に、バイオ医薬品や再生医療等製品、核酸医薬品といった高分子医薬品の研究開発投資が世界的に増加していることです。これらの医薬品は、従来の低分子医薬品では治療が困難であった疾患に対して画期的な効果をもたらす可能性を秘めており、製薬企業の開発パイプラインにおいて重要な位置を占めています。第二に、高分子医薬品の製造は、その複雑な構造と生物学的特性から、高度な専門知識、特殊な設備、そして厳格な品質管理体制を必要とします。多くの製薬企業、特にバイオベンチャーは、これらの要件を自社で全て満たすことが困難であるため、専門的なCDMOへのアウトソーシングを選択する傾向が強まっています。第三に、COVID-19パンデミックは、mRNAワクチンなどの迅速な開発と大量生産の必要性を浮き彫りにし、CDMOの重要性を一層高めました。これらの要因が複合的に作用し、高分子医薬品CDMO市場は今後も拡大を続けると予測されています。
高分子医薬品CDMO市場の将来は、非常に明るいと見られています。今後も、遺伝子治療薬、細胞治療薬、mRNA医薬品、抗体薬物複合体(ADC)、多重特異性抗体などの分野で、新たな技術革新と医薬品開発が加速すると予想されます。これに伴い、CDMOには、より高度で多様な製造技術と専門知識が求められるようになるでしょう。特に、個別化医療の進展に伴い、少量多品種生産への対応や、製造プロセスの柔軟性、迅速性が一層重要になります。また、AIや機械学習を活用したプロセス最適化、連続生産技術の導入、デジタルツインの活用など、スマートファクトリー化の推進も期待されます。CDMO間の競争は激化する一方で、特定の技術や疾患領域に特化した専門性の高いCDMOの需要も高まるでしょう。グローバルなサプライチェーンの強化や、環境負荷の低い持続可能な製造プロセスの開発も、今後の重要な課題となります。高分子医薬品CDMOは、革新的な医薬品を患者さんに届ける上で、ますますその役割を拡大していくことでしょう。