レーザーキャプチャーマイクロダイセクション市場:市場規模・シェア分析、成長動向・予測 (2025-2030年)
レーザーキャプチャーマイクロダイセクション市場は、製品(機器など)、システムタイプ(紫外線LCMなど)、用途(研究開発[ゲノミクス、プロテオミクス]など)、エンドユーザー(学術・政府研究機関など)、および地域(北米、欧州、アジア太平洋、中東・アフリカ、南米)によってセグメント化されています。市場予測は、金額(米ドル)で提供されます。

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
レーザーキャプチャーマイクロダイセクション(LCM)市場の概要:成長トレンドと予測(2025年~2030年)
市場規模と成長分析
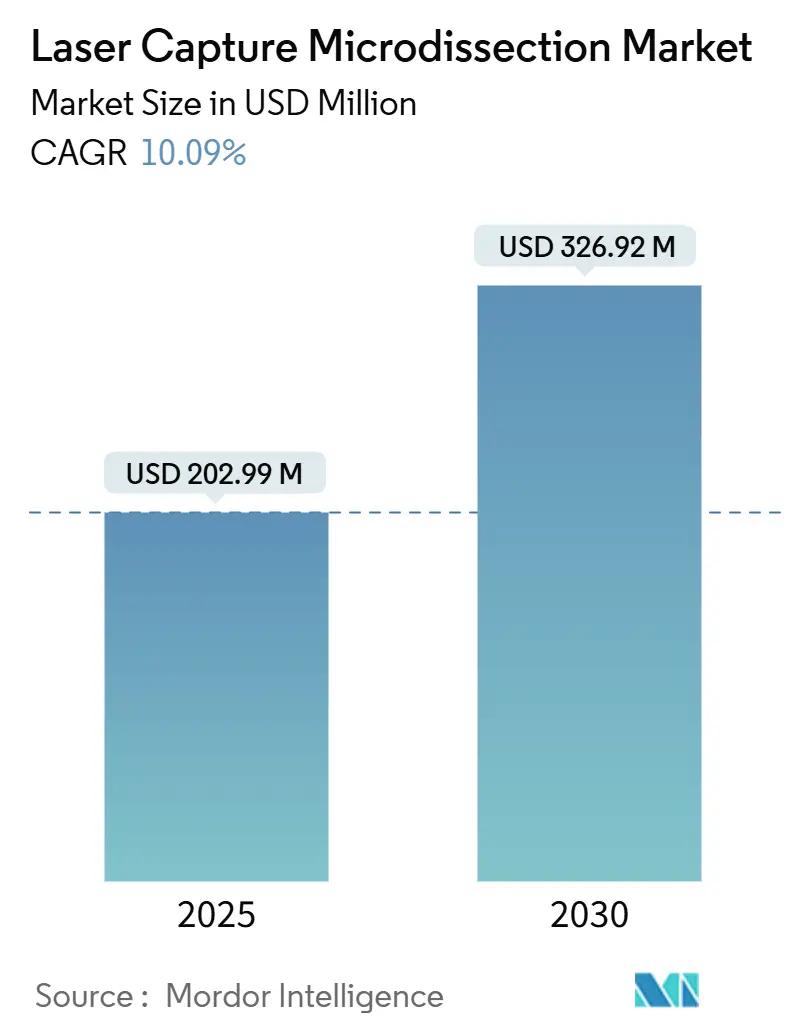
レーザーキャプチャーマイクロダイセクション(LCM)市場は、2025年には2億299万米ドルと推定され、2030年には3億2692万米ドルに達し、予測期間(2025年~2030年)中に年平均成長率(CAGR)10.09%で成長すると予測されています。この技術は、組織病理学と分子生物学を結びつけ、科学者が空間的文脈を保護しながら正確な細胞群を抽出することを可能にし、マルチオミクス研究への需要を高めています。人工知能(AI)は空間生物学のワークフローに組み込まれ、ターゲット認識の自動化と分析サイクルの短縮に貢献しています。製薬・バイオテクノロジー企業は、混合組織切片から腫瘍細胞を分離するためにLCMプラットフォームを導入し、バイオマーカー発見と薬剤応答プロファイリングを加速させています。消耗品は、キャプチャーフィルムや試薬の継続的な購入が高スループット研究を支えるため、牽引力を増しています。また、DNAやタンパク質のより穏やかな処理のために赤外線システムが好まれています。アジア太平洋地域は、中国、日本、インドにおける政府プログラムが新たな空間オミクス研究センターを構築しているため、最も急速な拡大を記録していますが、北米は成熟した研究資金と早期のAI導入によりリーダーシップを維持しています。
主要なレポートのポイント
* 製品別: 2024年には機器がLCM市場シェアの44.35%を占めましたが、消耗品は2030年までにCAGR 13.23%で成長すると予測されています。
* システムタイプ別: 2024年には紫外線(UV)プラットフォームが収益シェアの52.11%を占めましたが、赤外線(IR)システムは2030年までに最も速いCAGR 15.61%で成長すると予想されています。
* アプリケーション別: 2024年には研究開発がLCM市場規模の61.41%を占めましたが、診断は同期間にCAGR 11.32%で拡大すると見込まれています。
* エンドユーザー別: 2024年には学術・政府研究機関がLCM市場規模の43.63%を占めましたが、製薬・バイオテクノロジー企業およびCROはCAGR 11.89%の成長が見込まれています。
* 地域別: 2024年には北米がLCM市場シェアの42.82%を占めましたが、アジア太平洋地域は2030年までにCAGR 13.44%で成長すると予測されています。
市場のトレンドと洞察
成長要因:
* 腫瘍学および神経学における研究開発費の増加: がんや神経変性疾患の負担が増大するにつれて、LCMは学術および商業研究室の主要なツールとなっています。中国や日本の助成金は、シングルセルゲノミクスにLCMを利用する国家的な空間オミクスハブを支援しています。製薬企業も競争力のある薬剤パイプラインのためにLCMを研究契約に組み込んでおり、これが長期的な成長を支えています。
* 手動マイクロダイセクションに対する技術的優位性: LCMは、隣接する細胞間のクロストークのリスクがある手動メス法とは異なり、汚染のないセクションを一貫して生成します。RNAの完全性保持は、シングルセル転写解析において重要であり、自動化はオペレーターのバイアスを排除し、再現性を向上させます。
* 空間オミクスおよびシングルセルマルチオミクスワークフローの急増: LCMと空間トランスクリプトミクスを組み合わせることで、研究者は生体組織構造に対する遺伝子発現をマッピングできます。マルチオミクス設計は、最大5つの分子層をin situでプロファイリングでき、LCMは処理全体で空間的忠実性を維持します。
* 精密医療バイオマーカー発見プログラムの成長: 規制当局はコンパニオン診断を重視しており、企業は純粋な細胞集団からバイオマーカーアッセイを開始するためにLCMを使用するよう促されています。LCMは、バイオマーカーの状態と治療結果を関連付けるための臨床試験プロトコルに組み込まれています。
* AIガイドによる自動化: AIはターゲット認識を自動化し、分析サイクルを短縮することで、LCMワークフローの効率を向上させています。
* マイクロ流体-LCMハイブリッド: マイクロ流体技術との統合により、LCMの機能がさらに拡張され、より効率的な細胞分離と分析が可能になります。
阻害要因:
* 統合システムの高い初期費用と維持費用: LCMワークステーションは高価であり、多くの研究室にとって導入が困難です。年間サービス契約も高額であり、予算の制約がある機関では共有施設を利用せざるを得ず、スループットが低下します。
* 病理学者および熟練した技術者の不足: 特に低所得地域では、病理学者の数が不足しており、LCMスイートを運営するための熟練したスタッフの確保が困難です。労働集約的なマイクロダイセクションプロトコルは、多忙なスタッフにとって負担となります。
* 熱/UV誘発性の核酸損傷: 紫外線(UV)システムや一部の熱ベースのシステムでは、核酸に損傷を与えるリスクがあり、下流のオミクス解析の品質に影響を与える可能性があります。
* 競合する液滴ベースのシングルセルプラットフォーム: 液滴ベースのシングルセル解析プラットフォームは、LCMの代替となり得る競合技術であり、特に北米やヨーロッパで普及が進んでいます。
セグメント分析
* 製品別: 消耗品は、高スループットパイプラインがキャプチャーフィルム、スライド、試薬の継続的な供給を必要とするため、2030年までにCAGR 13.23%で最も急速に成長するカテゴリーです。機器は2024年にLCM市場シェアの44.35%を維持しましたが、サブスクリプション型の注文モデルへの移行は、長期的なワークフローの一貫性に焦点を当てた成熟した購入者層を示唆しています。ソフトウェアとサービスは売上高は小さいものの、マイクロダイセクションハードウェアを下流のシーケンシングやバイオインフォマティクスにリンクさせるターンキーエコシステムを求める購入者が増えているため、その関連性が高まっています。
* システムタイプ別: 紫外線(UV)システムは2024年に52.11%の収益を占めましたが、赤外線(IR)プラットフォームは、DNAやタンパク質を下流のオミクス解析のために保護する穏やかな熱特性により、年間15.61%の成長が予測されています。IRデバイスは細胞をよりきれいに捕捉するため、エラーのないライブラリを求めるシングルセルパイプラインに適しています。UVシステムは、従来の組織学とマイクロダイセクションを組み合わせる教育病院など、形態学的保存が不可欠な場所で依然として人気があります。
* アプリケーション別: 研究開発は2024年にLCM市場全体の61.41%を占めましたが、病理学研究室が空間生物学を日常的なワークフローに統合するにつれて、診断用途はCAGR 11.32%で成長しています。コンパニオン診断薬の開発は、機器の設置に共同出資する製薬スポンサーからの需要を牽引しています。腫瘍病理学は、腫瘍の不均一性が純粋な細胞集団を評価しない限りバイオマーカーを不明瞭にするため、診断設置を支配しています。
* エンドユーザー別: 学術・政府機関は2024年に43.63%のシェアを占め、助成金による購入やオープンアクセスの中核施設を反映しています。しかし、製薬・バイオテクノロジー企業およびCROは、提出パッケージに空間的に分解されたバイオマーカーを含めるという規制圧力に後押しされ、CAGR 11.89%を記録すると予想されています。病院は主にがん診断と移植免疫学において中程度の貢献者です。
地域分析
* 北米: 2024年にはLCM市場シェアの42.82%を維持し、国立衛生研究所(NIH)からの継続的な資金提供と成熟した製薬研究開発クラスターに支えられています。デジタル病理学の普及はワークフロー統合を簡素化し、AI支援マイクロダイセクションは労働力のボトルネックを軽減します。
* ヨーロッパ: 精密医療研究を支援する官民連携プログラムにより、2番目に大きな地域となっています。ドイツ、英国、フランスには複数のLCM中核施設があり、機器の利用率を向上させています。
* アジア太平洋: 2030年までに最も速いCAGR 13.44%を記録すると予測されています。中国の五カ年計画は空間生物学を優先し、大規模な研究室建設と大量購入契約を促しています。日本の研究機関は、高忠実度赤外線マイクロダイセクションに依存する腫瘍学および神経変性研究を追求しています。
競争環境
LCM市場は中程度の集中度を示しています。Carl Zeiss MeditecとDanaherのLeica Microsystemsは、深い顕微鏡専門知識と世界的なサポートネットワークを活用して、高い導入基盤を維持しています。Thermo Fisher Scientificは、マイクロダイセクションと下流のシーケンシングキットをバンドルし、エンドツーエンドのワークフローを提供しています。Molecular Machines & IndustriesとFluidigmは、自動化の深さとマルチオミクス互換性に焦点を当て、専門的なニッチ市場を開拓しています。競争は現在、レーザー出力だけでなく、ソフトウェア、画像分析、ワークフローオーケストレーションに集中しています。ベンダーのロードマップは、マイクロ流体統合、クラウド接続分析、モジュラー消耗品エコシステムに収束しています。企業は診断用途向けのプラットフォーム認証を急いでおり、規制当局の承認が臨床検査室への収益シフトをもたらす可能性があると予測しています。
最近の業界動向
* 2025年1月: Leica BiosystemsとIndica Labsは、LeicaのAperioスキャナー技術とIndicaのHALO APソフトウェアを組み合わせた統合デジタル病理学プラットフォームを構築するための戦略的投資を発表しました。これは、AI対応のコンパニオン診断機能を強化し、LCMをサンプル調製に利用するバイオマーカー発見プログラムを支援します。
* 2024年10月: BDは、シングルセル発見研究を自動化するための高スループットでロボット対応の試薬キットの新ファミリーを発表しました。これには、HamiltonのMicrolab NGS STARプラットフォームと連携したBD® OMICS-One XT WTAアッセイが含まれ、LCMアプリケーションを補完する標準化されたワークフローへの高まる需要に対応します。
* 2024年7月: Danaher Corporationは、スタンフォード大学とのBeaconsプログラムを通じて、がん薬物スクリーニング向けの次世代スマート顕微鏡技術を開発するための研究協力に着手しました。これは、空間生物学とAI機能を組み合わせ、LCMワークフローの精度と自動化を向上させます。
* 2024年5月: 日立ハイテク株式会社は、Rocheとのパートナーシップを少なくとも10年間延長し、LCMを含む高度なサンプル調製技術を必要とする精密医療アプリケーションに影響を与える診断イノベーションにおける協力を強化しました。
本レポートは、レーザーキャプチャーマイクロダイセクション(LCM)市場の詳細な分析を提供しています。LCM市場は、単一細胞または特定の組織領域を選択的に分離し、下流の分子解析に用いるスタンドアロンのLCM装置、バンドルされたソフトウェア、およびブランド消耗品の販売から生じる世界的な収益を対象としています。
市場の成長を牽引する主な要因としては、腫瘍学および神経学分野における公的・民間部門の研究開発費の増加が挙げられます。また、手動マイクロダイセクションと比較した技術的優位性、空間オミクスおよびシングルセルマルチオミクスワークフローの急増、精密医療バイオマーカー発見プログラムの拡大も重要な推進力となっています。さらに、AIガイド画像認識による完全自動LCMの実現や、ハイスループットサンプル調製のためのマイクロ流体LCMハイブリッドの登場も市場を活性化させています。
一方で、市場の成長を抑制する要因も存在します。統合システムの高い初期費用と維持費用(50万ドルを超える場合も多い)は、特に小規模な研究室や新興市場における導入の障壁となっています。病理学者や訓練された技術者の不足、デリケートなサンプルにおける熱やUVによる核酸損傷のリスク、そして液滴ベースのシングルセル分離プラットフォームとの競合も課題として挙げられています。
市場は製品、システムタイプ、用途、エンドユーザー、地域別に詳細に分析されています。
製品別では、装置、消耗品、ソフトウェア&サービスに分類され、特に消耗品セグメントはハイスループットプロトコルの普及により、年平均成長率(CAGR)13.23%で最も急速に拡大すると予測されています。
システムタイプ別では、紫外線LCM、赤外線LCM、免疫蛍光ガイドLCM、LMPC(Laser Microdissection Pressure-Catapulting)があり、赤外線システムは熱損傷を最小限に抑え、DNAやタンパク質の保存を改善する利点から、2030年までにCAGR 15.61%で成長すると見込まれています。
用途別では、研究開発(ゲノミクス、プロテオミクス)、診断(腫瘍学、病理学、細胞病理学)、法医学などが含まれます。
エンドユーザー別では、学術・政府研究機関、病院、製薬・バイオテクノロジー企業・CRO、法医学研究所が主要な顧客層です。
地域別では、北米が2024年に42.82%の市場シェアを占め、NIHからの強力な資金提供と成熟した製薬活動により市場をリードしています。一方、アジア太平洋地域は、中国、日本、インドにおける国家精密医療イニシアチブに牽引され、2025年から2030年にかけてCAGR 13.44%で最も速い成長を遂げると予測されています。
競合環境においては、Carl Zeiss Meditec AG、Danaher Corp (Leica Microsystems)、Thermo Fisher Scientific Inc.、Molecular Machines & Industries GmbHなどが主要な市場プレイヤーとして挙げられています。
本レポートの調査は、病理学者や空間オミクス研究者などへのインタビューを含む一次調査と、NIH RePORTER、FDA 510(k)サマリー、PubMedなどの公開データセット、D&B Hoovers、Dow Jones Factivaなどの有料リソースを用いた二次調査を組み合わせて実施されています。市場規模の算出と予測は、世界の病理学およびライフサイエンスR&D支出を基にしたトップダウンアプローチと、サプライヤーの収益集計などによるボトムアップチェックを併用し、毎年更新される検証済みの取引価格に基づいて行われており、高い信頼性を確保しています。
レーザーキャプチャーマイクロダイセクション市場は、がんや神経学分野での研究開発の活発化、技術革新、そして精密医療の進展により、今後も堅調な成長が期待されています。特に消耗品と赤外線システムが市場を牽引し、アジア太平洋地域が新たな成長エンジンとなるでしょう。

1. はじめに
- 1.1 調査の前提と市場の定義
- 1.2 調査範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場概況
- 4.1 市場概要
- 4.2 市場の推進要因
- 4.2.1 腫瘍学および神経学における官民の研究開発費の増加
- 4.2.2 手動マイクロダイセクションに対する技術的優位性
- 4.2.3 空間オミクスおよび単一細胞マルチオミクスワークフローの急増
- 4.2.4 精密医療バイオマーカー発見プログラムの成長
- 4.2.5 AIガイド画像認識による完全自動LCMの実現
- 4.2.6 ハイスループットサンプル調製のためのマイクロ流体LCMハイブリッドの出現
- 4.3 市場の阻害要因
- 4.3.1 統合システムの高い初期費用と維持費用
- 4.3.2 組織学研究室における病理医および訓練された技術者の不足
- 4.3.3 デリケートなサンプルにおける熱/UV誘発核酸損傷のリスク
- 4.3.4 ドロップレットベースの単一細胞分離プラットフォームとの競合
- 4.4 ポーターの5つの力分析
- 4.4.1 新規参入の脅威
- 4.4.2 買い手の交渉力
- 4.4.3 供給者の交渉力
- 4.4.4 代替品の脅威
- 4.4.5 競争上の対抗関係
5. 市場規模と成長予測(米ドル建て)
- 5.1 製品別
- 5.1.1 機器
- 5.1.2 消耗品
- 5.1.3 ソフトウェア&サービス
- 5.2 システムタイプ別
- 5.2.1 紫外線LCM
- 5.2.2 赤外線LCM
- 5.2.3 免疫蛍光誘導LCM
- 5.2.4 LMPC (レーザーマイクロダイセクション圧力カタパルト)
- 5.3 用途別
- 5.3.1 研究開発
- 5.3.1.1 ゲノミクス
- 5.3.1.2 プロテオミクス
- 5.3.2 診断
- 5.3.2.1 腫瘍学
- 5.3.2.2 病理学および細胞病理学
- 5.3.3 法医学およびその他
- 5.4 エンドユーザー別
- 5.4.1 学術・政府研究機関
- 5.4.2 病院
- 5.4.3 製薬・バイオテクノロジー企業およびCRO
- 5.4.4 法医学研究所
- 5.5 地域別
- 5.5.1 北米
- 5.5.1.1 米国
- 5.5.1.2 カナダ
- 5.5.1.3 メキシコ
- 5.5.2 欧州
- 5.5.2.1 ドイツ
- 5.5.2.2 英国
- 5.5.2.3 フランス
- 5.5.2.4 イタリア
- 5.5.2.5 スペイン
- 5.5.2.6 その他の欧州
- 5.5.3 アジア太平洋
- 5.5.3.1 中国
- 5.5.3.2 日本
- 5.5.3.3 インド
- 5.5.3.4 オーストラリア
- 5.5.3.5 韓国
- 5.5.3.6 その他のアジア太平洋
- 5.5.4 中東・アフリカ
- 5.5.4.1 GCC
- 5.5.4.2 南アフリカ
- 5.5.4.3 その他の中東・アフリカ
- 5.5.5 南米
- 5.5.5.1 ブラジル
- 5.5.5.2 アルゼンチン
- 5.5.5.3 その他の南米
6. 競合情勢
- 6.1 市場集中度
- 6.2 市場シェア分析
- 6.3 企業プロファイル(グローバルレベルの概要、市場レベルの概要、主要セグメント、利用可能な財務情報、戦略情報、主要企業の市場ランキング/シェア、製品・サービス、および最近の動向を含む)
- 6.3.1 Carl Zeiss Meditec AG
- 6.3.2 Danaher Corp (Leica Microsystems)
- 6.3.3 Thermo Fisher Scientific Inc.
- 6.3.4 Molecular Machines & Industries GmbH
- 6.3.5 Fluidigm Corp.
- 6.3.6 LLS Rowiak LaserLabSolutions GmbH
- 6.3.7 Molecular Devices LLC
- 6.3.8 Hamilton Thorne Inc.
- 6.3.9 Motic Instruments Inc.
- 6.3.10 MicroSupport Co. Ltd.
- 6.3.11 Epistem Ltd.
- 6.3.12 VitroVivo Biotech LLC
- 6.3.13 Caresbio Laboratory LLC
- 6.3.14 GnomeDX LLC
- 6.3.15 Biogenity Ltd.
- 6.3.16 PALM MicroBeam
- 6.3.17 Tecan Group Ltd.
- 6.3.18 Omnit Labs
- 6.3.19 AvanSci Bio
- 6.3.20 NIKON Instruments Inc.
7. 市場機会と将来展望
*** 本調査レポートに関するお問い合わせ ***

レーザーキャプチャーマイクロダイセクション(Laser Capture Microdissection, LCM)は、顕微鏡下で観察される組織切片や細胞培養物などの不均一なサンプルから、特定の細胞や組織領域を精密に分離・回収するための画期的な技術です。この技術は1990年代半ばに開発され、従来の肉眼や手動によるマイクロダイセクションでは困難であった、数細胞から数十細胞といった微細な領域を、周囲の細胞や組織の混入なく正確に採取することを可能にしました。これにより、疾患組織における特定の細胞集団の遺伝子発現、タンパク質発現、遺伝子変異などの分子プロファイルを、より正確に解析することが可能となり、分子生物学研究において純粋な細胞集団を対象とした解析を可能にする重要なツールとして確立されています。
LCMシステムは、主にその細胞回収メカニズムによって二つの主要な方式に大別されます。一つは、旧Arcturus社(現Thermo Fisher Scientific社)が開発した方式で、一般に「IR-LCM(赤外線レーザーキャプチャーマイクロダイセクション)」または「接着式LCM」と呼ばれます。この方式では、低出力の赤外線レーザーを、ターゲット細胞の上に乗せた特殊な熱可塑性フィルム付きのキャップに照射し、フィルムを軟化させてターゲット細胞に選択的に接着させます。その後、キャップを持ち上げることで、接着した細胞のみを回収します。この方式の利点は、細胞への物理的ダメージが少なく、生体分子(DNA、RNA、タンパク質)の完全性を比較的良好に保ちやすい点にあります。もう一つは、Leica Microsystems社が開発した方式で、一般に「UV-LCM(紫外線レーザーマイクロダイセクション)」または「重力落下式LCM」と呼ばれます。この方式では、高出力の紫外線レーザーを用いて、ターゲット細胞の周囲を直接切断し、切断された細胞は重力によって下方に設置された回収チューブに落下し、回収されます。この方式の利点は、非常にシャープな切断が可能であり、複雑な形状の細胞や組織領域でも高精度に分離できる点です。両方式ともに、それぞれの特性に応じた利点と用途があり、研究目的やサンプル特性に応じて選択されます。
LCMは、その高い細胞選択性から、多岐にわたる生命科学研究および臨床応用において不可欠なツールとなっています。最も主要な応用分野の一つはがん研究です。腫瘍組織からがん細胞、間質細胞、あるいは前がん病変や微小転移巣の細胞を分離し、がんの発生、進展、転移メカニズムの解明、新規バイオマーカーの探索、治療標的の同定に貢献しています。神経科学では、脳組織から特定の神経細胞群やグリア細胞を分離し、神経変性疾患や精神疾患の病態メカニズム解明、脳発達研究に利用されます。発生生物学では、胚発生過程における特定の細胞集団や組織領域を分離し、細胞の運命決定や分化、形態形成に関わる遺伝子ネットワークの解析に用いられます。病理学においては、疾患組織から病変部位の細胞を分離し、診断や予後予測に有用な分子マーカーの探索、個別化医療に向けた治療薬感受性因子の同定などに活用されます。その他、幹細胞研究、感染症研究、法医学など、純粋な細胞集団を必要とするあらゆる分野でその価値を発揮し、生命現象の理解と疾患の克服に大きく貢献しています。
LCMは単独で用いられるだけでなく、他の様々な技術と組み合わせてその価値を最大化します。LCMを行う前には、ターゲット細胞を識別するために組織学的染色法(ヘマトキシリン・エオジン染色など)、特定のタンパク質マーカーを発現する細胞を識別する免疫組織化学(IHC)や免疫蛍光法(IF)、あるいは特定のRNA分子を発現する細胞を識別するin situハイブリダイゼーション(ISH)などが前処理として広く利用されます。細胞分離技術としては、フローサイトメトリー(FACS)が単一細胞懸濁液から細胞を分離するのに対し、LCMは組織の空間的な文脈を保持したまま特定の細胞を分離する点で補完的な関係にあります。LCMで回収された細胞は、その後の様々な分子生物学的解析に供されます。これには、DNAやRNAの特定の配列を増幅・定量するPCR/qPCR、ゲノム、トランスクリプトーム、エピゲノムなど網羅的な遺伝子情報を解析する次世代シーケンシング(NGS)、タンパク質の種類や量を同定・定量する質量分析法(プロテオミクス)、多数の遺伝子の発現レベルを同時に解析するマイクロアレイなどが含まれます。特に微量なサンプルからのNGS解析において、LCMとの組み合わせは非常に強力です。近年発展している空間トランスクリプトミクスや空間プロテオミクスは、組織切片上の分子の空間分布を直接解析する技術であり、LCMが特定の細胞集団を「切り出して」詳細に解析するのに対し、空間オミクスは組織全体の空間情報を「俯瞰する」アプローチとして、互いに補完し合う関係にあります。
レーザーキャプチャーマイクロダイセクションの市場は、精密医療、個別化医療、バイオマーカー探索、および基礎生命科学研究の進展に伴い、着実に成長を続けています。この分野の主要なシステムメーカーは、Arcturusシステムを継承するThermo Fisher Scientific社と、LMDシステムを提供するLeica Microsystems社が二大巨頭として市場を牽引しています。市場のトレンドとしては、より微細な細胞や組織領域を、より迅速かつ効率的に回収できる高精度化と高スループット化、画像認識技術やロボット技術を導入した自動化の進展、回収されたサンプルを直接分子解析に供するためのダウンストリーム解析との統合が挙げられます。また、研究用途だけでなく、病理診断におけるバイオマーカーの特定や、個別化医療における治療効果予測など、臨床応用への拡大も期待されています。空間トランスクリプトミクスなどの新しい空間解析技術の登場により、LCMは、空間情報を持つデータから特定の細胞集団をさらに深く掘り下げるための重要なツールとして、その役割を再定義しつつあります。一方で、高価な装置費用、専門的な操作スキルが必要であること、微量サンプルからの分子解析における技術的なハードル、サンプル前処理における生体分子の劣化リスクなどが課題として挙げられ、これらの克服が今後の市場成長の鍵となります。
レーザーキャプチャーマイクロダイセクション技術は、今後も生命科学研究および臨床応用において重要な役割を担い続けると予想されます。将来展望としては、顕微鏡画像からターゲット細胞を自動的に識別し、最適な切断・回収経路を決定するAIと機械学習の統合が進むでしょう。これにより、操作の自動化、精度向上、解析時間の短縮、そして人為的ミスの削減が実現されます。現在でも数細胞レベルでの回収は可能ですが、より確実に単一細胞を回収し、その後のシングルセルオミクス解析に直接接続できるようなシングルセル解析への対応強化が期待されます。また、サンプルへのダメージを最小限に抑え、生体分子の完全性を最大限に保つためのレーザー技術や回収メカニズムのさらなる改良、さらには生きた細胞を回収し、その後の培養や機能解析に供する非侵襲的・非破壊的アプローチの進化も進む可能性があります。LCM装置自体が、高度なイメージング機能、自動染色機能、さらには回収後のサンプル前処理の一部を統合した多機能化と統合システムへと進化することで、ワークフローが簡素化され、解析の効率が向上するでしょう。臨床病理学における臨床診断への本格的な導入もさらに拡大し、疾患の早期診断、予後予測、個別化された治療戦略の選択に貢献します。空間トランスクリプトミクスなどの技術が組織全体の空間的な分子プロファイルを提供する一方で、LCMは、その中で特に興味深いとされた特定の細胞集団や微小環境を「ピンポイントで深く掘り下げる」役割を担い、両技術が相乗的に機能することで、生命現象のより包括的な理解が進むと期待されます。これらの進展により、LCMは、複雑な生物学的システムにおける細胞の多様性と機能、疾患のメカニズム解明、そして個別化医療の実現に向けた強力な基盤技術として、その重要性を一層高めていくことでしょう。