生細胞カプセル化市場:規模・シェア分析 – 成長トレンドと予測(2025-2030年)
ライブセル封入市場レポートは、製造技術(シンプルドリッピングなど)、ポリマータイプ(アルギン酸など)、アプリケーション(ドラッグデリバリーなど)、細胞源(自己由来など)、封入スケール(マイクロカプセル化など)、エンドユーザー(バイオファーマ・バイオテクノロジー企業など)、地域(北米など)によってセグメント化されています。市場予測は金額(米ドル)で提供されます。

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
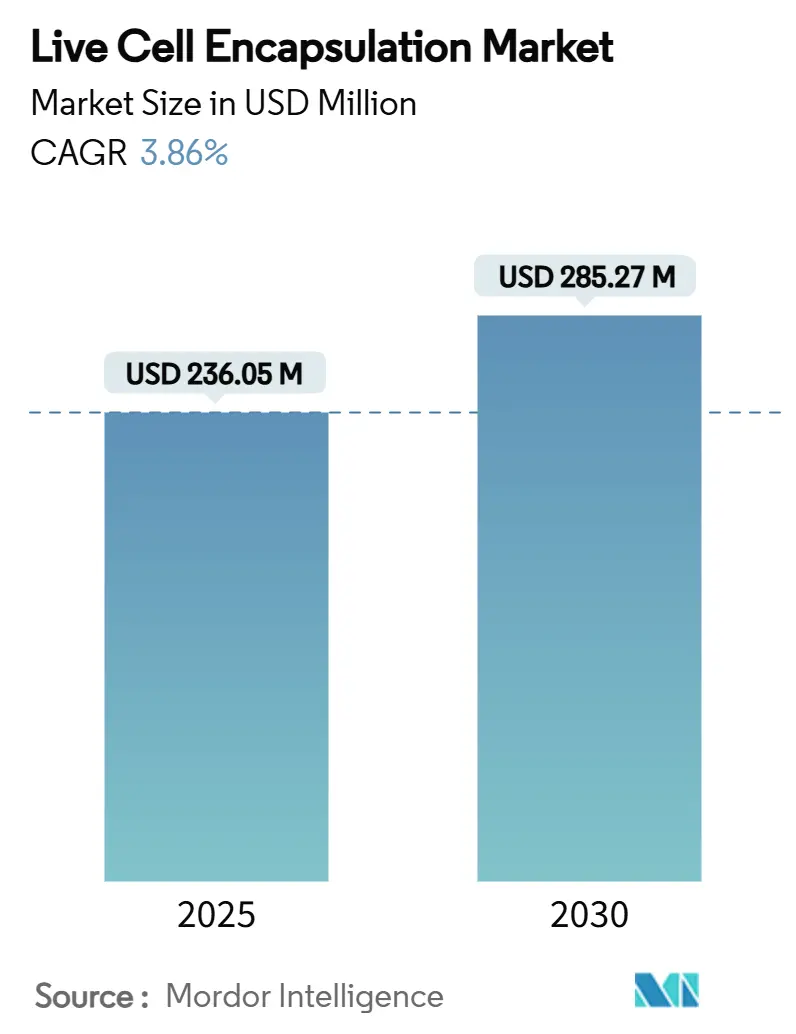
ライブセルカプセル化市場は、2019年から2030年を調査期間とし、2025年には2億3,605万米ドル、2030年には2億8,527万米ドルに達すると予測されており、予測期間中の年平均成長率(CAGR)は3.86%です。地域別では、北米が最大の市場であり、アジア太平洋地域が最も急速に成長しています。市場の集中度は中程度です。主要企業には、ViaCyte Inc.、Living Cell Technologies Limited.、Sigilon Therapeutics Inc.、Sernova Corp.、PharmaCyte Biotech Inc.などが挙げられます。
市場概要
ライブセルカプセル化市場は、研究室段階から規制された商業製品への移行が進み、着実に拡大しています。この成長は、2024年の黄斑部毛細血管拡張症に対するEncelto社のNT-501の承認や、1型糖尿病治療薬VX-880の第III相試験の進展といった画期的な承認によって後押しされています。また、機能性食品に対する消費者の需要の高まりや、日本、欧州連合、北米におけるカプセル化プロバイオティクスの規制承認も市場を牽引しています。バイオ医薬品企業による自動マイクロ流体生産ラインへの投資は、1回あたりの投与コストを30~40%削減し、企業がより多くの患者に対応することを可能にしています。さらに、慢性疾患の有病率の増加と、より効果的で持続的な治療法へのニーズが、ライブセルカプセル化技術の採用を促進しています。これらの要因が相まって、ライブセルカプセル化市場は今後も堅調な成長を続けると予測されます。
このレポートは、生細胞マイクロカプセル化市場に関する詳細な分析を提供しています。生細胞マイクロカプセル化とは、細胞を半透過性のポリマー膜内に固定化する技術であり、細胞代謝に必要な分子の双方向拡散と、生成物の外部拡散を可能にします。同時に、この膜の半透過性により、免疫細胞や抗体がカプセル化された細胞を異物と見なして損傷するのを防ぐことができます。
本レポートでは、市場を製造技術(単純滴下、静電滴下、同軸気流、回転ディスク噴霧など)、ポリマーの種類(アルギン酸、キトサン、シリカ、セルロース硫酸塩など)、用途(薬物送達、再生医療、細胞移植、プロバイオティクス・機能性食品など)、細胞源、カプセル化の規模、エンドユーザー、および地域(北米、ヨーロッパ、アジア太平洋、中東・アフリカ、南米)別に詳細にセグメント化し、世界の主要地域にわたる17カ国の市場規模とトレンドを米ドル(USD)で評価しています。
市場は2030年までに2億8527万米ドルに達すると予測されており、年平均成長率(CAGR)は3.86%で成長する見込みです。
市場の成長を牽引する主な要因としては、バイオテクノロジー研究への官民投資の増加、慢性疾患および変性疾患の負担増大、生体材料およびカプセル化技術の進歩が挙げられます。また、高度な細胞ベース治療法に対する支援的な規制経路、機能性食品・飲料へのカプセル化プロバイオティクスの組み込み、埋め込み型またはウェアラブル送達デバイスとのカプセル化細胞の統合も重要な推進力となっています。
一方で、医薬品グレードの生体材料の入手可能性の制限、高い開発・製造コスト、厳格な規制および品質コンプライアンス要件、遺伝子編集および同種細胞療法代替品との競合が市場の成長を抑制する要因となっています。
製造技術別では、静電滴下法がその実証されたスケーラビリティと規制上の馴染みやすさから、38.54%と最大のシェアを占めています。地域別では、アジア太平洋地域が4.78%のCAGRで最も急速に成長しており、これは中国と日本における好意的な政策改革、広範な臨床試験活動、機能性食品に対する支援的な枠組みに起因しています。用途別では、プロバイオティクスおよび機能性食品分野が6.89%のCAGRで最も力強い成長を示しています。これは、カプセル化がプロバイオティクスの生存率を高め、進化する食品規制の下で健康強調表示を可能にするためです。
高額な生産コストの課題に対しては、業界関係者は専門のCDMO(医薬品開発製造受託機関)へのアウトソーシングを増やし、バッチコストを最大40%削減する自動化技術を導入し、GMPグレードの生体材料を確保するための垂直統合を進めています。主要なカプセル化材料としては、アルギン酸が依然として主要なポリマーですが、セルロース硫酸塩やナノセルロースハイドロゲルは、優れた機械的強度と持続可能性のプロファイルにより、勢いを増しています。
競争環境については、市場集中度、市場シェア分析、およびViaCyte Inc.、Living Cell Technologies Ltd.、Sigilon Therapeutics Inc.、Sernova Corp.、Merck KGaAなどを含む主要企業の詳細なプロファイルが提供されています。レポートはまた、市場の機会と将来の展望、特に未開拓のニーズの評価についても言及しています。

1. はじめに
- 1.1 調査の前提と市場の定義
- 1.2 調査範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場概況
- 4.1 市場概要
-
4.2 市場促進要因
- 4.2.1 バイオテクノロジー研究における官民投資の増加
- 4.2.2 慢性疾患および変性疾患の負担の増加
- 4.2.3 生体材料およびカプセル化技術の進歩
- 4.2.4 高度な細胞ベース治療に対する支援的な規制経路
- 4.2.5 カプセル化プロバイオティクスの機能性食品および飲料への組み込み
- 4.2.6 カプセル化細胞と埋め込み型またはウェアラブル送達デバイスの統合
-
4.3 市場抑制要因
- 4.3.1 医薬品グレードの生体材料の入手可能性の制限
- 4.3.2 高い開発および製造コスト
- 4.3.3 厳格な規制および品質コンプライアンス要件
- 4.3.4 遺伝子編集および同種細胞療法代替品との競合
- 4.4 規制状況
-
4.5 ポーターの5つの力分析
- 4.5.1 新規参入者の脅威
- 4.5.2 買い手の交渉力
- 4.5.3 供給者の交渉力
- 4.5.4 代替品の脅威
- 4.5.5 競争の激しさ
5. 市場規模と成長予測 (金額、米ドル)
-
5.1 製造技術別
- 5.1.1 シンプルな滴下法
- 5.1.2 静電滴下法
- 5.1.3 同軸気流法
- 5.1.4 回転ディスク噴霧法
- 5.1.5 その他の製造技術
-
5.2 ポリマータイプ別
- 5.2.1 アルギン酸
- 5.2.2 キトサン
- 5.2.3 シリカ
- 5.2.4 セルロース硫酸
- 5.2.5 その他のポリマータイプ
-
5.3 用途別
- 5.3.1 薬物送達
- 5.3.2 再生医療
- 5.3.3 細胞移植
- 5.3.4 プロバイオティクス&機能性食品
- 5.3.5 その他の用途
-
5.4 細胞源別
- 5.4.1 自己由来
- 5.4.2 同種異系
- 5.4.3 異種異系
- 5.4.4 遺伝子操作
-
5.5 カプセル化スケール別
- 5.5.1 マイクロカプセル化
- 5.5.2 マクロカプセル化
-
5.6 エンドユーザー別
- 5.6.1 バイオファーマ&バイオテック企業
- 5.6.2 学術・研究機関
- 5.6.3 CROs&CMOs
- 5.6.4 その他のエンドユーザー
-
5.7 地域別
- 5.7.1 北米
- 5.7.1.1 米国
- 5.7.1.2 カナダ
- 5.7.1.3 メキシコ
- 5.7.2 欧州
- 5.7.2.1 ドイツ
- 5.7.2.2 英国
- 5.7.2.3 フランス
- 5.7.2.4 イタリア
- 5.7.2.5 スペイン
- 5.7.2.6 その他の欧州
- 5.7.3 アジア太平洋
- 5.7.3.1 中国
- 5.7.3.2 日本
- 5.7.3.3 インド
- 5.7.3.4 オーストラリア
- 5.7.3.5 韓国
- 5.7.3.6 その他のアジア太平洋
- 5.7.4 中東&アフリカ
- 5.7.4.1 GCC
- 5.7.4.2 南アフリカ
- 5.7.4.3 その他の中東&アフリカ
- 5.7.5 南米
- 5.7.5.1 ブラジル
- 5.7.5.2 アルゼンチン
- 5.7.5.3 その他の南米
6. 競合情勢
- 6.1 市場集中度
- 6.2 市場シェア分析
-
6.3 企業プロファイル(グローバル概要、市場概要、主要事業セグメント、財務、従業員数、主要情報、市場順位、市場シェア、製品およびサービス、および最近の動向の分析を含む)
- 6.3.1 ViaCyte Inc.
- 6.3.2 Living Cell Technologies Ltd.
- 6.3.3 Sigilon Therapeutics Inc.
- 6.3.4 Sernova Corp.
- 6.3.5 PharmaCyte Biotech Inc.
- 6.3.6 Neurotech Pharmaceuticals Inc.
- 6.3.7 Blacktrace Holdings Ltd.
- 6.3.8 Büchi Labortechnik AG
- 6.3.9 Atelerix Ltd.
- 6.3.10 Kadimastem Ltd.
- 6.3.11 Austrianova Pte Ltd.
- 6.3.12 Stem Cell Therapies Australia Pty
- 6.3.13 Microfluidic ChipShop GmbH
- 6.3.14 Sphere Fluidics Ltd.
- 6.3.15 Merck KGaA
- 6.3.16 3P Innovation Ltd.
- 6.3.17 BICO Group AB
- 6.3.18 Corning Incorporated
- 6.3.19 Lonza Group AG
- 6.3.20 Charles River Laboratories Inc.
7. 市場機会と将来展望
*** 本調査レポートに関するお問い合わせ ***

生細胞カプセル化とは、生きた細胞を半透膜でできた微小なカプセルや構造体の中に閉じ込める技術を指します。この技術の主な目的は、細胞を生体外または生体内で保護し、その機能を維持・発揮させることにあります。具体的には、宿主の免疫系からの攻撃を回避し、細胞の生存率を高め、特定の生理活性物質を持続的に放出させることなどが挙げられます。これにより、細胞が本来持つ治療効果や機能性を最大限に引き出し、様々な医療応用やバイオテクノロジー分野での利用が期待されています。カプセルは、細胞と外部環境との間で栄養素や酸素、老廃物の交換を可能にしつつ、免疫細胞や抗体などの侵入を防ぐバリアとして機能します。
生細胞カプセル化には、カプセルのサイズや形状、使用される材料、カプセル化の方法によって様々な種類が存在します。サイズによる分類では、数ミリメートルから数センチメートル程度の比較的大きな「マクロカプセル」と、数十マイクロメートルから数百マイクロメートル程度の「マイクロカプセル」、さらに小さな「ナノカプセル」があります。マクロカプセルは中空繊維型や平板型などがあり、細胞の回収が容易であるという利点があります。一方、マイクロカプセルは生体への移植が容易で、細胞への酸素供給効率が高いという特徴を持ちます。カプセル材料としては、生体適合性が高く、半透膜としての機能を持つ高分子材料が主に用いられます。代表的なものには、海藻由来のアルギン酸、カニの甲羅由来のキトサン、合成高分子であるポリエチレングリコール(PEG)、ポリ乳酸-グリコール酸共重合体(PLGA)、さらにはゼラチンやコラーゲンといった天然高分子などがあります。これらの材料は、細胞毒性が低く、免疫原性が少ないことが求められます。カプセル化の方法としては、エマルション法、押し出し法、静電滴下法、マイクロ流体デバイスを用いた方法などがあり、目的とするカプセルのサイズや均一性に応じて選択されます。
生細胞カプセル化技術は、その多様な特性から幅広い分野での応用が期待されています。最も注目されているのは、再生医療分野です。例えば、糖尿病治療における膵島細胞移植では、カプセル化によって免疫抑制剤の投与を不要にし、拒絶反応のリスクを大幅に低減できる可能性があります。同様に、肝細胞移植や神経細胞移植などにおいても、細胞の生着率向上と機能維持に貢献します。薬物送達システム(DDS)としても利用され、サイトカイン、ホルモン、抗体などの生理活性物質を細胞が持続的に産生・放出することで、標的部位への効率的な薬物送達や、全身投与に伴う副作用の軽減が期待されます。バイオリアクターとしての応用も進んでおり、カプセル化された細胞を用いて、医薬品原料や有用なタンパク質、酵素などを効率的に生産する研究が行われています。また、生体外での毒性試験や薬効評価のための細胞モデルとしても活用され、動物実験の代替や新薬開発の効率化に貢献しています。さらに、食品分野ではプロバイオティクス(乳酸菌など)や機能性成分の保護、化粧品分野では有効成分の安定化と持続的な放出など、多岐にわたる応用が模索されています。
生細胞カプセル化技術の発展は、他の先端技術との融合によって加速されています。ゲノム編集技術(CRISPR/Cas9など)は、カプセル化する細胞自体の機能を強化したり、特定の遺伝子を改変して治療効果を高めたりする可能性を秘めています。例えば、免疫原性を低減させた細胞や、特定の治療物質を過剰に産生するよう改変された細胞をカプセル化することで、より効果的な治療法が開発されるかもしれません。iPS細胞やES細胞といった多能性幹細胞の利用も重要です。これらの幹細胞を分化誘導後にカプセル化することで、倫理的な課題をクリアしつつ、多様な細胞源を安定的に供給できる可能性があります。3Dバイオプリンティング技術は、カプセル化された細胞を精密に配置し、より複雑な組織や臓器構造を構築する上で不可欠な技術となりつつあります。これにより、生体内の微細環境を模倣した機能的な組織の作製が期待されます。また、より生体適合性が高く、長期安定性に優れたカプセル材料の開発も継続的に進められています。生体内で分解されにくい材料や、特定の刺激に応答して機能を発揮する「スマート材料」の研究も活発です。カプセル内の細胞の挙動や生存率をリアルタイムでモニタリングするための高度なイメージング技術も、関連技術として重要視されています。
生細胞カプセル化技術の市場は、再生医療の進展、慢性疾患の増加、個別化医療へのニーズの高まりを背景に、着実に成長を続けています。特に、糖尿病、肝疾患、神経変性疾患などの治療において、免疫抑制剤の副作用を回避しつつ、長期的な治療効果を期待できる点が大きな魅力となっています。主要なプレイヤーとしては、大手製薬企業、バイオベンチャー、医療機器メーカー、そして大学や研究機関が挙げられます。これらの組織が連携し、基礎研究から臨床応用まで幅広い開発を進めています。しかし、市場の拡大にはいくつかの課題も存在します。カプセル材料の生体適合性や長期的な安定性の確保、大量生産技術の確立、そして製造コストの削減は依然として重要な課題です。また、細胞治療製品としての規制当局の承認プロセスは複雑であり、安全性と有効性の厳格な評価が求められます。これらの課題を克服し、標準化された製造プロセスと品質管理体制を確立することが、市場のさらなる成長には不可欠です。
生細胞カプセル化技術の将来は非常に明るく、革新的な医療ソリューションを提供することが期待されています。今後は、患者一人ひとりの状態に合わせた「個別化医療」の実現に向けて、最適な細胞の種類やカプセル材料、カプセル化方法を選択する技術がさらに発展するでしょう。外部からの刺激(光、温度、pHなど)に応答して、特定のタイミングで物質放出を制御できる「スマートカプセル」の開発も進んでいます。これにより、より精密な薬物送達や細胞機能の制御が可能になります。また、複数の種類の細胞や薬剤を同時にカプセル化する「多機能カプセル」の研究も進められており、相乗効果による治療効果の向上が期待されます。AI(人工知能)や機械学習の活用により、最適なカプセル材料の設計や、カプセル化プロセスの自動化・最適化が進むことも予想されます。これにより、製造効率の向上とコスト削減が実現されるでしょう。臨床応用においては、糖尿病以外の様々な疾患への適用が拡大し、より複雑な組織や臓器の再生医療への貢献も期待されます。例えば、人工臓器の代替としての機能性組織の構築など、その可能性は無限大です。一方で、幹細胞利用における倫理的側面や、長期的な安全性に関するさらなる研究も重要であり、社会的な受容性を高めるための議論も継続的に行われることでしょう。生細胞カプセル化技術は、未来の医療を大きく変革する可能性を秘めた、極めて重要な技術分野であると言えます。