医療機器のテストと認証市場の規模と展望、2025-2033

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
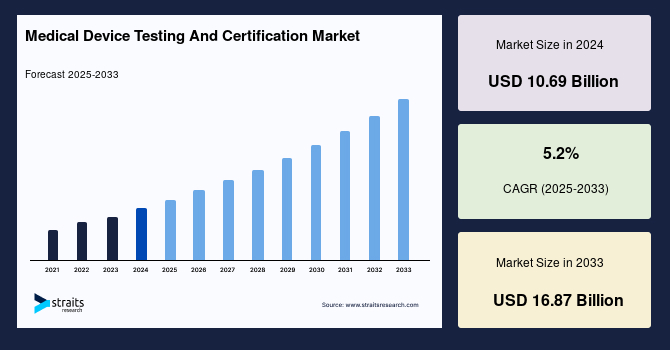
医療機器のテストと認証市場は、2024年に106.9億米ドルの市場規模が評価され、2025年には112.4億米ドル、2033年には168.7億米ドルに達すると予測されており、予測期間(2025-2033年)で年平均成長率(CAGR)5.2%を記録する見込みです。製薬製品および医療機器は、品質保証のための基準に従う必要があります。製品の検証および確認は、製品が意図された目的に沿って効率的に機能することを確保することを目的としています。医療機器の検証および確認の需要の増加、発展途上国での医療機器の消費の増加、基準の調和、厳格な政府規制の導入、医療機器のテストサービスおよび基準のアウトソーシングの傾向の高まりは、予測期間中の医療機器のテストと認証に対する需要を推進すると考えられています。
効果的で文書化された検証および確認活動は、最高品質の設計と生産プロセスを提供するために基本的です。医療機器における誤りの発生率が低下し、再設計の必要が減り、より迅速な生産プロセスが確保されることから、これらの検証および確認に関連する進展は全体的な市場成長を促進しています。医療機器の開発の増加および製品設計やエンジニアリングに関する複雑さの増加は、検証および確認(V&V)サービスの需要を高めています。医療機器は、ソフトウェアの組み込みにより、より小型化かつ複雑化しています。顧客のニーズや要件の複雑さが医療機器をより難解にし、検証および確認の需要を増加させています。また、癌などの慢性疾患の有病率の上昇も、先進技術の開発に対する需要を増加させ、検証および確認の必要性を高めています。検証および確認は過去よりも標準化されており、製造および承認プロセスを合理化しています。これは、自動テストや強力な診断およびデータ収集ツールによってさらに強化されています。これらの要因から、検証および確認プロセスがますます重要になり、市場全体の成長に好影響を与えています。
規格への準拠は、患者の安全を守り、製造業者の評判を維持し、デバイスの悪影響による製品回収の可能性を最小限に抑えるために不可欠です。多くの回収が発生したため、政府および製造業者は医療機器に関するガイドラインを厳格に遵守しています。各国の国家規制当局は、製造業者に対して標準ガイドラインに従い、第三者認証制度によって確認することを求めており、これが医療機器のテストと認証市場を推進し、市場へのアクセスを容易にすることが期待されています。ガイドラインは各国で異なるため、すべての医療機器製造業者は、その特定の国の行政規則を遵守する必要があり、これが認可された第三者にデバイスをリストアップさせる必要性を示しています。したがって、上記の要因から医療機器のテストと認証の需要が増加し、予測期間中の市場全体の成長をさらに促進することになります。
医療機器の標準ガイドラインは、国によって異なり、すべての製造業者が製品を販売またはマーケティングするために遵守しなければならないものです。規制は国によって異なります。アメリカはFDAのガイドラインを遵守し、ヨーロッパはCE承認を重視し、カナダはHealth Canada登録が必要で、インドは中央薬品標準管理機構(CDSCO)の承認を求めています。このような多様な監視環境は、テストと認証市場を活性化させています。企業が異なる国々への販売を増加させたい場合、さまざまな規則と規制の多様性がプロセスを妨げ、高コストかつ煩雑になります。また、特に国内での過剰な規制は、これらの医療機器の地元の革新を妨げる障害ともなり得ます。新技術が長期的で高コストなライセンス手続きを受ける必要があるため、国内の革新を阻害する可能性があります。過剰な規制は、医療機器の製造コストに加えて、必要な時間と費用も増加させます。したがって、過剰な規制や異なる国における規制の違いなど、これらの要因は、医療機器を世界的に展開する上での課題となり、市場全体の成長を妨げています。
製造業者は、厳しい規制に準拠する必要があるため、テストと認証に多くの投資を行っています。また、大手製薬およびバイオ製薬企業は、さまざまな慢性疾患に対する効果的な治療を提供するために多数の治療法や医療機器の開発に注力しているため、医療機器のテストと認証サービスの需要は今後増加する見込みです。このような発展から、医療機器のテスト会社は、分野のカバレッジを広げるために買収を行っていることが明らかです。彼らは医療機器のテストサービスにおける戦略的投資に継続的に関与しており、市場全体の成長のために大きな機会を生み出しています。
北米は最大の市場シェアを占めており、予測期間中に年平均成長率4.3%で成長すると見込まれています。アメリカでは、食品医薬品局(FDA)が医療機器のテストと認証のプロセスを規制しています。2019年2月、FDAは医療機器の開発および市場前通知のための省略510(k)プログラムを拡大するガイダンスを発表しました。この拡大されたガイダンスにより、510(k)適格デバイスの製造業者は、FDAが特定した性能基準を満たすことにより、クリアランスを取得できる新たな承認経路が整備されました。2019年9月には、FDAは特定のデバイスに関する性能基準およびテスト方法を特定するいくつかのドラフトガイダンス文書を発表しました。これらのFDAによる発展および規制の改正により、製品承認プロセスが容易になり、デバイスが検証および確認基準を満たすことが求められ、市場成長を促進すると期待されています。
ヨーロッパは第二の地域であり、2030年には343.5億米ドルの期待値に達すると予測されており、年平均成長率4%を記録する見込みです。ドイツは先進的で強固な医療機器市場を有しており、シーメンス、カール・ツァイス、ドレガーワークなどの大手企業が存在します。ドイツは、アメリカと日本に次いで世界で三番目に大きな医療技術市場を持つとされ、またヨーロッパでは最も大きな市場です。医療機器市場の規模が拡大するにつれて、テストおよび認証の需要は増加すると予想されます。ドイツで販売されるすべての医療機器は、医療機器のテストおよび認証手続きをクリアする必要があります。ドイツにおける医療機器の販売は、ドイツおよび欧州連合(EU)の指令、基準、安全ルールによって厳格な安全性、認証、および指令要件に従っています。2021年5月には、EU医療機器規則(MDR)が発効する見込みであり、ドイツにおける医療機器のテスト、認証、およびコンプライアンス要件がさらに強化されることが期待されています。
アジア太平洋地域は、第三の地域です。中国はアジア太平洋地域における主要な医療機器産業の一つを代表しています。中国政府は、すべての医療機器が中国市場での商業化前に適切なテストおよび標準遵守手続きを受ける必要があると規定しています。国家医療製品管理局(NMPA、旧中国食品医薬品監督管理局)は、ほとんどの医療機器に対して国内テストおよび広範な臨床データを求めています。中国国務院は新しい医療機器規則を可決しました。この新しい規則は、製品の安全性に対する市場後の監視を強化し、製造業者にペナルティを課すことを規定しています。たとえば、未承認の医療機器の製造および流通は、販売価値の15〜30倍の罰金を科される可能性があります。この規制は、中国で医療機器を商業化する前に安全性およびリスク評価に焦点を当てるため、医療のテストおよび標準認証の需要をさらに高めることになります。
テストサービスは医療機器のテストと認証市場を支配しており、デバイスの安全性、有効性、および規制コンプライアンスを確保するための基盤となっています。このセグメントには、生体適合性、機械的、電気的、およびソフトウェアのテストなど、重要な手続きが含まれます。特にAIなどの高度な技術を取り入れた医療機器の複雑さが増しているため、堅牢なテストが不可欠です。FDAやEU MDRなどの規制当局は、市場投入前に性能と安全性を検証するための包括的なテストを義務付けています。医療機器技術の継続的な進展や革新デバイスの発売の増加は、テストサービスの需要をさらに促進し、このカテゴリで最も重要かつ求められるものにしています。
アウトソーシングされたテストおよび認証サービスは、コスト効率や専門的な知識へのアクセスによって、社内業務よりも優位に立っています。多くの医療機器製造業者は、確立されたテストインフラ、規制知識、および技術的な専門知識を持つ第三者サービスプロバイダーと提携することを好みます。このアプローチにより、製造業者はR&Dやマーケティングなどのコア活動に集中しながら、コンプライアンスおよび認証のための外部の専門知識を活用できます。アウトソーシングは、包括的な社内テスト能力を持たない中小企業にとって特に有利です。医療機器の複雑さの増加や厳しい規制要件により、アウトソーシングは多くの企業にとって実用的かつ効果的な選択肢となっています。
クラスIIの医療機器は、この分類の中で最も大きなセグメントを占めており、注入ポンプや電動車椅子などの中程度の複雑さとリスクを伴うデバイスを幅広く含んでいます。これらのデバイスは、クラスIデバイスよりも厳格な規制が必要ですが、生命維持装置を含むクラスIIIデバイスよりも複雑ではありません。クラスIIデバイスの市場での重要な存在は、診断から患者ケアに至るまで、さまざまな医療分野での幅広い応用によって推進されています。これらのバランスの取れた規制要件は、管理可能なコンプライアンスの経路を提供すると同時に、安全性と有効性データの詳細な必要性をもたらし、彼らの支配的な市場シェアに寄与しています。
体外診断(IVD)医療機器は、病気の検出やモニタリングにおける重要な役割から、リーディングセグメントとなっています。これらのデバイスは、慢性疾患の管理に必須な早期診断や継続的な健康管理を促進します。COVID-19パンデミックは、特に診断テストに対するIVDの需要を大幅に押し上げ、その公衆衛生における重要性を浮き彫りにしました。分子診断、ポイントオブケアテスト、個別化医療の分野での継続的な革新は、IVDセグメントをさらに推進しています。IVDデバイスは、医療専門分野や日常的な健康評価に広く適用されるため、現代医療において中心的な役割を果たしています。
医療機器製造業者は、テストおよび認証サービスの主要なエンドユーザーです。これらの企業は、製品が市場に投入される前に、グローバルな規制基準に準拠していることを確認する必要があります。製造業者は、デバイスの安全性、機能性、規制コンプライアンスを確認するために、テストおよび認証に大きく依存しています。技術革新のペースが増加しているため、医療機器のテストと認証の重要性は今後も高まるでしょう。
Report Coverage & Structure
医療機器のテストと認証に関する報告書の構成概要
この報告書は、医療機器のテストと認証に関連する市場の詳細な分析を提供することを目的としています。以下に、報告書の主要なセクションを論理的にグループ化してまとめます。
1. イントロダクション
報告書の冒頭部分では、医療機器のテストと認証に関する基本的な情報と背景を説明しています。ここでは、研究の目的や範囲、制限事項および仮定について言及します。
2. 市場分析
このセクションでは、医療機器のテストと認証市場の機会評価、トレンド、ドライバー、警告要因、マクロ経済指標、地政学的影響、技術要因などを詳しく分析します。
- 市場機会評価: 新興地域や国、新興企業、新興アプリケーションの評価を行います。
- 市場トレンド: 現在の市場の動向や影響を与える要因を探ります。
- ドライバーおよび警告要因: 市場の成長を促す要因とリスクを特定します。
- マクロ経済指標: 経済全体の状況が市場に与える影響を考察します。
- 地政学的影響: 政治的要因が市場に与える影響を分析します。
- 技術要因: 市場の技術的進展の影響を評価します。
3. 市場評価
市場評価の部分では、ポーターの5フォース分析やバリューチェーン分析を通じて、市場の競争環境を理解します。
4. 規制フレームワーク
医療機器のテストと認証に関連する規制の枠組みについて、北米、欧州、アジア太平洋、中東およびアフリカ、ラテンアメリカの各地域に分けて詳細に説明します。
5. ESGトレンド
環境、社会、ガバナンスの観点から、医療機器のテストと認証市場のトレンドを分析します。
6. 市場規模分析
このセクションでは、サービスの種類、調達タイプ、デバイスクラス、技術、およびエンドユーザーに基づいて、医療機器のテストと認証市場の規模を詳細に分析します。
7. 地域別市場分析
北米およびヨーロッパ市場についてさらに詳細な分析を行い、それぞれのサービスタイプ、調達タイプ、デバイスクラス、技術、およびエンドユーザーに基づく市場の状況を示します。
- 北米市場分析: 特に米国とカナダに焦点を当て、サービス別、調達別、デバイスクラス別、技術別、エンドユーザー別に分析します。
- ヨーロッパ市場分析: イギリスを含む地域の分析を行い、同様の分類で評価します。
このように、報告書は医療機器のテストと認証に関する包括的な分析を提供しており、各セクションが市場の理解を深めるために重要な役割を果たしています。
*** 本調査レポートに関するお問い合わせ ***

医療機器のテストと認証とは、医療機器が安全で効果的に機能することを確認するためのプロセスを指します。このプロセスは、製品が市場に出る前に必要な品質基準を満たしていることを保証するために不可欠です。医療機器は患者の健康に直接影響を与えるため、そのテストと認証は非常に重要です。
医療機器のテストには、さまざまなタイプがあります。一般的には、機器の性能評価、安全性評価、耐久性試験などが含まれます。性能評価は、機器が設計された機能を果たすかどうかを検証します。安全性評価は、使用中に患者や医療従事者に対するリスクを評価し、そのリスクが許容範囲内であるかどうかを判断します。耐久性試験は、機器が長期間にわたって正常に機能するかどうかを確認するために行われます。
医療機器の認証プロセスは、各国で異なる規制機関によって実施されます。日本では、医療機器の認証は主に厚生労働省が担当しています。医療機器の製造業者は、製品を市場に出す前に、これらの規制機関に対して申請を行い、必要なテストを実施する必要があります。認証が得られると、製品には特定のマークが付与され、消費者や医療機関に対して安全性と信頼性の証明となります。
医療機器のテストと認証は、さまざまな関連技術とも密接に関係しています。例えば、品質管理システムやリスクマネジメント手法は、製品の開発段階からテスト、認証までの各プロセスにおいて重要な役割を果たします。また、最新の技術を活用したシミュレーションやデータ解析により、テストの効率性を高めることが可能になっています。さらに、AI(人工知能)やIoT(モノのインターネット)といった新しい技術も、医療機器の性能向上や安全性の確保に寄与しています。
このように、医療機器のテストと認証は、製品の安全性を保証するために不可欠なプロセスです。これによって、患者が安心して医療機器を使用できる環境が整えられ、医療の質が向上します。医療機器の進化とともに、テストと認証の手法も進化し続けており、今後の技術革新が期待されます。