微生物発酵技術市場:規模・シェア分析、成長動向と予測(2025-2030年)
微生物発酵技術市場レポートは、用途(抗生物質、モノクローナル抗体など)、微生物の種類(細菌、酵母など)、発酵方式(バッチ式など)、発酵槽容量(パイロットスケールなど)、エンドユーザー(バイオ医薬品企業など)、および地域(北米、ヨーロッパなど)によって分類されます。市場予測は、金額(米ドル)で提供されます。

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
微生物発酵技術市場の概要
市場規模と予測
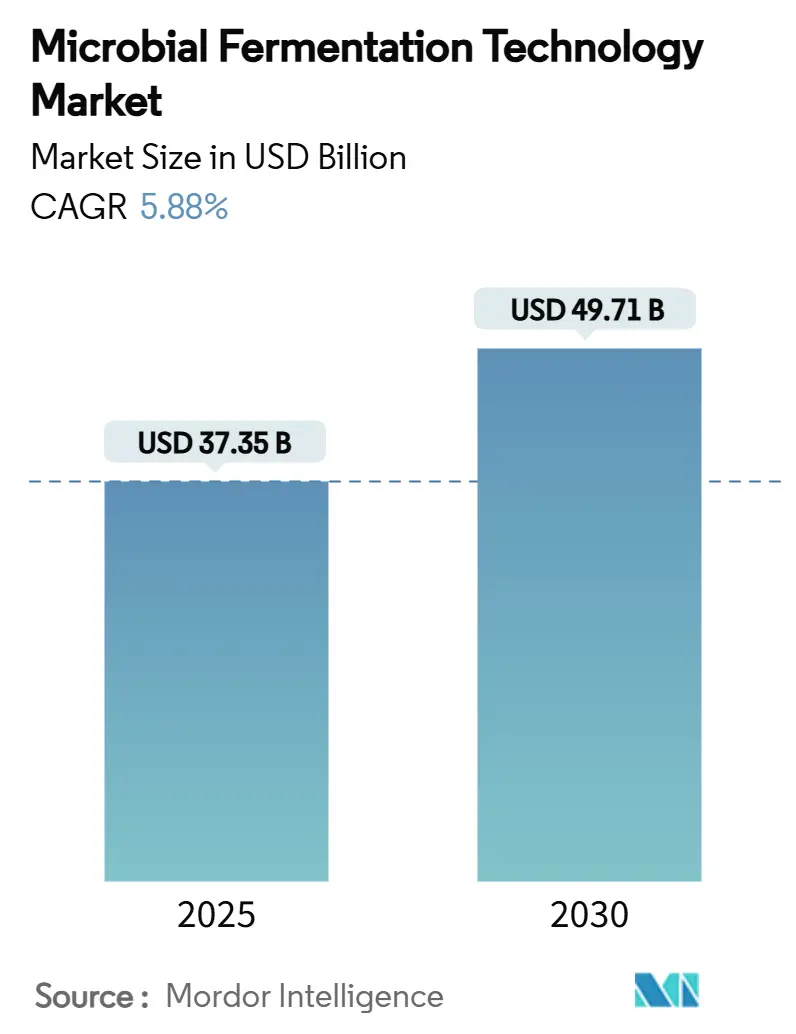
微生物発酵技術市場は、2025年には373.5億米ドルと評価され、2030年には497.1億米ドルに達すると予測されており、予測期間(2025年~2030年)において年平均成長率(CAGR)5.88%で成長する見込みです。この成長は、より環境に優しい生産経路への需要の高まり、国内バイオ製造に対する政府のインセンティブ、記録的なベンチャー投資水準が相まって、医薬品、食品タンパク質、持続可能な化学品分野での生産能力拡大を推進していることに起因しています。
市場の主要動向と洞察
市場の成長を牽引する主な要因は以下の通りです。
1. RNAワクチン向け微生物生産能力の拡大: RNAワクチンの需要増加に伴い、微生物発酵による生産能力が世界的に、特に北米とEUで拡大しています。これは中期的に市場に影響を与えると見られています。
2. 持続可能な化学品における組換え酵素の需要増加: 排出量削減とプロセス特異性の向上を目指す生産者により、組換え酵素が石油化学触媒に取って代わりつつあります。Solugen社の事例のように、低炭素有機酸の供給やCO2排出量削減に貢献しています。高スループットスクリーニングやAIを活用したタンパク質設計により、開発サイクルが短縮され、磁気架橋細胞凝集体などの新しい固定化方法が酵素の寿命を延ばしています。欧州の循環経済政策や中国の選択的廃棄物規制も、バイオベースプラスチック、バイオ燃料、特殊化学品への需要を増幅させており、酵素発酵は大規模な脱炭素化の基盤として位置付けられています。これはAPACと北米を中心に世界的に長期的な影響をもたらします。
3. バイオ製造のレジリエンスに対する政府のインセンティブ: 各国の安全保障上の目的から、国内の微生物生産能力に前例のない公的資金が投入されています。米国防総省はDARPAの生物技術局を通じてバイオテクノロジーに20億ドルを投じ、国家バイオテクノロジー・バイオ製造イニシアティブは既存工場改修への税額控除や助成金を提供しています。中国の41.7億ドルの合成生物学戦略も、医薬品や産業バイオテクノロジーのインフラを支援し、世界的な競争を激化させています。米国と欧州における精密発酵食品や細胞フリー治療薬の規制迅速化は、市場参入障壁を低減しています。これは北米とEUを中心に短期的な影響をもたらします。
4. 連続発酵スキッドシステムの急速な導入: ダウンタイムと汚染リスクを削減するため、リアルタイム分析と閉鎖型移送操作を統合したモジュール式の連続システムが導入されています。スキッドマウント型プラットフォームは設備投資を抑え、ラインの移設を簡素化し、医薬品と代替タンパク質の両方における分散型製造戦略と合致しています。連続上流とバッチ下流を組み合わせたハイブリッド方式は、確立された精製シーケンスを妨げることなく、高い体積生産性を提供します。AIを活用した制御ループは滞留時間と栄養供給を安定させ、バッチ間の均一性を向上させます。使い捨て技術の規模拡大に伴い、使い捨て流路は多製品の柔軟性をサポートし、定置洗浄費用を削減するため、先進国市場での導入が加速しています。これは先進国市場を中心に世界的に中期的な影響をもたらします。
5. AIベースの菌株工学の成功率向上: 人工知能は、経路フラックスを最大化する遺伝子編集を予測し、ウェットラボでの反復回数を最大70%削減し、商業的力価に達する確率を高めています。TUNEYALIバイオセンサーツールキットは、発酵中のリアルタイム代謝フィードバックを可能にし、設計・構築・試験・学習サイクルを短縮します。Ginkgo BioworksとNovo Nordiskは、代謝性疾患治療薬の研究開発に自動菌株工学プラットフォームを展開するため、協業を拡大しています。これらの統合されたワークフローはパイロットスケール発酵槽に直接供給され、不確実性を低減しながらスケールアップを加速します。AIモデルがマルチオミクスデータセットの拡大に基づいて学習するにつれて、予測精度が向上し、複雑な多段階変換が可能な合成コンソーシアムの迅速な構築が可能になります。これは技術先進地域を中心に世界的に長期的な影響をもたらします。
6. 精密発酵食品タンパク質へのベンチャー資金の急増: これは北米とEUを中心に世界的に短期的な影響をもたらします。
一方で、市場の成長を抑制する要因も存在します。
1. 高細胞密度における菌株の遺伝的安定性の崩壊: 力価が上昇するにつれて、代謝ストレスが突然変異率を加速させ、プラスミドの喪失を引き起こし、工業生産ラインで収量を15~30%低下させる可能性があります。新しい遺伝子回路は安定性の向上を約束しますが、多くの場合、生産性と堅牢性の間でトレードオフが生じます。早期警戒分析はコピー数変動と代謝物ドリフトを監視しますが、業界は依然として密度と耐久性の最適なバランスを調整しています。複数バッチキャンペーンや長期発酵は累積的なリスクをもたらし、高価値バイオ医薬品のコスト計算を複雑にしています。強化された選択メカニズムと合成栄養要求株が評価されていますが、商業展開は限定的です。これは大規模な操業に特に影響を与え、中期的な課題です。
2. 5,000L以上の使い捨てリアクターの不足: mRNAワクチンや精密発酵タンパク質の需要が急増したことで、大型使い捨てバイオリアクターの需要が専門サプライヤーの供給能力を圧倒しました。18ヶ月を超えるリードタイムは、メーカーに早期発注を強制するか、ステンレス鋼に戻ることを余儀なくさせ、使い捨てシステムの俊敏性という利点を損なっています。多層フィルムや埋め込みセンサーの原材料不足が課題をさらに悪化させています。契約交渉には量保証が含まれることが増えていますが、小規模な新規参入企業は割り当てを確保するのに苦労しています。一部の生産者は、10,000Lの容量を再現するために並行して2,000Lのラインを展開しており、運用上の複雑さは増すものの、汚染管理の利点は維持しています。これはAPACでの不足が特に深刻で、短期的な課題です。
3. 上流と下流のスケールミスマッチによるボトルネック: これは新興市場で最も深刻で、中期的な課題です。
4. 限られたグローバルなc GMP人材プール: これはAPACと新興市場で特に深刻なギャップがあり、長期的な課題です。
セグメント分析
* 用途別: 抗生物質が2024年に33.51%と最大の市場シェアを占めましたが、細胞フリー酵素システムは2030年までに12.25%のCAGRで最も速い成長が予測されています。これは、細胞の制約を回避する次世代生産への転換を示唆しています。モノクローナル抗体と組換えタンパク質は、既存のインフラと償還経路により依然として主要な収益源です。パンデミック中に確立されたmRNA生産ラインは、現在ワクチンパイプラインを拡大しています。AI支援設計と細胞フリー反応による迅速なプロトタイピングの相乗効果が市場を牽引し、Journal of Biological Engineeringのプログラマブルベシクルシステムで検証されたオンデマンド治療薬を可能にしています。細胞フリー合成は、新しい特殊化学品に不可欠な酵素カスケードの迅速な反復を可能にし、小分子の多様化も加速します。
* 微生物タイプ別: バクテリアが長年の最適化により2024年の収益の46.53%を占めましたが、合成コンソーシアムは分業代謝工学のブレークスルーを反映し、13.85%のCAGRで拡大すると予測されています。酵母は糖鎖修飾バイオ医薬品で強い牽引力を維持し、糸状菌は複雑な酵素カクテルでニッチな優位性を保っています。藻類とシアノバクテリアは、糖原料を回避する光合成化学経路で注目を集め、アセトゲン細菌はC1ガスを燃料に変換しています。
* 発酵モード別: 確立された医薬品基準により、流加培養プロセスが2024年の収益の55.63%を占めましたが、リアルタイム分析の成熟に伴い、連続システムは12.87%のCAGRで上昇すると予測されています。連続反応器はダウンタイムを削減し、フットプリント効率を向上させ、培地使用量を削減するため、コモディティバイオマテリアルにとって魅力的です。
* 発酵槽容量別: 1,000~20,000Lの範囲の容器が2024年に48.63%の収益をもたらし、これはブロックバスターバイオ医薬品と精密タンパク質の現実的なスイートスポットです。1,000L未満のパイロットスケールユニットは、企業が分散型生産を採用するにつれて、12.74%のCAGRで最も強い成長を記録しています。LonzaによるVacavilleサイトの買収とそれに伴うモジュール式改修は、20,000L未満の拡張可能なスイートへの移行を示しています。
* エンドユーザー別: バイオ医薬品企業が2024年の支出の42.32%を占めましたが、精密発酵が動物由来タンパク質に取って代わるにつれて、食品・飲料メーカーは13.57%のCAGRで最も速い成長が予測されています。Perfect Dayの乳清保証やNestléの動物性不使用乳製品パイロットは、主流の勢いを反映しています。
地域分析
* 北米: 2024年に38.32%の収益を占め、DARPAからの20億ドルの資金提供、一連の税制優遇措置、複数の民間生産能力増強によって牽引されています。Fujifilmのノースカロライナでの16億ドルの拡張やNovo Nordiskの41億ドルのプログラムは新しい施設を支え、BioSecure Actは政府契約を国内サプライヤーに振り向けています。Lonzaの12億ドルのVacaville買収やAgilentのBIOVECTRA買収は、地域の専門知識を強化する統合を示しています。堅牢なベンチャーエコシステムがAI対応スタートアップに資金を提供し、学術界と産業界の知識ループを強化しています。
* アジア太平洋: 2030年までに12.77%のCAGRで最も高い成長が予測されており、中国の41.7億ドルの合成生物学計画と、米国のサプライチェーンセキュリティ要件とのインドの連携によって推進されています。WuXi Biologicsは地域での生産能力増強を継続し、シンガポールの経済開発庁は精密発酵乳タンパク質のパイロットプラントに資金を提供しています。韓国は、オフショアのCO2から化学品への経路を活用する海洋藻類プログラムに投資しています。地方政府は外国直接投資を誘致するために許認可を合理化し、中小企業にとって肥沃な土壌を創出しています。
* 欧州: 持続可能性を重視する成熟した拠点であり続けています。ドイツのバイオエコノミーフレームワークはバイオポリマーの微生物生産を奨励し、オランダは精密発酵チーズ事業を加速させています。英国は合成生物学クラスターを活用して、細胞フリー治療薬や先進的な酵素プラットフォームを商業化しており、専用の規制ガイダンスによってサポートされています。
* 中東およびアフリカ: 新興ながら戦略的な成長ベクトルを示しています。サウジアラビアのNEOM投資基金は、Liberation Labsが運営する精密発酵複合施設を支援し、乳製品と卵タンパク質の自給自足を目指しています。この地域の豊富な再生可能エネルギー資源は、C1発酵向けの競争力のあるグリーン水素ベースの原料を可能にします。各国政府は、グローバルパートナーを誘致するためにバイオセーフティ規制と労働力訓練を急いで確立しています。
競争環境
微生物発酵技術市場は、確立された製薬大手と機敏な精密発酵新規参入企業との間でバランスが取れています。Lonza、Fujifilm、Novo Nordiskは、大量のバイオ医薬品とmRNA生産能力を確保するために数十億ドルを施設拡張に投資しており、規模主導の防衛戦略を例示しています。中堅のCDMOは、細胞フリープラットフォームと連続生産に多様化してサービスポートフォリオを差別化し、小規模なイノベーターは高マージンのニッチ市場向けに独自の微生物を磨いています。
Ginkgo BioworksのようなAI中心のプラットフォームは、菌株構築を自動化し、IPをライセンス供与したり製造で提携したりする設計会社としての地位を確立しています。Perfect Day、Standing Ovation、Liberation Labsは、契約製造提携を通じて食品タンパク質パイプラインを拡大し、ブランド力と運用上の深さを融合させています。市場では、BASFと合成生物学スタートアップとの持続可能な色素に関する提携や、製薬大手と産業バイオテクノロジー企業からの酵素経路のライセンス供与など、異業種間のパートナーシップが見られます。
データ駆動型バイオプロセス最適化をカバーする特許出願は2024年に急増し、発酵をリアルタイムで調整するアルゴリズム的手法を確保するための競争を反映しています。人材不足は依然として制約要因であり、主要企業は社内研修アカデミーを立ち上げ、大学と協力してc GMP対応の労働力プールを拡大しています。サプライチェーンのレジリエンスは戦略に影響を与え、いくつかの企業は使い捨て部品の制約を緩和するために樹脂とフィルムのベンダーを多様化しています。生産能力が拡大するにつれて、環境影響指標がCDMO契約の入札基準として浮上し、低炭素フットプリントを文書化できる事業者が評価されています。
主要企業
* Lonza Group AG
* Novozymes
* AbbVie Inc
* Thermo Fisher Scientific
* Merck KGaA
最近の業界動向
* 2025年4月:Standing OvationはTetra Pakと提携し、精密発酵による代替カゼインの工業生産を強化し、タンパク質製造におけるスケーラビリティとコスト効率の向上を目指しました。
* 2025年4月:Liberation LabsはサウジアラビアのNEOM投資基金と提携し、精密発酵施設を建設することで、地域の乳製品および卵タンパク質の現地生産を通じて食料安全保障のニーズに対応します。
微生物発酵技術市場に関する本レポートは、微生物を用いて基質を有用な製品に変換する技術の現状と将来展望を詳細に分析しています。この技術は、嫌気性条件下で生化学プロセスを通じて行われ、医薬品やバイオテクノロジーを含む様々な産業で極めて重要な役割を担っています。
市場規模は、2025年には373.5億米ドルに達し、2030年までには497.1億米ドルに成長すると予測されており、今後も拡大を続ける見込みです。
市場の成長を牽引する主な要因としては、RNAワクチン向けの微生物能力の拡大、持続可能な化学品分野における組換え酵素の需要増加、バイオ製造のレジリエンス(回復力)を高めるための政府によるインセンティブ、連続発酵スキッドシステムの急速な採用、AIベースの菌株工学における成功率の向上、精密発酵食品タンパク質分野へのベンチャー資金の急増が挙げられます。
一方で、市場の成長を抑制する要因も存在します。高細胞密度における菌株の遺伝的安定性の崩壊、5,000リットル以上の大型シングルユースリアクターの不足、アップストリームとダウンストリーム間のスケールミスマッチによるボトルネック、グローバルなcGMP(適正製造規範)人材プールの限定性などが挙げられます。特に、大型シングルユースバイオリアクターの不足と高細胞密度での遺伝的安定性維持の課題は、市場全体の成長率を約1.2パーセントポイント抑制していると指摘されています。
本レポートでは、市場を用途別、微生物タイプ別、発酵方式別、発酵槽容量別、エンドユーザー別、地域別に詳細にセグメント化し、分析しています。
用途別では、抗生物質、モノクローナル抗体、組換えタンパク質、ワクチン、酵素、小分子などに加え、セルフリー酵素システムが2030年までに年平均成長率12.25%で最も速く成長すると予測されています。微生物タイプ別では、バクテリア、酵母、糸状菌、藻類・シアノバクテリアに加え、人工合成コンソーシアが年平均成長率13.85%で成長すると見込まれており、複数の菌株に代謝タスクを分散させることで高い収率と複雑なバイオ変換を可能にするとされています。エンドユーザーは、バイオ医薬品企業、医薬品受託製造機関(CMO/CDMO)、医薬品受託研究機関(CRO)、学術・研究機関、食品・飲料メーカー、産業バイオテクノロジー企業など多岐にわたります。地域別では、北米、欧州、アジア太平洋、中東・アフリカ、南米が対象です。
政府の政策も市場成長に大きな影響を与えており、米国の国家バイオテクノロジー・バイオ製造イニシアチブや中国の合成生物学計画のようなプログラムが、資金提供と規制支援を通じて生産能力の拡大を加速させています。
競争環境については、市場集中度、市場シェア分析、そしてAbbVie Inc、Lonza Group AG、Thermo Fisher Scientific、Samsung Biologicsなど多数の主要企業のプロファイルが含まれており、各企業の概要、主要セグメント、財務状況、戦略的情報、製品・サービス、最近の動向が詳述されています。
本レポートは、市場の機会と将来の展望、特に未開拓分野や満たされていないニーズの評価についても言及しており、今後の市場発展の方向性を示唆しています。

1. はじめに
- 1.1 調査の前提と市場の定義
- 1.2 調査範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場概況
- 4.1 市場概要
-
4.2 市場の推進要因
- 4.2.1 RNAワクチン向け微生物生産能力の拡大
- 4.2.2 持続可能な化学品における組換え酵素の需要増加
- 4.2.3 バイオ製造のレジリエンスに対する政府のインセンティブ
- 4.2.4 連続発酵スキッドシステムの急速な導入
- 4.2.5 AIベースの菌株工学における成功率
- 4.2.6 精密発酵食品タンパク質へのベンチャー資金の急増
-
4.3 市場の阻害要因
- 4.3.1 高細胞密度における菌株の遺伝的安定性の崩壊
- 4.3.2 5,000 L以上のシングルユースリアクターの不足
- 4.3.3 アップストリームとダウンストリームのスケールミスマッチによるボトルネック
- 4.3.4 限られたグローバルなcGMP人材プール
- 4.4 技術的展望
-
4.5 ポーターのファイブフォース
- 4.5.1 新規参入者の脅威
- 4.5.2 買い手の交渉力
- 4.5.3 供給者の交渉力
- 4.5.4 代替品の脅威
- 4.5.5 競争上の対抗関係
5. 市場規模と成長予測 (金額、米ドル)
-
5.1 用途別
- 5.1.1 抗生物質
- 5.1.2 モノクローナル抗体
- 5.1.3 組み換えタンパク質
- 5.1.4 バイオシミラー
- 5.1.5 ワクチン
- 5.1.6 酵素
- 5.1.7 小分子
- 5.1.8 無細胞酵素システム
- 5.1.9 その他の用途
-
5.2 微生物の種類別
- 5.2.1 細菌
- 5.2.2 酵母
- 5.2.3 糸状菌
- 5.2.4 藻類 & シアノバクテリア
- 5.2.5 エンジニアリングされた合成コンソーシアム
-
5.3 発酵方式別
- 5.3.1 バッチ
- 5.3.2 補給培養
- 5.3.3 連続
-
5.4 発酵槽容量別
- 5.4.1 パイロットスケール (<1,000 L)
- 5.4.2 中規模 (1,000-20,000 L)
- 5.4.3 大規模 (20,000 L超)
-
5.5 エンドユーザー別
- 5.5.1 バイオ医薬品企業
- 5.5.2 医薬品受託製造機関 (CMO/CDMO)
- 5.5.3 医薬品受託研究機関 (CRO)
- 5.5.4 学術・研究機関
- 5.5.5 食品・飲料メーカー
- 5.5.6 産業バイオテクノロジー企業
-
5.6 地域別
- 5.6.1 北米
- 5.6.1.1 米国
- 5.6.1.2 カナダ
- 5.6.1.3 メキシコ
- 5.6.2 欧州
- 5.6.2.1 ドイツ
- 5.6.2.2 英国
- 5.6.2.3 フランス
- 5.6.2.4 イタリア
- 5.6.2.5 スペイン
- 5.6.2.6 その他の欧州
- 5.6.3 アジア太平洋
- 5.6.3.1 中国
- 5.6.3.2 日本
- 5.6.3.3 インド
- 5.6.3.4 韓国
- 5.6.3.5 オーストラリア
- 5.6.3.6 その他のアジア太平洋
- 5.6.4 中東およびアフリカ
- 5.6.4.1 GCC
- 5.6.4.2 南アフリカ
- 5.6.4.3 その他の中東およびアフリカ
- 5.6.5 南米
- 5.6.5.1 ブラジル
- 5.6.5.2 アルゼンチン
- 5.6.5.3 その他の南米
6. 競合情勢
- 6.1 市場集中度
- 6.2 市場シェア分析
-
6.3 企業プロファイル(グローバルレベルの概要、市場レベルの概要、主要セグメント、利用可能な財務情報、戦略情報、主要企業の市場ランキング/シェア、製品&サービス、および最近の動向を含む)
- 6.3.1 アッヴィ
- 6.3.2 バイオコン
- 6.3.3 メルクKGaA
- 6.3.4 ロンザグループAG
- 6.3.5 ノボザイムズ
- 6.3.6 F. ホフマン・ラ・ロシュAG
- 6.3.7 サーモフィッシャーサイエンティフィック
- 6.3.8 サイティバ
- 6.3.9 ギンコバイオワークス
- 6.3.10 エボニック(ヘルス&ケア)
- 6.3.11 ファイザー
- 6.3.12 ベーリンガーインゲルハイム
- 6.3.13 サムスンバイオロジクス
- 6.3.14 富士フイルムダイオシンス
- 6.3.15 ダナハー(ポールバイオテック)
- 6.3.16 CJ第一製糖(バイオ)
- 6.3.17 アミリス
- 6.3.18 ADM(バイオソリューションズ)
- 6.3.19 バイオベクトラ
- 6.3.20 テラビア(イングレディオン)
7. 市場機会&将来展望
*** 本調査レポートに関するお問い合わせ ***

微生物発酵技術は、細菌、酵母、カビといった微生物が持つ特定の酵素の働きを利用し、有機物を分解・変換して、人間にとって有用な物質を生産するプロセス全般を指します。この技術は、古くから食品の製造に用いられてきましたが、現代ではバイオテクノロジーの中核技術として、医薬品、化学品、燃料、環境分野など、多岐にわたる産業に応用され、その重要性を増しています。微生物は、特定の条件下で効率的に目的物質を生成する能力を持ち、その代謝経路を制御することで、様々な製品を生み出すことが可能となります。
微生物発酵技術には、様々な種類が存在します。まず、培養形式による分類では、固形基質上で微生物を培養する「固体培養(固体発酵)」と、液体培地中で微生物を培養する「液体培養(液体発酵)」が挙げられます。液体培養は、大規模なタンクで行われる「深部培養」が一般的で、攪拌や通気によって微生物の生育環境を最適化します。次に、利用する微生物の種類によって、乳酸菌や酢酸菌を用いる「細菌発酵」、清酒酵母やパン酵母を用いる「酵母発酵」、麹菌や青カビを用いる「カビ発酵」などに分けられます。また、生成される物質によって、アルコール発酵、乳酸発酵、アミノ酸発酵、抗生物質生産発酵などと分類されることもあります。さらに、酸素の有無によって、酸素を必要とする「好気性発酵」と、酸素を必要としない「嫌気性発酵」に大別され、それぞれ異なる代謝経路と生成物をもたらします。これらの多様な発酵形式や微生物の選択により、目的に応じた最適な生産プロセスが構築されます。
この技術の用途は非常に広範です。食品産業では、日本酒、ビール、ワインといった酒類、醤油、味噌、酢などの調味料、ヨーグルト、チーズなどの乳製品、パン、納豆、漬物といった伝統食品の製造に不可欠です。また、うま味調味料としてのアミノ酸や、ビタミン類の生産にも利用されています。医薬品産業においては、ペニシリンやストレプトマイシンなどの抗生物質、インスリンやワクチン、各種酵素製剤、さらにはバイオ医薬品の生産に貢献しています。化学産業では、クエン酸、乳酸、コハク酸などの有機酸、エタノール、アセトン、ブタノールといった溶剤、ポリ乳酸などのバイオプラスチック原料、界面活性剤、色素などの製造に活用されています。農業・環境分野では、飼料添加物、肥料、バイオエタノールやバイオディーゼルといったバイオ燃料の生産、さらには廃水処理や土壌改良、バイオレメディエーションといった環境浄化技術にも応用されています。化粧品産業においても、保湿成分、美白成分、抗酸化成分などの機能性素材の生産に利用され、その応用範囲は日々拡大しています。
微生物発酵技術を支え、さらに発展させるための関連技術も多岐にわたります。微生物の代謝経路を改変し、目的物質の生産効率を向上させる「遺伝子組換え技術」や、より精密な遺伝子改変を可能にする「ゲノム編集技術(CRISPR/Cas9)」は、新たな機能を持つ微生物の創出に不可欠です。微生物の代謝経路を設計・最適化する「メタボリックエンジニアリング」は、高効率生産を実現するための基盤となります。発酵槽の設計や、温度、pH、溶存酸素、攪拌などの培養条件を最適に制御する「バイオリアクター技術」は、生産性を最大化するために重要です。発酵液から目的物質を高純度で回収する「分離精製技術」(膜分離、クロマトグラフィー、晶析など)も、製品の品質とコストに直結します。さらに、微生物の全体像を解析する「オミックス解析技術」(ゲノミクス、プロテオミクス、メタボロミクス)は、発酵プロセスの理解と最適化に貢献し、近年ではAIやデータサイエンスが発酵プロセスの予測、最適化、異常検知に活用され、スマート発酵の実現に向けた研究開発が進められています。
市場背景としては、微生物発酵技術は持続可能な社会の実現に貢献する技術として、世界的に注目されています。環境意識の高まりから、化石資源由来の製品からバイオベース製品へのシフトが進んでおり、バイオ燃料やバイオプラスチックの需要が増加しています。また、食の安全・安心への関心や、プロバイオティクス、機能性食品といった健康志向の高まりも、発酵食品や発酵由来の機能性素材の市場を牽引しています。新興国における経済成長と人口増加も、食品、医薬品、化学品といった幅広い分野での需要拡大に寄与しています。一方で、生産コストの削減、大規模生産へのスケールアップ、原料の安定供給と多様化、そして各国・地域の法規制への対応といった課題も存在し、これらを克服するための技術革新とビジネスモデルの構築が求められています。
将来展望として、微生物発酵技術はさらなる進化を遂げることが期待されています。AI、ロボティクス、IoTといった先端技術を統合したスマート発酵プラントの実現により、生産の自動化と最適化が進み、高機能化・高効率化が加速するでしょう。合成生物学の進展により、自然界には存在しない全く新しい機能を持つ微生物が創出され、これまで不可能だった物質生産が可能になるかもしれません。また、連続発酵や無細胞発酵といった新たな発酵プロセスの開発も進められています。原料面では、農業残渣や食品廃棄物などの未利用バイオマスからの高付加価値物質生産、さらにはCO2を原料とする発酵技術(CO2固定化技術との融合)が注目されており、資源循環型社会への貢献が期待されます。応用分野では、細胞農業(培養肉、培養魚介類)や宇宙での物質生産、環境修復、資源回収など、新たな領域への展開が予測されます。微生物発酵技術は、持続可能な開発目標(SDGs)の達成に不可欠な中核技術として、今後もその重要性を増し、私たちの社会に多大な恩恵をもたらすことでしょう。