mRNAワクチン・治療薬市場 規模・シェア分析 – 成長動向と予測 (2026年~2031年)
mRNAワクチン・治療薬市場は、mRNA構築タイプ(従来の非複製型mRNAなど)、治療領域(感染症、がんなど)、デリバリーシステム(ポリマーベースのナノキャリア、カチオン性ナノエマルションなど)、流通チャネル(公的、民間)、および地域(北米、欧州など)によってセグメント化されています。市場規模と予測は、金額(米ドル)で提供されます。

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
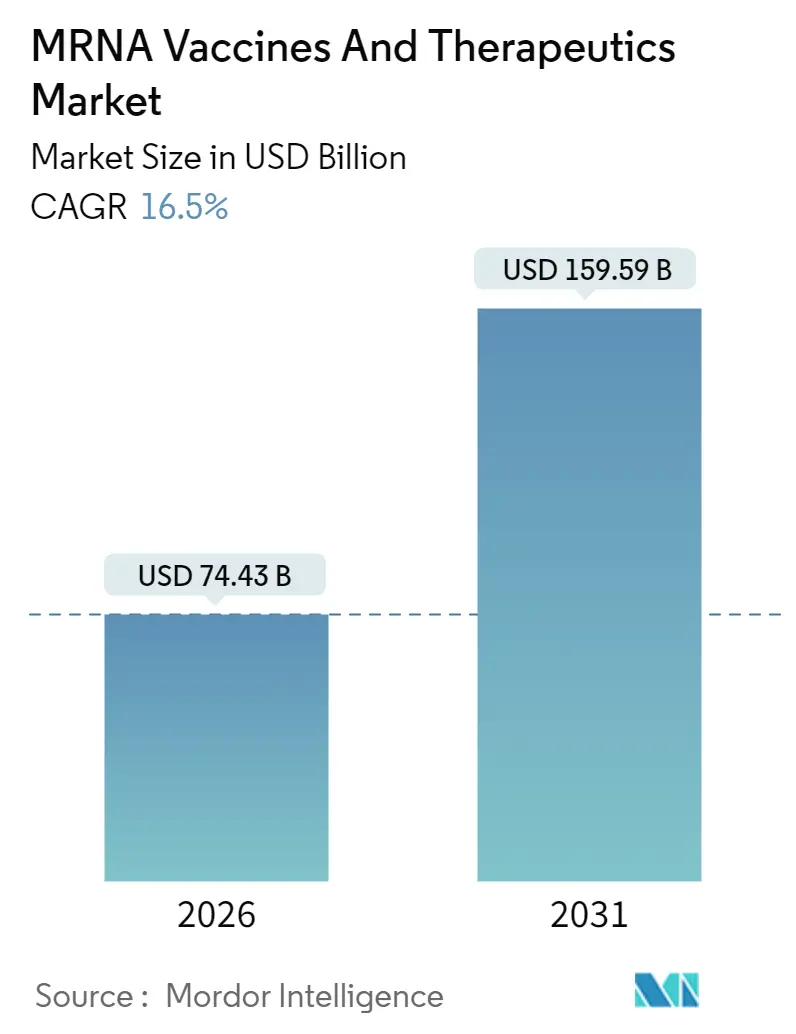
mRNAワクチンおよび治療薬市場は、2025年の638.9億米ドルから、2026年には744.3億米ドル、そして2031年には1595.9億米ドルに成長すると予測されており、予測期間(2026年~2031年)における年平均成長率(CAGR)は16.5%に達すると見込まれています。この市場は中程度の集中度を示しており、北米が最大の市場であり、アジア太平洋地域が最も急速に成長する市場となるでしょう。
この市場の成長は、専門的な製造拠点への大規模な投資、臨床パイプラインを拡大する戦略的な官民連携、そして学術研究から主要な臨床試験へと移行する次世代のmRNA構造によって推進されています。投資家の関心は依然として高く、COVID-19、RSウイルス(Moderna社のRSVワクチンmRESVIAが米国FDAの承認を受けたことなど)、およびいくつかの腫瘍学分野におけるmRNAプラットフォームの実世界での有効性データがその価値を証明しています。
規制面では、FDAプラットフォーム指定プログラムや日本、シンガポールにおける同様の迅速承認制度を通じて規制上のギャップが解消され、開発期間が短縮されています。また、モジュール式のクローズドシステムプラントの導入により、設備投資とバッチ間のばらつきが削減されています。同時に、連続的な脂質ナノ粒子生産やコールドチェーン監視の改善といったサプライチェーンの革新が、1回あたりの投与コストを削減し、新興地域でのアクセスを拡大しています。
主要な市場セグメントの分析は以下の通りです。
* mRNA構造タイプ別:
2025年には、従来の非複製型mRNAが市場シェアの65.10%を占め、主導的な地位にありました。一方、自己増幅型mRNAは2031年までに17.10%のCAGRで最も急速な進展が予測されています。
* 治療領域別:
2025年には、感染症がmRNAワクチンおよび治療薬市場規模の49.85%を占めました。腫瘍学分野は、2031年までに17.20%のCAGRで最も速い成長を遂げると見込まれています。
* 送達システム別:
2025年には、脂質ナノ粒子が収益シェアの67.60%を占めました。ウイルスベクターは、2026年から2031年の間に16.95%のCAGRで最も高い成長率を示すと予測されています。
* 流通チャネル別:
2025年には、公的調達が収益の69.10%を占めました。民間チャネルは、2031年までに17.25%のCAGRで拡大すると予測されています。
* 地域別:
2025年には、北米が市場シェアの41.95%を占めました。アジア太平洋地域は、同期間に17.35%のCAGRで最も速い成長を遂げると予測されています。
市場の成長を牽引する主な要因とその影響は以下の通りです。
* パンデミックへの備えによる需要の急増:
CAGR予測に+3.2%の影響を与え、世界的に中期(2~4年)で影響を及ぼします。保健機関がCOVID-19を超えてインフルエンザ、エムポックス、結核などへの備えを強化する中で、政府のパンデミック対策資金がmRNAワクチンおよび治療薬市場を支えています。例えば、BARDAがModerna社にH5型インフルエンザ候補に対して1億7600万米ドルを授与したことは、複数年にわたる調達ロードマップの基盤となっています。
* 慢性疾患および感染症の負担増加:
CAGR予測に+2.8%の影響を与え、アジア太平洋地域および新興市場で長期(4年以上)にわたって影響を及ぼします。
* 政府およびベンチャーによる研究開発資金の増加:
CAGR予測に+2.1%の影響を与え、北米、ヨーロッパ、アジア太平洋地域で短期(2年以内)に影響を及ぼします。
* COVID-19後の商業的実証:
CAGR予測に+2.5%の影響を与え、世界的に中期(2~4年)で影響を及ぼします。
* モジュール式クローズドシステムmRNA製造の展開:
CAGR予測に+1.8%の影響を与え、北米およびヨーロッパで長期(4年以上)にわたって影響を及ぼします。
* 自己増幅型/環状mRNAの進歩:
CAGR予測に+1.9%の影響を与え、日本、シンガポール、そして世界的に中期(2~4年)で影響を及ぼします。
これらの要因が複合的に作用し、mRNAワクチンおよび治療薬市場は今後も力強い成長を続けると予測されます。
このレポートは、mRNAワクチンおよび治療薬の世界市場に関する詳細な分析を提供しています。mRNAワクチンおよび治療薬は、望ましい免疫学的特性を組み合わせたもので、哺乳類細胞を用いて実験室で調製されます。これらは体内に注入されることでウイルスを検出する免疫センサーを活性化し、細胞内でウイルス抗原タンパク質を産生させます。これにより、B細胞およびT細胞の応答を改善し、身体の免疫システムを強化する効果が期待されています。
市場規模と予測
mRNAワクチンおよび治療薬の世界市場規模は、2026年に744.3億米ドルに達し、2031年までに1595.9億米ドルに成長すると予測されています。
市場の推進要因
市場の成長を牽引する主な要因としては、以下の点が挙げられます。
* パンデミック対策の需要急増
* 慢性疾患および感染症の負担増加
* 政府およびベンチャーキャピタルによる研究開発資金の増加
* COVID-19後の商業的実証の成功
* モジュール型クローズドシステムmRNA製造の展開
* 自己増幅型および環状mRNAの技術進歩
市場の阻害要因
一方で、市場の成長を妨げる要因も存在します。
* コールドチェーンの維持と厳格な規制遵守
* 高い生産コストとスケールアップの複雑さ
* LNP(脂質ナノ粒子)賦形剤の供給ボトルネックと特許問題
* ワクチン忌避や誤情報による逆風
市場のセグメンテーションと成長動向
レポートでは、以下の主要なセグメントに基づいて市場を分析しています。
* mRNA構築タイプ別: 従来の非複製型mRNA、自己増幅型mRNA、環状mRNA、その他に分類されます。特に自己増幅型mRNAは、より少ない投与量で強力な免疫応答を誘発できるため、2031年までの年平均成長率(CAGR)が17.10%と最も速い成長を遂げると予測されています。
* 治療領域別: 感染症、腫瘍学、自己免疫疾患、その他が含まれます。腫瘍学分野では、mRNA-4157とペムブロリズマブの併用によるメラノーマ再発率49%減少といった画期的な結果がこのモダリティの有効性を証明し、17.20%のCAGRで大きな注目を集めています。
* デリバリーシステム別: 脂質ナノ粒子(LNP)、ポリマーベースのナノキャリア、カチオン性ナノエマルジョン、ウイルスベクター、その他に分けられます。
* 流通チャネル別: 公共部門と民間部門に分類されます。
* 地域別: 北米、ヨーロッパ、アジア太平洋、中東およびアフリカ、南米にわたる17カ国で市場規模とトレンドが推定されています。特にアジア太平洋地域は、支援的な規制、政府資金、費用対効果の高い製造モデルにより、17.35%のCAGRで最も急速な成長が期待されています。
競争環境
市場の競争環境については、市場集中度、市場シェア分析、主要企業のプロファイルが含まれています。主要企業には、Pfizer Inc.、Moderna Inc.、BioNTech SE、CureVac SE、Arcturus Therapeutics、GSK plc、Sanofi、Daiichi Sankyo、AstraZeneca、CSL Seqirus、Chugai Pharmaceuticalなどが挙げられます。新規参入者にとっての主な障壁は、コールドチェーン物流、複雑な規制遵守、およびLNPに関する特許紛争が挙げられます。
市場機会と将来展望
レポートは、未開拓の領域や満たされていないニーズの評価を通じて、将来の市場機会についても言及しています。モジュール型クローズドシステムや連続フロー製造プラントといった製造革新は、検証期間の短縮とバッチコストの削減を可能にし、各国での現地生産を支援し、世界市場の成長を後押ししています。
このレポートは、mRNAワクチンおよび治療薬市場の全体像を把握し、将来の戦略立案に役立つ重要な情報を提供しています。

1. はじめに
- 1.1 調査の前提と市場の定義
- 1.2 調査範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場概況
- 4.1 市場概要
-
4.2 市場促進要因
- 4.2.1 パンデミック対策需要の急増
- 4.2.2 慢性疾患および感染症の負担増加
- 4.2.3 政府およびベンチャーによる研究開発資金の増加
- 4.2.4 COVID-19後の商業的実証
- 4.2.5 モジュール式閉鎖系mRNA製造の展開
- 4.2.6 自己増幅型/環状mRNAの進歩
-
4.3 市場抑制要因
- 4.3.1 コールドチェーンと厳格な規制遵守
- 4.3.2 生産コストの上昇とスケールアップの複雑さ
- 4.3.3 LNP賦形剤の供給ボトルネックと特許の密集
- 4.3.4 ワクチン忌避と誤情報の逆風
- 4.4 規制状況
-
4.5 ポーターの5つの力分析
- 4.5.1 新規参入者の脅威
- 4.5.2 買い手の交渉力
- 4.5.3 供給者の交渉力
- 4.5.4 代替品の脅威
- 4.5.5 競争上の対立
5. 市場規模と成長予測 (金額、米ドル)
-
5.1 mRNA構築物の種類別
- 5.1.1 従来の非複製型mRNA
- 5.1.2 自己増幅型mRNA
- 5.1.3 環状mRNA
- 5.1.4 その他
-
5.2 治療領域別
- 5.2.1 感染症
- 5.2.2 腫瘍学
- 5.2.3 自己免疫疾患
- 5.2.4 その他
-
5.3 送達システム別
- 5.3.1 脂質ナノ粒子 (LNP)
- 5.3.2 ポリマーベースのナノキャリア
- 5.3.3 カチオン性ナノエマルション
- 5.3.4 ウイルスベクター
- 5.3.5 その他
-
5.4 流通チャネル別
- 5.4.1 公共
- 5.4.2 民間
-
5.5 地域別
- 5.5.1 北米
- 5.5.1.1 米国
- 5.5.1.2 カナダ
- 5.5.1.3 メキシコ
- 5.5.2 欧州
- 5.5.2.1 ドイツ
- 5.5.2.2 英国
- 5.5.2.3 フランス
- 5.5.2.4 イタリア
- 5.5.2.5 スペイン
- 5.5.2.6 その他の欧州
- 5.5.3 アジア太平洋
- 5.5.3.1 中国
- 5.5.3.2 日本
- 5.5.3.3 インド
- 5.5.3.4 オーストラリア
- 5.5.3.5 韓国
- 5.5.3.6 その他のアジア太平洋
- 5.5.4 中東およびアフリカ
- 5.5.4.1 GCC
- 5.5.4.2 南アフリカ
- 5.5.4.3 その他の中東およびアフリカ
- 5.5.5 南米
- 5.5.5.1 ブラジル
- 5.5.5.2 アルゼンチン
- 5.5.5.3 その他の南米
6. 競合情勢
- 6.1 市場集中度
- 6.2 市場シェア分析
-
6.3 企業プロファイル(グローバルレベルの概要、市場レベルの概要、主要セグメント、利用可能な財務情報、戦略情報、主要企業の市場ランク/シェア、製品&サービス、および最近の動向を含む)
- 6.3.1 ファイザー株式会社
- 6.3.2 モデルナ株式会社
- 6.3.3 バイオNTech SE
- 6.3.4 キュアバック SE
- 6.3.5 アークトゥルス・セラピューティクス
- 6.3.6 GSK plc
- 6.3.7 サノフィ
- 6.3.8 第一三共
- 6.3.9 アストラゼネカ
- 6.3.10 CSL シーラス
- 6.3.11 中外製薬
- 6.3.12 ジェンノバ・バイオファーマシューティカルズ
- 6.3.13 eTheRNA イムノセラピューティクス
- 6.3.14 オービタル・セラピューティクス
- 6.3.15 SAB バイオセラピューティクス
- 6.3.16 ストランド・セラピューティクス
- 6.3.17 グリーンライト・バイオサイエンス
- 6.3.18 プロビデンス・セラピューティクス
- 6.3.19 カンシノ・バイオロジクス
- 6.3.20 ワルバックス・バイオテクノロジー
7. 市場機会&将来展望
*** 本調査レポートに関するお問い合わせ ***

mRNAワクチン・治療薬は、メッセンジャーRNA(mRNA)という生体分子を利用して、体内で特定のタンパク質を生成させることで、病気の予防や治療を目指す革新的な医療技術です。従来のワクチンや治療薬とは異なり、病原体の一部や化学合成物質を直接投与するのではなく、タンパク質の設計図であるmRNAを投与し、患者自身の細胞に治療に必要なタンパク質を作らせる点が最大の特徴です。これにより、迅速な開発、高い安全性、そして幅広い応用可能性が期待されています。
まず、定義についてご説明いたします。mRNAは、DNAの遺伝情報をタンパク質合成の場であるリボソームに伝える役割を担うRNAの一種です。mRNAワクチン・治療薬は、このmRNAを人工的に合成し、脂質ナノ粒子(LNP)などのデリバリーシステムに封入して体内に投与します。投与されたmRNAは、細胞質内でリボソームによって読み取られ、目的のタンパク質が合成されます。ワクチンとして使用される場合は、病原体の抗原タンパク質を生成させ、それに対する免疫応答を誘導することで感染症を予防します。治療薬として使用される場合は、欠損しているタンパク質を補充したり、がん細胞を攻撃するタンパク質を生成させたりすることで、疾患の治療効果を発揮します。
次に、種類と用途について詳しく見ていきましょう。
mRNAワクチンは、主に感染症予防とがん治療の二つの分野で開発が進められています。感染症予防ワクチンとしては、新型コロナウイルス感染症(COVID-19)パンデミックにおいて、ファイザー・バイオンテック社製およびモデルナ社製のmRNAワクチンが世界中で広く使用され、その有効性と迅速な開発能力が実証されました。現在では、インフルエンザ、RSウイルス、サイトメガロウイルス、HIV、デング熱、マラリアなど、様々な感染症に対するmRNAワクチンの開発が進められています。がんワクチンとしては、患者個々のがん細胞が持つ特異的な変異(ネオアンチゲン)を標的とした個別化がんワクチンや、複数のがん抗原を標的とする汎用がんワクチンが研究されており、メラノーマや膵臓がんなどの固形がんに対する臨床試験が行われています。
一方、mRNA治療薬は、がん治療薬、遺伝性疾患治療薬、再生医療、自己免疫疾患治療薬など、多岐にわたる応用が期待されています。がん治療薬としては、免疫チェックポイント阻害剤との併用や、CAR-T細胞療法と組み合わせることで、より強力な抗腫瘍効果を目指す研究が進んでいます。遺伝性疾患治療薬としては、特定のタンパク質が欠損している疾患(例:嚢胞性線維症、フェニルケトン尿症、ハンチントン病、筋ジストロフィーなど)において、その欠損タンパク質をmRNAによって体内で補充することで、症状の改善や進行の抑制を目指します。再生医療分野では、心筋梗塞後の心臓組織修復や、糖尿病性足病変の治療など、組織の再生や血管新生を促進するタンパク質を生成させることで、損傷した組織の機能回復を目指す研究が進められています。また、自己免疫疾患においては、免疫応答を抑制するタンパク質を生成させることで、過剰な免疫反応を制御する可能性も探られています。
関連技術もmRNAワクチン・治療薬の発展には不可欠です。主要な関連技術としては、mRNAの安定化と効率的な翻訳を可能にする技術、そして細胞内への効率的なデリバリーシステムが挙げられます。mRNAの安定化と翻訳効率の向上には、ヌクレオシド修飾(例:シュードウリジンへの置換)、コドン最適化、5'キャップ構造や3'非翻訳領域(UTR)、ポリAテールの最適化などが用いられます。これらの技術により、mRNAは生体内で分解されにくくなり、より多くの目的タンパク質を生成できるようになります。デリバリーシステムとしては、脂質ナノ粒子(LNP)が最も広く使用されています。LNPは、mRNAを分解酵素から保護し、細胞膜を通過して細胞質内へ効率的に送達する役割を果たします。LNP以外にも、ポリマーナノ粒子やエクソソームなど、様々なデリバリーシステムの開発が進められており、特定の細胞や組織への標的指向性を高める研究も活発に行われています。製造技術においては、in vitro転写(IVT)法による迅速かつスケーラブルなmRNA合成技術が確立されており、パンデミック時の迅速なワクチン供給に貢献しました。
市場背景としては、COVID-19パンデミックがmRNA技術の市場を劇的に加速させました。パンデミック以前は、mRNA技術はまだ研究開発段階にありましたが、パンデミックを機に、モデルナ社やバイオンテック社(ファイザー社と提携)が開発したmRNAワクチンが緊急承認され、世界中で数億回接種されるに至りました。この成功により、mRNA技術への信頼と期待が飛躍的に高まり、研究開発投資が活発化しました。現在では、大手製薬企業がこの分野に本格的に参入し、多くのスタートアップ企業が設立され、M&Aや提携も増加しています。市場規模は今後も大きく成長すると予測されており、感染症予防ワクチンだけでなく、がん治療薬や遺伝性疾患治療薬など、多様な疾患領域への応用拡大が期待されています。一方で、高コスト、コールドチェーンを必要とする流通課題、長期的な安全性データや規制承認プロセスの確立などが、今後の市場拡大における課題として挙げられます。
最後に、将来展望について述べさせていただきます。mRNAワクチン・治療薬は、その汎用性と迅速な開発能力から、今後の医療を大きく変革する可能性を秘めています。将来的には、現在開発中の感染症ワクチンやがん治療薬が実用化されるだけでなく、自己免疫疾患、神経変性疾患、希少疾患など、これまで治療が困難であった様々な疾患への応用が期待されています。特に、個別化医療の実現において、mRNA技術は重要な役割を果たすでしょう。患者個々の遺伝子情報や疾患特性に基づいたオーダーメイドの治療薬を、迅速かつ効率的に開発することが可能になると考えられています。また、次世代のmRNA技術として、自己増幅型mRNA(saRNA)や環状mRNA(circRNA)など、より低用量で効果を発揮し、持続性の高い技術の開発が進められています。デリバリーシステムもさらに進化し、特定の細胞や臓器にmRNAを効率的に送達する技術や、経口投与、吸入投与など、より簡便な投与経路の開発も期待されています。製造コストの削減とアクセシビリティの向上も重要な課題であり、グローバルヘルスへの貢献、特に低所得国への普及が今後の大きな目標となるでしょう。mRNA技術は、その柔軟性と可能性から、今後も医療イノベーションの中心的な役割を担い続けると確信しております。