オリゴヌクレオチド合成市場 規模・シェア分析 – 成長動向と予測 (2025年~2030年)
オリゴヌクレオチド合成市場レポートは、業界を製品タイプ別(合成オリゴヌクレオチド製品など)、化学種別(DNA、RNAなど)、用途別(研究、診断、治療)、エンドユーザー別(学術研究機関、製薬・バイオテクノロジー企業など)、および地域別に分類しています。市場規模と予測は、金額(米ドル)で提供されています。

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
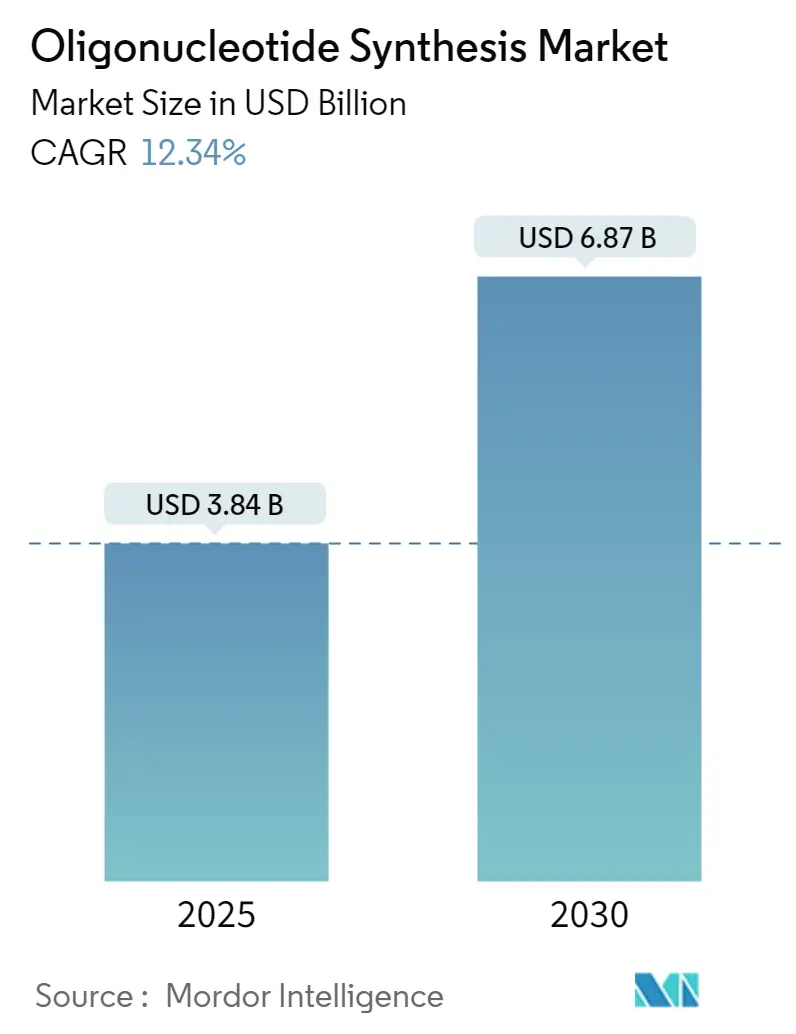
オリゴヌクレオチド合成市場は、2025年に38.4億米ドルに達し、2030年には68.7億米ドルに成長すると予測されており、予測期間中の年平均成長率(CAGR)は12.34%です。この成長は、治療法の画期的な進歩が需要を加速させていることに起因しています。特に、危険な試薬を使用せずに、より長く、よりクリーンな鎖を生成する酵素プラットフォームが、40年間にわたるリン酸アミダイト法の優位性に挑戦し、市場を再構築しています。米国国立衛生研究所(NIH)によるRNA研究への1540万米ドルの助成金など、政府からの資金提供は新しい生産方法を促進しています。また、受託製造業者(CMO)は、医薬品のアウトソーシングニーズの高まりに対応するため、生産能力を拡大しています。2023年末までに22の核酸医薬品が規制当局の承認を得ており、2024年にはさらに4つが承認されたことで、オリゴヌクレオチド合成市場は研究試薬の領域を超え、工業規模のバイオ医薬品へと拡大しています。PFAS(有機フッ素化合物)関連試薬に対する環境規制の強化は、従来のプロセスに圧力をかけ、廃棄物を削減しつつ進化する規制に準拠する酵素代替品への関心を高めています。
主要な市場動向と洞察主要な市場動向と洞察
酵素合成の台頭と市場再編: 従来のリン酸アミダイト法に代わる酵素プラットフォームは、より長いオリゴヌクレオチドをよりクリーンかつ効率的に合成できるため、市場の主要なトレンドとなっています。この技術は、合成プロセスの環境負荷を低減し、高純度な製品を求める需要に応えることで、医薬品開発における新たな可能性を切り開いています。特に、危険な有機溶媒や試薬の使用を削減できる点は、持続可能性への関心が高まる中で大きな魅力となっています。
核酸医薬品の承認増加と商業化の加速: 2023年末までに22、2024年にはさらに4つの核酸医薬品が承認されたことは、オリゴヌクレオチド合成市場が研究段階から商業生産へと移行していることを明確に示しています。これにより、高純度かつ大規模なオリゴヌクレオチドの供給に対する需要が劇的に増加しており、合成技術のスケールアップとコスト効率の改善が喫緊の課題となっています。
受託製造・開発機関(CDMO)の役割拡大: 医薬品開発のアウトソーシングニーズの高まりに伴い、受託製造業者(CMO)や受託開発製造機関(CDMO)は、オリゴヌクレオチド合成の生産能力を積極的に拡大しています。これらの企業は、専門的な技術と設備を提供することで、製薬企業が研究開発に集中できるよう支援し、市場全体の成長を牽引しています。特に、複雑な合成プロセスや規制要件への対応能力が、CDMO選定の重要な要素となっています。
環境規制とグリーンケミストリーへの移行: PFAS(有機フッ素化合物)関連試薬に対する環境規制の強化は、従来の合成プロセスに大きな圧力をかけています。これにより、廃棄物の削減と環境負荷の低い代替プロセスの開発が加速しており、酵素合成のようなグリーンケミストリーの原則に基づいた技術への関心が高まっています。持続可能な製造方法への移行は、今後も市場の重要な推進力となるでしょう。
政府からの資金提供と研究開発の促進: 米国国立衛生研究所(NIH)によるRNA研究への助成金など、政府からの資金提供は、新しい生産方法や治療法の開発を強力に後押ししています。これらの投資は、基礎研究から臨床応用への橋渡しを促進し、オリゴヌクレオチド合成技術の革新と市場拡大に不可欠な要素となっています。
治療領域の多様化と応用範囲の拡大: オリゴヌクレオチド医薬品は、遺伝子疾患、がん、感染症など、幅広い治療領域での応用が期待されています。アンチセンスオリゴヌクレオチド(ASO)、siRNA、miRNA、アプタマーなど、様々な種類の核酸医薬品が開発されており、それぞれの特性に応じた合成技術の最適化が進められています。この治療領域の多様化が、市場の成長をさらに加速させています。
このレポートは、世界のオリゴヌクレオチド合成市場に焦点を当て、その現状、成長予測、主要な推進要因と抑制要因、および競争環境を詳細に分析しています。
市場定義と範囲:
本調査では、研究、診断、治療グレードで販売される短鎖DNA、RNA、および化学修飾オリゴヌクレオチドの化学合成から生じる収益を市場と定義しています。これには、関連する試薬、専用の合成装置、および受託合成サービスが含まれます。ただし、オリゴヌクレオチドを含む最終的な医薬品は、市場規模の算出から除外されています。
市場規模と成長予測:
オリゴヌクレオチド合成市場は、2025年には38.4億米ドルに達すると予測されており、2030年までに年平均成長率(CAGR)12.34%で成長し、68.7億米ドルに達すると見込まれています。
市場の推進要因:
市場の成長を牽引する主な要因は多岐にわたります。パンデミック後の政府資金の急増、先進診断における合成オリゴヌクレオチドの臨床採用の拡大、受託開発製造(CDMO)能力の継続的な拡大が挙げられます。さらに、主要な特許切れが次世代のアンチセンスおよびRNA治療薬の開発を促進していること、マイクロアレイベースの超高スループット合成プラットフォームの登場、そして酵素的ベンチトップ型「DNAプリンター」の発売パイプラインも、市場拡大の重要な推進力となっています。
市場の抑制要因:
一方で、市場の成長を抑制するいくつかの課題も存在します。これには、オリゴヌクレオチドの高額な精製および品質管理コストの継続、CRISPR/遺伝子編集配列に関する知的財産(IP)紛争、特殊なホスホラミダイトの供給ボトルネック、およびPFAS(有機フッ素化合物)に関連するフッ素化核酸に対する環境規制などが含まれます。
市場のセグメンテーション:
市場は、製品タイプ(合成オリゴヌクレオチド製品、試薬、装置、サービス)、化学(DNA、RNA、LNA/PNA/モルフォリノ)、用途(研究、診断、治療)、エンドユーザー(学術研究機関、製薬・バイオテクノロジー企業、病院・診断ラボ)、および地域(北米、欧州、アジア太平洋、中東・アフリカ、南米)によって詳細に分析されています。
地域別洞察と主要プレイヤー:
地域別では、中国と韓国が主導するアジア太平洋地域が、多額の資金調達と新たな製造施設の設立により、最も急成長している市場として注目されています。主要な市場プレイヤーには、Thermo Fisher Scientific、Agilent Technologies、Merck KGaA、Bio-Synthesis Inc.、Eurofins Scientificなどが挙げられます。
調査手法の信頼性:
本レポートの調査手法は、一次調査(治療薬開発者、ゲノミクス施設責任者、試薬販売業者へのインタビュー)と二次調査(FDA、NIH、WIPO、OECDなどの公開データ、業界団体ポータル、学術誌など)を組み合わせた堅牢なものです。市場規模の算出と予測は、トップダウンとボトムアップの両方のアプローチを用いて行われ、多変量回帰分析とシナリオ分析が適用されています。
特に、本レポートはオリゴヌクレオチド合成の収益に焦点を絞り、インタビューで確認された平均販売価格を使用し、毎年更新されることで、他の調査で生じがちな二重計上や古い仮定を排除し、信頼性の高いベースラインを提供している点が強調されています。他の調査が最終医薬品や遺伝子合成、CDMO収益を含めたり、定価に依存したりするのに対し、本レポートはより厳密な範囲設定と検証されたデータに基づいています。

1. はじめに
- 1.1 調査の前提条件 & 市場の定義
- 1.2 調査範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場概況
- 4.1 市場概要
-
4.2 市場の推進要因
- 4.2.1 パンデミック後の政府資金の急増
- 4.2.2 先進診断における合成オリゴの臨床導入
- 4.2.3 医薬品受託開発製造(CDMO)能力の拡大
- 4.2.4 次世代アンチセンス/RNA治療薬を推進する特許切れ
- 4.2.5 マイクロアレイベースの超ハイスループット合成プラットフォーム
- 4.2.6 酵素的、ベンチトップ型「DNAプリンター」の発売パイプライン
-
4.3 市場の阻害要因
- 4.3.1 継続的な高純度化および品質管理コスト
- 4.3.2 CRISPR/遺伝子編集配列に関する知的財産紛争
- 4.3.3 特殊ホスホラミダイトの供給ボトルネック
- 4.3.4 PFAS関連のフッ素化核酸に関する環境規制
- 4.4 バリュー/サプライチェーン分析
- 4.5 規制環境
- 4.6 技術的展望
-
4.7 ポーターの5つの力分析
- 4.7.1 新規参入の脅威
- 4.7.2 買い手の交渉力
- 4.7.3 供給者の交渉力
- 4.7.4 代替品の脅威
- 4.7.5 競争の激しさ
5. 市場規模と成長予測(金額、米ドル)
-
5.1 製品タイプ別
- 5.1.1 合成オリゴヌクレオチド製品
- 5.1.2 試薬
- 5.1.3 機器
- 5.1.4 サービス
-
5.2 化学別
- 5.2.1 DNA(ホスホラミダイト)
- 5.2.2 RNA
- 5.2.3 LNA / PNA / モルフォリノ
-
5.3 用途別
- 5.3.1 研究
- 5.3.2 診断
- 5.3.3 治療
-
5.4 エンドユーザー別
- 5.4.1 学術研究機関
- 5.4.2 製薬・バイオテクノロジー企業
- 5.4.3 病院・診断検査機関
-
5.5 地域別
- 5.5.1 北米
- 5.5.1.1 米国
- 5.5.1.2 カナダ
- 5.5.1.3 メキシコ
- 5.5.2 ヨーロッパ
- 5.5.2.1 ドイツ
- 5.5.2.2 イギリス
- 5.5.2.3 フランス
- 5.5.2.4 イタリア
- 5.5.2.5 スペイン
- 5.5.2.6 その他のヨーロッパ
- 5.5.3 アジア太平洋
- 5.5.3.1 中国
- 5.5.3.2 日本
- 5.5.3.3 インド
- 5.5.3.4 オーストラリア
- 5.5.3.5 韓国
- 5.5.3.6 その他のアジア太平洋
- 5.5.4 中東・アフリカ
- 5.5.4.1 GCC
- 5.5.4.2 南アフリカ
- 5.5.4.3 その他のMEA
- 5.5.5 南米
- 5.5.5.1 ブラジル
- 5.5.5.2 アルゼンチン
- 5.5.5.3 その他の南米
6. 競合情勢
- 6.1 市場集中度
- 6.2 市場シェア分析
-
6.3 企業プロファイル(グローバルレベルの概要、市場レベルの概要、主要セグメント、利用可能な財務情報、戦略情報、主要企業の市場ランキング/シェア、製品&サービス、および最近の動向を含む)
- 6.3.1 アジレント・テクノロジーズ
- 6.3.2 サーモフィッシャーサイエンティフィック
- 6.3.3 メルクKGaA(シグマアルドリッチ)
- 6.3.4 ダナハー(IDT)
- 6.3.5 ユーロフィン・サイエンティフィック
- 6.3.6 カネカ(ユーロジェンテック)
- 6.3.7 ジェンスクリプト
- 6.3.8 LGCバイオサーチテクノロジーズ
- 6.3.9 マラバイ・ライフサイエンス(トライリンク)
- 6.3.10 バイオジェン
- 6.3.11 サレプタ・セラピューティクス
- 6.3.12 ツイスト・バイオサイエンス
- 6.3.13 インテグレーテッドDNAテクノロジーズ
- 6.3.14 バイオニア
- 6.3.15 バイオシンセシス株式会社
- 6.3.16 バイオレジオ
- 6.3.17 GEヘルスケア(サイティバ)
- 6.3.18 シンバイオテクノロジーズ
- 6.3.19 クリエイティブ・バイオジーン
- 6.3.20 ビバンティス・テクノロジーズ
- 6.3.21 マクロジェン
7. 市場機会&将来展望
*** 本調査レポートに関するお問い合わせ ***

オリゴヌクレオチド合成は、特定の塩基配列を持つ短い核酸鎖(DNAやRNA、あるいはそれらの修飾体)を化学的に人工的に作り出す技術でございます。この技術は、分子生物学研究、診断薬開発、そして核酸医薬の創出といった多岐にわたる分野において、基盤となる重要な役割を担っております。天然の核酸は遺伝情報の担い手であり、その機能は配列によって厳密に決定されますが、オリゴヌクレオチド合成によって、研究者や開発者は目的とする機能を持つ核酸を自由に設計し、合成することが可能になります。
オリゴヌクレオチド合成の主要な方法は、固相合成法であり、その中でもホスホラミダイト法が広く用いられております。この方法では、まず不溶性の固相支持体(例えば、CPGガラスやポリスチレン樹脂など)に最初のヌクレオチドを結合させます。その後、以下の四つの化学反応サイクルを繰り返すことで、目的の配列を持つオリゴヌクレオチドを段階的に伸長させていきます。第一に、固相に結合したヌクレオチドの5'末端にある保護基(通常はDMTr基)を除去する「脱保護」ステップです。これにより、次のヌクレオチドが結合するための反応点が露出します。第二に、活性化されたホスホラミダイトヌクレオチドを、露出した5'ヒドロキシル基に結合させる「カップリング」ステップです。この反応により、リン酸トリエステル結合が形成されます。第三に、未反応の5'ヒドロキシル基をアセチル化して不活性化する「キャッピング」ステップです。これは、次のサイクルで不完全な配列のオリゴヌクレオチドが生成されるのを防ぎ、最終的な純度を高めるために重要です。第四に、形成されたリン酸トリエステル結合を、より安定なリン酸ジエステル結合に酸化する「酸化」ステップです。これらのサイクルを繰り返すことで、目的の長さと配列を持つオリゴヌクレオチドが合成されます。最後に、固相からオリゴヌクレオチドを切り離し、全ての保護基を除去することで、最終的な製品が得られます。この固相合成法は、自動化が容易であり、比較的高い収率と純度でオリゴヌクレオチドを合成できるという利点がございます。液相合成法も存在しますが、固相合成法に比べて精製が複雑であるため、特殊な用途を除いてはあまり一般的ではございません。近年では、酵素を用いた合成法も研究されておりますが、化学合成法が依然として主流でございます。
オリゴヌクレオチド合成の用途は非常に広範にわたります。分子生物学研究においては、ポリメラーゼ連鎖反応(PCR)やDNAシーケンシングのプライマーとして不可欠であり、遺伝子クローニング、部位特異的変異導入、遺伝子発現解析など、あらゆる実験の基盤となっております。また、遺伝子サイレンシングを目的としたsiRNA(低分子干渉RNA)やアンチセンスオリゴヌクレオチド、CRISPR-Cas9システムにおけるガイドRNAの合成にも用いられます。診断薬分野では、病原体の検出や遺伝子疾患の診断に用いられるプローブやプライマーとして利用され、迅速かつ高感度な検査を可能にしております。最も注目されているのは医薬品開発分野で、核酸医薬としてアンチセンスオリゴヌクレオチド、siRNA、アプタマー、そして近年ではmRNAワクチンなどが実用化され、難病治療や感染症予防に貢献しております。さらに、DNAナノテクノロジーやDNAオリガミといった材料科学分野においても、自己集合性を持つDNA構造体の構築に利用され、バイオセンサーやナノデバイスへの応用が期待されております。
関連技術としては、まずDNAシーケンシング技術が挙げられます。オリゴヌクレオチドは、サンガー法や次世代シーケンサー(NGS)におけるライブラリ調製のためのプライマーとして不可欠でございます。また、遺伝子編集技術、特にCRISPR-Cas9システムにおいては、標的遺伝子を正確に認識するためのガイドRNAがオリゴヌクレオチド合成によって供給されます。多数のオリゴヌクレオチドを基板上に固定したDNAマイクロアレイは、遺伝子発現プロファイリングやSNP解析に利用されます。オリゴヌクレオチドの合成を効率的かつ高精度に行うための自動合成装置は、この技術の普及に大きく貢献いたしました。合成後のオリゴヌクレオチドの品質を保証するためには、高速液体クロマトグラフィー(HPLC)やゲル電気泳動による精製技術、そして質量分析(MALDI-TOF MS)やUVスペクトル分析による品質管理技術が不可欠でございます。
市場背景としましては、核酸医薬の急速な発展が、オリゴヌクレオチド合成市場の主要な牽引役となっております。アンチセンス医薬やsiRNA医薬の承認、そしてCOVID-19パンデミックにおけるmRNAワクチンの成功は、この分野への投資を加速させました。また、個別化医療の進展に伴う遺伝子診断の需要増加、ゲノム編集技術の応用拡大、そして基礎研究における需要の安定的な増加も市場成長を後押ししております。主要なプレイヤーとしては、受託合成サービスを提供する企業(例:Integrated DNA Technologies (IDT), Eurofins Genomicsなど)、合成装置メーカー、そして合成に必要な試薬を提供する企業が挙げられます。市場は今後も堅調な成長が見込まれておりますが、長鎖オリゴヌクレオチドの合成効率の向上、高純度化のコスト削減、そして多様な修飾核酸の合成技術の確立が課題として残されております。
将来展望としましては、オリゴヌクレオチド合成技術はさらなる進化を遂げると考えられます。より長鎖で複雑な配列、例えば数百塩基を超えるオリゴヌクレオチドや、多様な化学修飾を持つ核酸の合成技術が発展することで、新たな機能性分子の創出が可能になるでしょう。合成プロセスの高効率化と低コスト化は、マイクロ流体技術や酵素合成法の改良によって実現され、より広範な研究者や産業界がこの技術を利用できるようになることが期待されます。核酸医薬の分野では、RNAi、アンチセンス、アプタマー、mRNAワクチンといった既存のモダリティに加え、新たな作用機序を持つ核酸医薬の開発が進むことで、これまで治療が困難であった疾患に対する画期的な治療法が生まれる可能性がございます。ゲノム編集技術の応用拡大に伴い、in vivoでのガイドRNAの効率的な送達技術や、より特異性の高いガイドRNAの設計・合成が重要になります。さらに、DNAを情報記録媒体として利用するDNAストレージ技術は、将来のデータ保存のソリューションとして大きな可能性を秘めており、オリゴヌクレオチド合成はその基盤技術となるでしょう。AIや機械学習の活用により、最適な配列設計や合成プロセスの最適化が進むことで、オリゴヌクレオチド合成は今後も生命科学と医療の発展に不可欠な技術として、その重要性を増していくことと存じます。