腫瘍学臨床試験市場の規模と展望、2026-2034

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
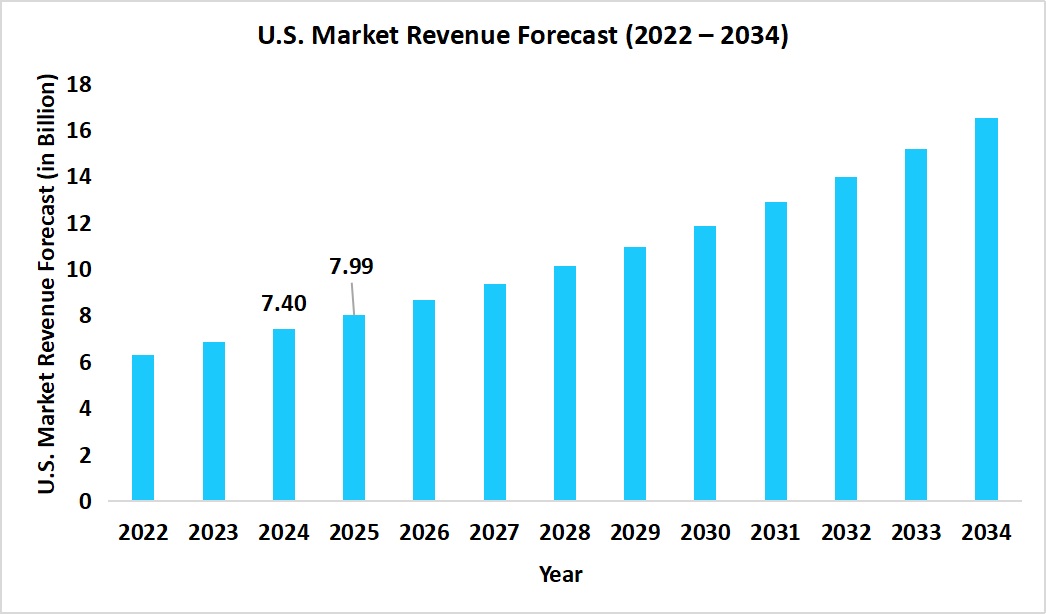
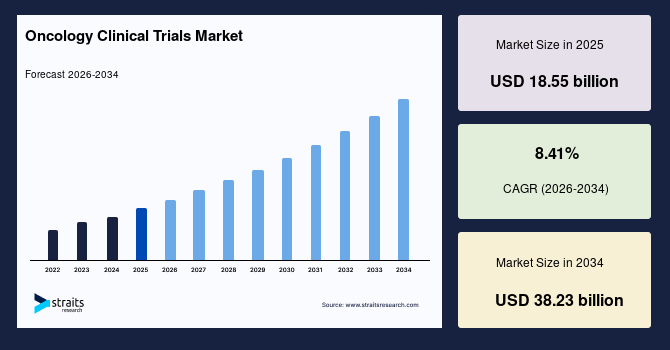
世界の腫瘍学臨床試験市場は、2025年に185.5億米ドルと推定され、2034年までに382.3億米ドルに達する見込みであり、予測期間中の年平均成長率(CAGR)は8.41%と予測されています。この市場の顕著な成長は、免疫腫瘍学分野の進展や、個別化医療への関心の高まりによって推進されており、標的治療および併用療法を評価する試験への強い需要が生まれています。
腫瘍学臨床試験市場は、乳がん、メラノーマ、大腸がん、前立腺がん、肺がん、その他の悪性腫瘍を含む複数のがんの革新的な療法および治療アプローチを評価する研究を含んでいます。これらの試験は、初期の安全性評価から市販後の評価まで、各段階(フェーズI、フェーズII、フェーズIII、フェーズIV)で重要な役割を果たしています。試験のデザインに基づいて、腫瘍学臨床試験は介入研究、観察研究、拡張アクセス研究に分類され、新しい治療法の評価、結果のモニタリング、調査治療の提供を目的としています。
腫瘍学臨床試験市場のエコシステムは、製薬会社やバイオテクノロジー企業、臨床研究機関、学術機関、規制機関で構成されており、これらが共同で臨床開発を推進し、患者の募集を円滑にし、標的、免疫腫瘍学、併用療法の進展を支援して、がん治療の成果を向上させています。腫瘍学研究は、細胞および遺伝子治療(CGT)に強く移行し、CAR TおよびTCRプラットフォームが血液腫瘍を超えて新たな腫瘍タイプに拡大しています。規制機関は新しい細胞ベースの治療法を承認し続け、世界中で多くの初期フェーズ研究が開始されています。
米国のFDAの腫瘍学優秀センター(OCE)やCBERは、精密診断に関連する新しい細胞ベースの製品の承認を報告しており、ClinicalTrials.govは、世界中のサイトで進行中のCAR T/TCR研究の高い数を示しています。この傾向は、より多くのフェーズ1/2のパイプラインを促進し、多施設試験ネットワークの成長を助長しました。より多くの企業がCGTプログラムに投資することで、腫瘍学臨床試験市場の勢いが増し、革新が拡大し、患者の次世代療法へのアクセスが向上しました。
腫瘍学の風景は、放射性医薬品のニッチな使用から、さまざまながんにおける広範なパイプラインへとシフトしました。前立腺がん及び神経内分泌腫瘍に限られていた放射性リガンド療法(RLT)は、今では早期治療ライン、併用療法、新たな適応症で試験されています。ノバルティス社は年次報告書で、Pluvictoの世界的な展開とMariana Oncologyの買収により、放射性リガンドの革新に対する強いコミットメントを示しました。この勢いは、より多くのスポンサーが用量探索および多施設研究を設計することを促し、試験の範囲と患者群を拡大しました。
腫瘍学臨床試験市場の主要な推進要因の一つは、国内メーカーによって開発された腫瘍学薬の強力なパイプラインであり、これはがん療法の臨床研究と革新を促進しています。このような要因は、市場の成長を支える強力なパイプラインを示し、患者の治療選択肢を拡大しました。製薬会社による腫瘍学研究および製造施設の拡大への投資が市場の成長を推進しています。
さらに、腫瘍学臨床試験市場における課題の一つは、これらの研究を実施する際のコストと複雑さの増加です。2024年2月、国立がん研究所(NCI)は、がん試験は立ち上げと運営が高額であり、多くのテスト、実験室作業、その他のプロトコル要件が研究のタイムラインを延ばすことを強調しました。このような複雑さは、患者、介護者、研究者の疲労を引き起こし、効果的ながん予防および治療アプローチの提供を遅延させる可能性があります。
米国FDAのダイバーシティアクションプランは、スポンサーがより包括的な腫瘍学試験を設計するための大きな機会を創出しました。これらのプランは、企業に対して人種、民族、性別、年齢による明確な募集目標を設定し、それを達成する方法を説明することを要求しました。この変化は、対象となる患者基盤を広げ、実際の人口における試験の関連性を向上させました。FDAはFDORAの下で草案ガイダンスを発行し、2024年末までにいくつかのスポンサーがすでにプロトコルを更新し、ダイバーシティの期待に沿うように新しい地域サイトを追加しました。この方針は、試験ネットワークを拡大し、募集の障壁を減少させ、データの一般化可能性を向上させています。
北米地域は、2025年における市場の収益シェアが47.92%であり、マーケットを支配しています。北米市場は、電子健康記録、バイオバンク、人口ゲノミクスプロジェクトの統合によって、試験の募集とモニタリングが円滑に進んだため、強く成長しました。米国におけるNIHのAll of Usプログラムは、2024年までに10万人以上の参加者にゲノム結果を返すことで、試験準備が整ったデータベースを拡大し、個別化試験デザインを向上させました。この統合により、患者の特定の障壁が減少し、試験の多様性が向上し、スポンサーが腫瘍学試験を迅速かつ正確に実施するのに役立ちました。
アジア太平洋地域は、予測期間中にCAGRが9.52%と最も成長が期待されており、精密医療プログラムへの強力な政府の支援とゲノムインフラへの大規模な投資がその要因です。中国、日本、韓国などの国々は、がん検査および試験参加のアクセスと手頃な価格を向上させました。これらの取り組みは、地域全体での腫瘍学試験の増加を促進しました。
欧州では、医療インフラおよび患者ケア基準の継続的な進展によって市場が安定した成長を見せています。欧州諸国全体での診断および治療プロトコルの最新化が、革新的な治療アプローチの採用を促進しています。スペインでは、年齢層におけるがん負担の増加を支えに、腫瘍学臨床試験市場が大きく拡大しています。がんリスクは年齢とともに著しく増加し、80~84歳の男性の47.8%、女性の32.7%に達しています。この増加する発生率は、先進的な治療介入の緊急性と、臨床研究を通じての革新的な腫瘍学治療の継続的な発展の必要性を強調しています。
中東およびアフリカでは、腫瘍学臨床試験市場が急速な進展を遂げており、がん治療インフラの発展と腫瘍学薬へのアクセスの向上がその要因です。サウジアラビア、UAE、南アフリカなどの国々は、がんの診断、治療、研究能力を向上させるために専門のがんセンターへの大規模な投資を行っています。南アフリカでは、腫瘍学臨床試験市場が、幼児がんケアを向上させるための取り組みの増加によって tractionを得ています。小児腫瘍学施設統合地方進化(ProFILE)ツールの実施により、全国的に小児腫瘍学サービスの体系的な評価と改善が可能になっています。がんケアの提供がより構造化され、公平でアクセス可能なものになるにつれて、革新的な腫瘍学薬および幼児がん治療の需要が高まり、南アフリカの市場の成長に大きく寄与することが期待されています。
Report Coverage & Structure
腫瘍学臨床試験レポートの構造概要
このレポートは、腫瘍学臨床試験に関する詳細な市場分析を提供しており、以下のように論理的なセクションに分かれています。
1. エグゼクティブサマリーと研究の範囲
最初のセクションでは、腫瘍学臨床試験の市場に関するエグゼクティブサマリーが提示され、研究の目的や範囲、制約、仮定が明確にされます。市場のスコープやセグメンテーション、考慮された通貨と価格設定についても説明されています。
2. 市場機会評価
このセクションでは、腫瘍学臨床試験の新興地域や国、新興企業、そして新興アプリケーションや最終用途に関する詳細な評価が行われます。
3. 市場動向
-
市場を駆動する要因や、警告サイン、最新のマクロ経済指標、地政学的影響、技術的要因についての分析が含まれています。
4. 市場評価
ポーターのファイブフォース分析やバリューチェーン分析を通じて、腫瘍学臨床試験市場の競争環境や構造が評価されます。
5. 規制フレームワーク
北米、欧州、アジア太平洋地域、中東およびアフリカ、ラテンアメリカにおける規制環境について詳細に議論されます。
6. ESGトレンド
環境・社会・ガバナンス(ESG)に関連するトレンドが腫瘍学臨床試験市場にどのように影響しているかについての考察があります。
7. グローバル腫瘍学臨床試験市場の詳細分析
-
市場のフェーズ別、タイプ別、研究別の詳細な分析が含まれ、各フェーズ(I-IV)の価値や、乳がん、黒色腫、大腸がん、前立腺がん、肺がんなどのがんのタイプ別のデータが提供されます。
8. 地域別市場分析
-
北米、欧州、アジア太平洋地域、中東およびアフリカの各地域における市場の詳細分析が行われ、各地域ごとのフェーズ、タイプ、研究の価値が評価されます。
全体を通じて、腫瘍学臨床試験に関する市場の動向、機会、競争環境、規制、地域別の特性について詳細に分析されており、業界関係者にとって価値のある情報が提供されています。
*** 本調査レポートに関するお問い合わせ ***

腫瘍学臨床試験(しゅようがくりんしょうしけん)とは、がんの治療法や診断法の有効性、安全性を評価するために設計された臨床試験のことを指します。これらの試験は、がん患者を対象に新しい薬剤、治療法、または治療の組み合わせが、既存の標準治療と比較してどのように効果を発揮するかを検証します。腫瘍学臨床試験は、がん治療の進歩に欠かせない重要なステップであり、医療の質を向上させるための基盤となっています。
腫瘍学臨床試験は、一般的にいくつかの段階に分かれて行われます。第一段階(フェーズ1)では、新薬の安全性や副作用を評価するためにごく少数の患者に投与されます。第二段階(フェーズ2)では、より多くの患者に対して効果を評価し、副作用のデータを収集します。第三段階(フェーズ3)では、広範な患者に対し、標準治療と比較して新しい治療法の効果を確認します。最終的に、これらの試験の結果が製薬会社や研究機関によって解析され、規制当局に提出されます。成功した場合、新薬は承認され、臨床で使用されるようになります。
腫瘍学臨床試験の用途は多岐にわたります。新しい抗がん剤の開発だけでなく、既存の治療法の改善や、治療の個別化を目的とした試験も含まれます。例えば、特定の遺伝子変異を持つ患者に対して特化した治療法を試験することで、より効果的な治療が実現する可能性があります。また、免疫療法や標的治療など、最近注目されている新しい治療法も多数の臨床試験を経て実用化されています。
腫瘍学臨床試験には、近年発展しているさまざまな関連技術も影響を与えています。例えば、次世代シーケンシング(NGS)技術を用いることで、患者のがんの遺伝的特性を詳細に把握し、個別化医療の実現が進んでいます。また、バイオマーカーの研究も重要な役割を果たしており、これにより治療の効果を予測する手法が進化しています。さらに、デジタル技術や人工知能(AI)の導入により、臨床試験のデータ管理や解析が効率化され、試験の質が向上しています。
腫瘍学臨床試験は、がん治療における新たな可能性を切り開く重要な取り組みであり、患者の治療選択肢を増やすことに寄与しています。患者の参加があってこそ、これらの試験は成り立ち、未来のがん治療の発展に繋がるのです。したがって、腫瘍学臨床試験は、医療界だけでなく、社会全体にとっても意義深い活動であると言えるでしょう。