オルガノイド市場:市場規模・シェア分析 – 成長動向と予測 (2026-2031年)
オルガノイド市場レポートは、タイプ(幹細胞由来オルガノイド、腫瘍由来オルガノイド)、用途(創薬・スクリーニング、疾患・毒性モデリングなど)、エンドユーザー(製薬・バイオテクノロジー企業、学術・研究機関など)、テクノロジー(スキャフォールドベース3D培養など)、および地域(北米など)によって分類されます。市場予測は、金額(米ドル)で提供されます。

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
オルガノイド市場の概要
オルガノイド市場は、動物実験の段階的廃止を求める規制要件、急速に成熟する3Dバイオプリンティング技術、そしてヒト関連疾患モデルへの製薬業界の移行という3つの主要な推進要因によって、力強い成長を遂げると予測されています。
市場規模と成長予測
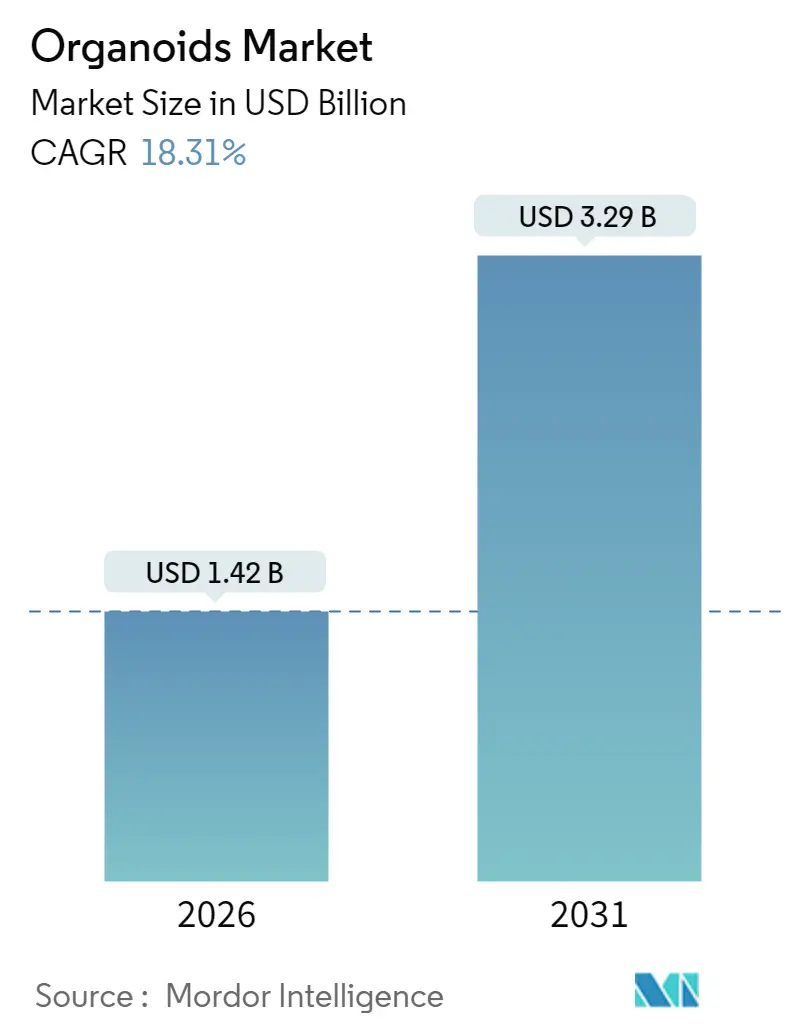
オルガノイド市場は、2025年の12.0億米ドルから2026年には14.2億米ドルに成長し、2031年までには32.9億米ドルに達すると予測されています。2026年から2031年までの年平均成長率(CAGR)は18.31%と見込まれています。
主要な推進要因
* 規制要件の変化: FDA Modernization Act 2.0により、新薬申請における動物実験の義務が撤廃され、欧州の規制当局もオルガノイドの安全性評価基準を準備しています。これにより、ヒトオルガノイドを用いた企業はコストと時間の面で優位に立ち、3Dヒトモデルの採用が加速しています。
* 3Dバイオプリンティング技術の成熟: スタンフォード大学で開発された血管新生心臓・肝臓オルガノイドは、かつて製造を制限していたサイズ障壁を取り除きました。また、マトリックスフリープロトコルは、細胞外ハイドロゲルの長年のコスト負担を軽減しています。
* ヒト関連疾患モデルへの移行: がん治療プログラムでは、高い脱落率を削減するために患者由来腫瘍オルガノイドへの依存度が高まっています。これにより、臨床試験前に複数の薬物組み合わせを患者の生物学に対してスクリーニングすることが可能になり、耐性メカニズムのリアルタイムな洞察や適応的投与戦略に役立っています。
* CRO(医薬品開発業務受託機関)の役割拡大: CROはターンキーオルガノイドサービスを拡大しており、小規模なバイオテクノロジー企業が複雑な培養ワークフローを外部委託することで、オルガノイド市場にさらなる勢いを与えています。
* CRISPR編集「次世代」オルガノイドによる知的財産競争: CRISPRの精密性と3D培養の組み合わせは、新たな特許ランドスケープを生み出しています。疾患を模倣したり、単一ヌクレオチド精度で標的検証を可能にする改変オルガノイドは、合成致死スクリーニング、カスタマイズされた細胞治療、機能ゲノミクスアッセイの基盤となっています。製薬大手は、専門のバイオテクノロジー企業を買収したり、独自の編集プロトコルやバイオプリントされた構造物へのアクセスを確保するオプション契約を結んだりすることで、独占権を確保しています。
市場の阻害要因
* 高額な消耗品コストと特殊なECMハイドロゲル: Matrigelのような動物由来マトリックスは高価であり、培養費用の最大60%を占めることがあります。また、バッチ間のばらつきは高額な検証サイクルを引き起こします。合成または人工ハイドロゲルやマトリックスフリープロトコルが解決策として期待されていますが、新たな標準作業手順や広範な細胞株の再認定が必要です。
* アッセイ間の再現性標準の欠如: 培地のレシピ、継代数、分析エンドポイントの不均一性は、施設間のデータ整合性を損ないます。規制当局は、オルガノイドベースの毒性試験を受け入れるための前提条件として再現性を挙げています。業界と学術界は、機能的ベンチマーク、ゲノム忠実度、参照コントロールを定義する認定ガイドラインで協力しています。
市場のセグメント分析
* タイプ別:
* 幹細胞由来システム: 2025年にはオルガノイド市場シェアの62.94%を占め、標準化されたスクリーニング要件への適合性を示しています。予測可能な増殖率と明確な知的財産経路が強みです。
* 腫瘍由来モデル: 2031年まで19.18%のCAGRで成長すると予測されており、がんセンターが治療層別化のために患者特異的なアバターを求めることで需要が高まっています。
* 用途別:
* 創薬・スクリーニング: 2025年にはオルガノイド市場規模の41.42%を占め、製薬業界が脱落率を下げ、毒性リスクを早期に発見する必要性に対応しています。
* 精密医療・個別化医療: 19.84%のCAGRで最も高い成長軌道を示しています。特に結腸直腸がんや膵臓がんにおけるオルガノイドガイド治療決定の規制上の認識が、迅速な償還経路を確立しています。
* 技術別:
* 足場ベースの3D培養: 2025年には収益シェアの47.55%を占め、そのプラグアンドプレイの性質と既製の試薬が強みです。
* 3Dバイオプリンティング支援システム: 20.74%のCAGRで成長しており、FRESH法のような埋め込み型バイオプリンティング技術は、灌流可能なネットワークを持つセンチメートルスケールの構造物を可能にし、オルガノイドを前臨床臓器置換に近づけています。
* エンドユーザー別:
* 製薬・バイオテクノロジー企業: 2025年の需要の54.92%を占め、豊富な資金と社内規制対応チームがオルガノイドデータを新薬申請に導いています。
* CRO: 20.21%のCAGRで最も速い成長を記録しており、社内でバイオプリンティング施設を構築する意思や能力がない企業向けに専門知識を提供しています。
* 地域別:
* 北米: 2025年にはオルガノイド市場の43.88%の収益を占め、FDAのロードマップやNIHからの潤沢な資金提供に支えられています。
* アジア太平洋地域: 2031年まで21.38%のCAGRで最も速い成長を遂げると予測されています。中国の第14次5カ年計画における再生医療の優先順位付けや、日本の細胞ベース治療に対する成熟した規制経路が成長を後押ししています。
競争環境
約75社がバイオプリンティング、マトリックスエンジニアリング、オルガノイドバイオバンキングの分野で事業を展開しており、市場は細分化されつつも急速に統合が進んでいます。Thermo Fisher ScientificやMerck KGaAのような大手企業は、戦略的な買収を通じて市場での存在感を強化しています。新興企業は、血管新生法、自動画像AIスイート、特許取得済みのCRISPR編集ワークフローなどで差別化を図っています。希少疾患モデリング、既製の免疫腫瘍オルガノイド、GMPグレードのバイオバンキングなど、未開拓の機会も存在します。
主要企業と最近の業界動向
主要企業には、Merck KGaA、Cellesce Ltd、3Dnamics Inc.、R&D Systems, Inc.、Hubrecht Organoid Technologyなどが挙げられます。
最近の注目すべき進展としては、2025年6月にスタンフォード大学の科学者が拡散限界を克服する血管新生心臓・肝臓オルガノイドを生成したこと、2025年3月にSernova Biotherapeuticsが甲状腺機能低下症向けのCell Pouchバイオハイブリッド臓器についてFDAのIND承認を得たこと、2024年4月にACROBiosystemsがスクリーニング用の脳および心臓オルガノイドラインを提供するOrganoid Toolboxを発売したことなどがあります。
オルガノイド市場は、技術革新と規制環境の変化に後押しされ、今後も大きな成長が期待される分野です。
本レポートは、実際の臓器の物理的・機能的特性を模倣したミニチュア臓器である「オルガノイド」市場に関する詳細な分析を提供しています。オルガノイドは、創薬開発、薬剤毒性評価、疾患モデリングなどの臨床研究において広く活用されています。
市場規模と成長予測
オルガノイド市場は、2026年には14.2億米ドル、2031年には32.9億米ドルに達すると予測されており、予測期間中の年平均成長率(CAGR)は18.31%と、顕著な成長が見込まれています。
市場の主要な推進要因
市場成長を牽引する主な要因としては、以下が挙げられます。
* 腫瘍薬物探索パイプラインにおけるオルガノイドの急速な採用。
* 患者由来オルガノイドを用いた精密医療試験の増加。
* 動物実験承認の減少に伴う3Dヒトモデルへの移行の加速。
* 幹細胞および3D培養インフラに対する政府助成金の増加。
* オルガノイドバイオバンクの収益化モデルの出現。
* CRISPR編集による「次世代」オルガノイドが引き起こす知的財産(IP)競争。
市場の主要な抑制要因
一方で、市場の成長を抑制する要因も存在します。
* 高額な消耗品コストと特殊な細胞外マトリックス(ECM)ハイドロゲルの必要性。
* アッセイ間の再現性標準の欠如。
* 胚様ガストルロイド研究に対する倫理的監視。
* 生きたオルガノイド輸送のためのコールドチェーン物流の限定性。
市場セグメンテーションの概要
本レポートでは、オルガノイド市場を以下の主要なセグメントに分けて分析しています。
* タイプ別: 幹細胞由来オルガノイド、腫瘍由来オルガノイド。
* アプリケーション別: 創薬・スクリーニング、疾患・毒性モデリング、精密・個別化医療、再生医療、その他(遺伝子編集検証など)。
* エンドユーザー別: 製薬・バイオテクノロジー企業、学術・研究機関、CROs(医薬品開発業務受託機関)・CDMOs(医薬品開発製造受託機関)、病院・診断ラボ。
* 技術別: スキャフォールドベース3D培養、スキャフォールドフリー/浮遊培養、マイクロ流体/臓器チップ統合型、3Dバイオプリンティング支援オルガノイド。
* 地域別: 北米(米国、カナダ、メキシコ)、欧州(ドイツ、英国、フランス、イタリア、スペイン、その他欧州)、アジア太平洋(中国、インド、日本、韓国、オーストラリア、その他アジア太平洋)、南米(ブラジル、アルゼンチン、その他南米)、中東・アフリカ(GCC、南アフリカ、その他中東・アフリカ)。
主要なセグメントの洞察
* アプリケーション別: 創薬・スクリーニングが2025年の収益の41.42%を占め、最大の需要分野となっています。これは、オルガノイドが動物モデルよりも予測性の高いヒトデータを提供できるためです。
* エンドユーザー別: CROsは、小規模なバイオテクノロジー企業が多額の設備投資なしに専門的な培養・分析にアクセスできるため、オルガノイドプラットフォームの採用が加速しており、このセグメントは20.21%のCAGRで成長しています。
* 地域別: アジア太平洋地域は、中国、日本、韓国が再生医療と3D培養インフラに公的・民間資金を投入していることから、21.38%のCAGRで最も急速に拡大すると予測されています。
規制環境の影響
FDA近代化法2.0や同様のEUの取り組みにより、動物実験の義務が撤廃され、医薬品開発者が検証済みの3Dヒトシステムを採用するインセンティブが高まっています。これは、オルガノイド市場の成長を後押しする重要な要因です。
競争環境と将来展望
レポートでは、市場集中度、市場シェア分析に加え、Thermo Fisher Scientific Inc.、Merck KGaA、Corning Inc.など20社の主要企業のプロファイルを通じて、競争環境を詳細に分析しています。また、市場の機会と将来の展望、満たされていないニーズについても評価しています。
1. はじめに
- 1.1 調査の前提と市場の定義
- 1.2 調査範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場概況
- 4.1 市場概要
- 4.2 市場の推進要因
- 4.2.1 腫瘍薬物探索パイプラインにおける急速な採用
- 4.2.2 患者由来オルガノイドを用いた精密医療試験の増加
- 4.2.3 動物実験承認の減少が3Dヒトモデルを促進
- 4.2.4 幹細胞および3D培養インフラに対する政府助成金
- 4.2.5 オルガノイドバイオバンクの収益化モデルの出現
- 4.2.6 CRISPR編集された「次世代」オルガノイドがIP競争を創出
- 4.3 市場の阻害要因
- 4.3.1 高い消耗品コストと特殊なECMハイドロゲル
- 4.3.2 アッセイ間の再現性標準の欠如
- 4.3.3 胚様ガストルロイド研究に対する倫理的精査
- 4.3.4 生体オルガノイド輸送のための限定的なコールドチェーンロジスティクス
- 4.4 バリュー/サプライチェーン分析
- 4.5 規制環境
- 4.6 技術的展望
- 4.7 ポーターの5つの力
- 4.7.1 新規参入の脅威
- 4.7.2 供給者の交渉力
- 4.7.3 買い手の交渉力
- 4.7.4 代替品の脅威
- 4.7.5 競争上の対立
- 4.8 オルガノイドバイオバンクの概況
5. 市場規模と成長予測(金額)
- 5.1 タイプ別
- 5.1.1 幹細胞由来オルガノイド
- 5.1.2 腫瘍由来オルガノイド
- 5.2 用途別
- 5.2.1 創薬 & スクリーニング
- 5.2.2 疾患 & 毒性モデリング
- 5.2.3 精密医療 & 個別化医療
- 5.2.4 再生医療
- 5.2.5 その他(例:遺伝子編集検証)
- 5.3 エンドユーザー別
- 5.3.1 製薬 & バイオテクノロジー企業
- 5.3.2 学術 & 研究機関
- 5.3.3 CRO & CDMO
- 5.3.4 病院 & 診断ラボ
- 5.4 技術別
- 5.4.1 足場ベース3D培養
- 5.4.2 足場なし/浮遊培養
- 5.4.3 マイクロ流体/臓器チップ統合型
- 5.4.4 3Dバイオプリンティング支援オルガノイド
- 5.5 地域別
- 5.5.1 北米
- 5.5.1.1 米国
- 5.5.1.2 カナダ
- 5.5.1.3 メキシコ
- 5.5.2 欧州
- 5.5.2.1 ドイツ
- 5.5.2.2 英国
- 5.5.2.3 フランス
- 5.5.2.4 イタリア
- 5.5.2.5 スペイン
- 5.5.2.6 その他の欧州
- 5.5.3 アジア太平洋
- 5.5.3.1 中国
- 5.5.3.2 インド
- 5.5.3.3 日本
- 5.5.3.4 韓国
- 5.5.3.5 オーストラリア
- 5.5.3.6 その他のアジア太平洋
- 5.5.4 南米
- 5.5.4.1 ブラジル
- 5.5.4.2 アルゼンチン
- 5.5.4.3 その他の南米
- 5.5.5 中東・アフリカ
- 5.5.5.1 GCC
- 5.5.5.2 南アフリカ
- 5.5.5.3 その他の中東・アフリカ
6. 競合情勢
- 6.1 市場集中度
- 6.2 市場シェア分析
- 6.3 企業プロファイル(グローバルレベルの概要、市場レベルの概要、主要セグメント、利用可能な財務情報、戦略情報、主要企業の市場ランク/シェア、製品・サービス、および最近の動向を含む)
- 6.3.1 Thermo Fisher Scientific Inc.
- 6.3.2 Merck KGaA
- 6.3.3 Corning Inc.
- 6.3.4 STEMCELL Technologies Inc.
- 6.3.5 Lonza Group AG
- 6.3.6 Greiner Bio-One International GmbH
- 6.3.7 Cellesce Ltd
- 6.3.8 Hubrecht Organoid Technology
- 6.3.9 Emulate Inc.
- 6.3.10 CN Bio Innovations Ltd
- 6.3.11 MIMETAS BV
- 6.3.12 InSphero AG
- 6.3.13 ATCC
- 6.3.14 Sartorius AG
- 6.3.15 Eppendorf SE
- 6.3.16 Miltenyi Biotec B.V. & Co. KG
- 6.3.17 BICO Group AB
- 6.3.18 Hubrecht Organoid Biobank (Hub)
- 6.3.19 QGel SA
- 6.3.20 Advanced BioMatrix Inc.
7. 市場機会と将来展望
*** 本調査レポートに関するお問い合わせ ***

オルガノイドは、多能性幹細胞(ES細胞やiPS細胞など)や組織幹細胞から自己組織化能力を利用して作製される、生体内の臓器に似た三次元構造と機能を持つ細胞集合体のことを指します。しばしば「ミニ臓器」とも呼ばれ、従来の二次元細胞培養では再現が困難であった複雑な細胞間相互作用や組織構造、生理機能をin vitroで模倣できる画期的なモデルとして注目されています。特定の臓器の発生過程を再現しながら、その臓器特有の細胞種が分化し、機能的な組織を形成することが特徴です。これにより、生体内の環境をより忠実に再現した研究が可能となり、基礎研究から応用研究まで幅広い分野で活用が期待されています。
オルガノイドには様々な種類が存在し、研究対象となる臓器に応じて多岐にわたります。代表的なものとしては、脳オルガノイド、腸オルガノイド、肝臓オルガノイド、腎臓オルガノイド、膵臓オルガノイド、肺オルガノイド、胃オルガノイドなどが挙げられます。脳オルガノイドは、大脳皮質、小脳、網膜など、脳の特定の領域の構造や機能を持つように誘導され、神経疾患の研究に用いられます。腸オルガノイドは、小腸や大腸の絨毛構造やクリプト構造を再現し、消化器疾患や感染症の研究に有用です。また、患者由来オルガノイド(Patient-Derived Organoids, PDOs)は、患者から採取した組織や細胞を用いて作製され、個々の患者の疾患特性を反映するため、個別化医療の実現に向けた重要なツールとなっています。さらに、複数のオルガノイドを組み合わせることで、臓器間の相互作用を模倣する多臓器オルガノイドの研究も進められています。
オルガノイドの用途は非常に広範です。まず、疾患モデルとしての利用が挙げられます。遺伝性疾患、感染症、がん、神経変性疾患など、様々な疾患の病態メカニズムの解明に貢献しています。特に、患者由来オルガノイドは、個々の患者の遺伝的背景や薬剤応答性を反映するため、個別化医療における薬剤スクリーニングや治療法開発に大きな可能性を秘めています。次に、創薬スクリーニングへの応用です。新薬候補物質の有効性や毒性を評価する際に、動物実験の代替として、よりヒトの生理状態に近い環境で評価できるため、開発期間の短縮やコスト削減に寄与します。ハイスループットスクリーニングシステムと組み合わせることで、効率的な薬剤評価が可能です。また、発生生物学研究においては、臓器がどのように形成されるかという発生メカニズムの解明に不可欠なツールとなっています。再生医療の分野では、損傷した臓器の修復や置換のための細胞源や移植材料としての応用が期待されており、将来的にはオルガノイドそのものを移植する治療法の開発も視野に入れられています。さらに、環境化学物質や食品添加物などの安全性評価における毒性試験にも利用され、動物実験の削減に貢献しています。
オルガノイド技術の発展は、様々な関連技術の進歩と密接に関わっています。その基盤となるのは、iPS細胞やES細胞といった多能性幹細胞技術です。これらの幹細胞を効率的に分化誘導する技術の確立が、多様なオルガノイド作製の鍵となります。また、より複雑で生体に近い構造を持つオルガノイドを作製するためには、3Dバイオプリンティング技術が重要です。これにより、細胞の配置を精密に制御し、血管網や神経網などの構造を導入することが可能になります。マイクロ流体デバイス、いわゆる「Organ-on-a-chip」技術も関連が深く、オルガノイドをチップ上で培養し、生体内の血流や機械的刺激などの微小環境を再現することで、より生理的な応答を評価できます。複数のオルガノイドをチップ上で接続し、多臓器間の相互作用を研究する「Human-on-a-chip」も開発が進んでいます。ゲノム編集技術(CRISPR/Cas9など)は、疾患モデルの作製や遺伝子機能解析、さらには遺伝子治療法の開発において、オルガノイドの遺伝子を操作するために不可欠です。シングルセル解析技術は、オルガノイド内の細胞多様性や分化経路を詳細に解析し、その複雑な細胞構成を理解する上で重要な役割を果たします。さらに、オルガノイドの大量培養や均一な培養環境を提供するためのバイオリアクター技術も、実用化に向けて重要な要素となっています。
オルガノイドの市場背景は、近年急速な拡大を見せています。研究市場が中心であり、創薬企業、バイオベンチャー、アカデミアなど、幅広い分野での需要が増加しています。特に、動物実験代替の動きが世界的に加速していることや、個別化医療、プレシジョンメディシンの進展が市場を牽引しています。患者由来オルガノイドを用いた個別化医療の実現は、製薬企業にとって新たなビジネスチャンスを生み出しています。これに伴い、オルガノイド培養キット、専用培地、解析機器、自動化システムなどの関連製品やサービスのサプライヤーも成長を続けています。各国政府や研究機関からの投資も活発であり、基礎研究から臨床応用への橋渡しを支援する動きが強まっています。グローバル市場規模は今後も年率二桁成長を続けると予測されており、特に北米と欧州が市場をリードしていますが、アジア太平洋地域でも研究開発が活発化しています。
オルガノイドの将来展望は非常に明るい一方で、いくつかの課題も存在します。現在のオルガノイドは、生体内の臓器と比較して成熟度や機能性に限界があります。例えば、血管網や免疫細胞の欠如、神経支配の不十分さなどが挙げられ、これらがオルガノイドの生体模倣性を制限しています。これらの課題を克服するためには、血管化技術の導入、免疫細胞や神経細胞との共培養、より複雑な多臓器連携モデルの開発が不可欠です。また、オルガノイドの作製プロトコルの標準化や再現性の確保、大規模生産のコスト削減も実用化に向けた重要な課題です。倫理的な側面も議論されており、特に脳オルガノイドが意識を持つ可能性や、ヒト由来オルガノイドを動物に移植するヒト-動物キメラ研究における倫理的ガイドラインの策定が求められています。
しかし、これらの課題を乗り越えることで、オルガノイドは医療と生命科学に革命をもたらす可能性を秘めています。将来的には、血管化や神経支配、免疫細胞の導入により、より生体に近い機能を持つオルガノイドが開発され、疾患モデルや創薬スクリーニングの精度が飛躍的に向上するでしょう。AIや機械学習との融合により、オルガノイドから得られる膨大なデータを効率的に解析し、新たな発見を加速させることも期待されます。臨床応用においては、個別化医療の実現がさらに進み、患者一人ひとりに最適な治療法を選択できるようになるでしょう。再生医療分野では、損傷した臓器の機能回復を目指したオルガノイド移植治療が現実のものとなる可能性も秘めています。さらに、宇宙生物学研究において、宇宙環境がヒトの臓器に与える影響をオルガノイドで評価するなど、新たな応用分野も開拓されています。オルガノイド技術は、今後も生命科学研究と医療の最前線を牽引し、人類の健康と福祉に大きく貢献していくことでしょう。