ペプチド合成市場の規模・シェア分析、成長トレンドと予測 (2025年~2030年)
ペプチド合成市場レポートは、手法(固相、液相など)、製品タイプ(機器、試薬・消耗品、サービス)、エンドユーザー(製薬・バイオテクノロジー企業、ペプチドCDMO・CRO、学術・研究機関など)、および地域(北米、欧州、アジア太平洋、中東・アフリカ、南米)別に分類されています。市場予測は、金額(米ドル)で提供されます。

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
ペプチド合成市場の概要
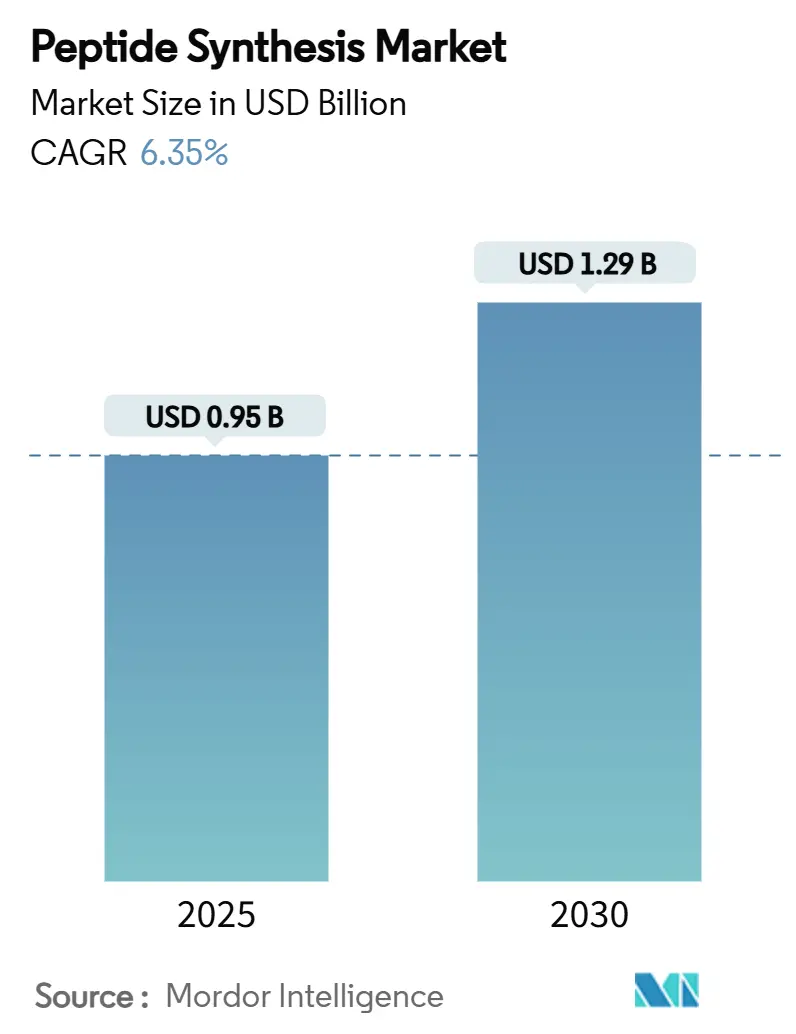
ペプチド合成市場は、2025年には0.95億米ドルに達し、2030年までに1.29億米ドルに成長すると予測されており、予測期間中の年平均成長率(CAGR)は6.35%です。この成長は、ペプチドベースの医薬品に対する強い需要、その優れた標的特異性、および低分子薬と比較して全身毒性が低いことに主に牽引されています。特に、マイクロ波支援固相ペプチド合成法(SPPS)の進歩により、反応時間が大幅に短縮され、粗生成物の純度が90%以上に向上し、製造効率が飛躍的に向上しています。
契約開発製造機関(CDMO)は、代謝性疾患や腫瘍性疾患向けペプチドの需要急増に対応するため、GLP-1生産能力の拡大に多額の投資を行っています。規制当局もイノベーションを促進しており、米国FDAは2024年に4つの新規ペプチド治療薬を承認し、複雑なペプチドに対する迅速承認経路を維持しています。
主要な市場動向
* 技術別: 固相合成法が2024年に72.34%の収益シェアを占め、市場をリードしています。一方、セルフリーおよび酵素合成法は、2030年までに8.54%のCAGRで最も急速に成長すると予測されています。
* 製品タイプ別: 試薬および消耗品が2024年の市場規模の48.34%を占めました。サービス部門は、2030年までに8.76%のCAGRで拡大すると予測されています。
* エンドユーザー別: 製薬およびバイオテクノロジー企業が2024年の市場規模の54.16%を占めました。CDMOおよびCROは、2030年までに9.54%のCAGRで成長しています。
* 地域別: 北米が2024年にペプチド合成市場規模の40.56%を占め、最大の市場となっています。アジア太平洋地域は、2030年までに7.65%のCAGRで最も急速に成長すると予測されています。
市場の推進要因と抑制要因
推進要因:
1. ペプチドベース治療薬の受容拡大(CAGRに+2.1%寄与): 2024年までに世界中で110以上のペプチド医薬品が承認され、その臨床的価値が確立されています。米国FDAは2024年にイメテルスタットやオレザルセンを含む4つの新規ペプチド薬を承認し、GLP-1受容体作動薬の成功はCDMOの生産能力増強を促しています。腫瘍分野でも、ペプチド薬物複合体(PDC)が標的放射性医薬品として注目されています。迅速承認制度やEMAのガイダンスがR&Dを刺激しています。
2. 標的治療を必要とする慢性疾患の有病率増加(CAGRに+1.8%寄与): 代謝性疾患、がん、神経変性疾患の増加が、ペプチドが優位性を持つ精密医療薬の需要を高めています。世界のペプチド治療薬市場は2021年の333億米ドルから2024年には393億米ドルに増加し、2030年には687億米ドルに達すると予測されています。150以上の治験段階のペプチドが「ドラッグ不可能」とされてきたタンパク質を標的としており、環状化やPEG化などの化学技術が半減期延長や週1回投与を可能にしています。高齢化社会も低毒性プロファイルのペプチドの需要を増幅させています。
3. 固相および自動合成技術の進歩(CAGRに+1.5%寄与): マイクロ波支援SPPSは、カップリングサイクルを数時間から数分に短縮し、粗生成物の純度を90%以上に高め、リードタイムを数日に圧縮しています。CEMのLiberty PRIMEプラットフォームやGenScriptのPepPowerシステムのような自動化技術は、高い配列忠実度と迅速な合成を可能にしています。機械学習アルゴリズムによる凝集ホットスポットのリアルタイム予測も、合成失敗と廃棄物を削減しています。これらの進歩は、cGMP下でのキログラムスケールバッチ生産を可能にし、スケーラビリティを向上させています。
4. 受託開発製造サービス(CDMO)の拡大(CAGRに+1.3%寄与): PolyPeptide Groupの収益成長やCordenPharmaのGLP-1生産能力増強に見られるように、アウトソーシング需要が急増しています。アジア太平洋地域のCDMOは、キログラムスケールの生産能力を持つ上海のBioDuroや韓国のSK pharmtecoへの投資など、最も急速に拡大しています。中国のサプライヤーは、米国や欧州の企業よりも多くのペプチド原薬マスターファイル(DMF)をFDAに提出しており、品質システムの成熟を示しています。エンドツーエンドのサービス提供は、スポンサーのタイムラインと設備投資を削減しています。
5. ライフサイエンス分野における政府および民間資金の増加(CAGRに+1.0%寄与): 北米、欧州、アジア太平洋の一部のイノベーションクラスターで、ライフサイエンス研究への資金提供が増加しています。
6. ペプチドの迅速承認に対する規制支援(CAGRに+0.9%寄与): 米国、欧州連合、日本におけるペプチドの迅速承認経路が、市場成長を後押ししています。
抑制要因:
1. 高い生産コストとスケーラビリティの課題(CAGRに-1.2%影響): SPPSは、ペプチド1キログラムあたり約13,000kgの廃棄物を生成し、低分子APIの168-308kgと比較して、溶剤処理費用と環境負荷を増大させます。特殊なアミノ酸やカップリング試薬が高価であり、原材料がコストの60-70%を占めます。精製プロセスは全体の生産時間を3倍にすることもあり、30アミノ酸を超えるペプチドでは不完全なカップリングや欠失配列が増加し、スケールアップが困難になります。
2. 厳格な規制および品質要件(CAGRに-0.8%影響): FDAは合成ペプチドに対する免疫原性リスク評価と詳細な不純物プロファイリングを義務付けており、分析負担を増大させています。EMAのガイドラインは、プロセス関連不純物の完全な開示を要求し、製造業者に洗浄および交差汚染管理の検証を求めています。BPC-157のような安全性が不確かなペプチド化合物に対する規制強化も、監視の強化を示しています。
3. 特殊な原材料の入手可能性の制限(CAGRに-0.7%影響): 特殊なアミノ酸や試薬の供給が不安定であり、特にサプライチェーンが未熟な地域では問題が顕著です。
4. 低分子およびバイオ医薬品との競合(CAGRに-0.6%影響): 特定の治療領域において、低分子薬やバイオ医薬品との競合が存在します。
セグメント分析
* 技術別:マイクロ波イノベーションが合成の進化を牽引
* 固相合成法(SPPS)は、成熟したプロセス化学と広範な試薬の入手可能性により、2024年に72.34%の市場シェアを維持しました。マイクロ波反応器の導入により、カップリング効率が向上し、溶剤使用量が削減され、2030年までに5.8%のCAGRで成長すると予測されています。自動化されたSPPSラインは、最大200残基の配列で95%の段階的収率を達成し、cGMP下でのキログラムスケールバッチ生産を可能にしています。
* セルフリーおよび酵素合成法は、グリーンケミストリーの要請が高まるにつれて、8.54%のCAGRで最も急速に成長している技術です。発酵プロセスを回避することでリードタイムを30%短縮し、水消費量を70%削減するセルフリープラットフォームが開発されています。酵素的ライゲーションは、周囲条件下でほぼ完璧な立体選択性を提供し、副生成物を減らし、下流の精製を容易にします。ハイブリッド化学酵素経路は、経口バイオアベイラビリティが改善された安定なラッソペプチドを生産し、新規足場に対する製薬企業の関心を刺激しています。
* 製品タイプ別:サービス部門がアウトソーシングトレンドを活用
* 試薬および消耗品は、保護アミノ酸、樹脂、カップリング剤に対する継続的な需要を反映し、2024年にペプチド合成市場の48.34%を占めました。非天然アミノ酸は、マクロ環状ペプチドやステープルペプチドに不可欠であり、標準残基の最大5倍のプレミアム価格で取引されています。
* サービスは、バイオ医薬品企業が複雑な化学、分析検証、GMP文書作成を外部委託する傾向にあるため、8.76%のCAGRで最も急速な成長を記録しました。カスタムペプチド合成は、ミリグラムの研究量からマルチキログラムの商業用APIまでを網羅し、従来のサービス階層を曖昧にしています。CordenPharmaのGLP-1生産能力増強は、このサブセグメントを支える設備投資と強力な先行受注を示しています。PEG化、糖鎖修飾、脂質化などの翻訳後修飾サービスは、修飾ペプチドがより良い半減期と組織浸透性を確保するため、年間10%で拡大しています。
* エンドユーザー別:CDMOが成長の触媒として台頭
* 製薬およびバイオテクノロジー企業は、前臨床スクリーニング、臨床試験、商業用API向けにペプチドを購入し、2024年の需要の54.16%を占めました。R&D支出は2025年にセグメント収益の平均17%を占め、マクロ環状ペプチドや放射性標識ペプチドが最大の予算を占めています。
* CDMOおよびCROは、スポンサーによる資産軽量化ビジネスモデルへの戦略的転換を反映し、9.54%のCAGRでより速く成長しています。PolyPeptide Groupが2028年までに2023年収益を倍増させるという目標は、専門化された能力が大規模な長期契約を獲得する方法を示しています。アジアのプロバイダーは、最大30%のコスト削減と迅速な技術移転タイムラインを提供することで、シェアを拡大しています。
地域分析
* 北米は、米国の強固な製薬エコシステムと、複雑なバイオ医薬品の迅速審査を支持する規制姿勢に支えられ、2024年にペプチド合成市場の40.56%を占めました。2025年には2000億米ドル以上の医薬品R&D支出がこの地域に流れ込み、そのうちの多くがペプチドモダリティに充てられています。CordenPharmaのコロラド州でのアップグレードやMerckのCyprumedとの経口ペプチドライセンス契約などの能力拡大は、製剤イノベーションへの戦略的投資を浮き彫りにしています。
* アジア太平洋は、コスト競争力のあるCDMO、拡大する人材プール、支援的な産業政策を背景に、2030年までに7.65%のCAGRを記録し、最も急速に成長している地域です。中国のペプチドCDMOシェアは、BioDuroやAsymchemなどの企業がキログラム規模の生産能力を拡大し、FDAのDMF提出数を増やしているため、2020年の5%から2025年には9%に上昇すると予測されています。韓国は、2026年に開設予定のSK pharmtecoの新施設に2.6億米ドルを投じ、GLP-1および腫瘍治療薬の生産能力を増強しています。
* 欧州は、スイス、ドイツ、英国を中心に堅調な生産量を維持しており、EMAの詳細なペプチドガイダンスが品質要件を調和させている恩恵を受けています。スイスだけでも2024年に27億スイスフランのバイオテクノロジー投資を誘致し、BachemとCordenPharmaがバーゼル近郊で大規模な新規プロジェクトを発表しています。EUのグリーンディール政策は、酵素合成と溶剤回収技術の採用を加速させ、低排出設備アップグレードへの助成金を提供しています。
競争環境
ペプチド合成市場は中程度の統合度であり、上位5社が世界の収益の推定55-60%を占めています。Bachem、PolyPeptide Group、CordenPharmaは、長年のプロセスノウハウ、大規模な反応器設備、およびグローバルな品質認証を活用して、高利益のカスタム製造契約を獲得しています。彼らの競争優位性は、探索ライブラリ、プロセス開発、GMP生産、充填・仕上げをカバーするエンドツーエンドのサービスバンドルにあります。アジアの中堅企業は、高スループット精製ラインやリアルタイムリリース分析に投資することで、バリューチェーンを上昇させています。
能力拡大が主要な戦略テーマです。CordenPharmaは9億ユーロを投じてスイスと米国に2つのペプチドメガプラントを建設し、GLP-1アナログの年間生産能力を約2トン増強しています。PolyPeptideは、複数の拠点でボトルネック解消プログラムを実施し、精製生産量を増やし、廃棄物を15%削減するNADESベースのグリーン溶剤を導入しています。
技術差別化も引き続き重要です。主要企業は、AIを活用した経路探索により原材料コストの変動を抑制し、合成装置の予測保守により稼働時間を95%以上に高めています。短鎖ペプチド向けのフローケミストリーや長鎖ペプチド向けの酵素媒介ライゲーションの採用は、新たな機会を創出しています。持続可能な製造(クローズドループ溶剤回収、リサイクル可能な樹脂、再生可能エネルギー調達)は、コンプライアンスの必要性から商業的差別化要因へと進化し、環境重視のスポンサー契約を獲得しています。
主要企業
* Merck KGaA
* Thermo Fisher Scientific Inc.
* GenScript
* Novozymes A/S
* Bachem Holding AG
最近の業界動向
* 2025年3月: CordenPharmaは、スイスのバーゼル近郊で5億ユーロ(5.824億米ドル)規模のペプチド開発・製造施設の建設を開始しました。2028年までに商業運転を開始し、300人の雇用を創出する予定です。
* 2025年1月: BioDuroは、上海の張江ハイテクパークにキログラムスケールのSPPS能力と自動合成装置を備えたペプチド合成プラントを開設しました。
* 2024年5月: NovartisとPeptiDreamは、放射性リガンド用途のマクロ環状ペプチドを特定するため、最大27.1億米ドルのペプチド探索共同研究を拡大しました。
* 2024年4月: Merckは、Cyprumedと経口ペプチド送達技術に関する4.93億米ドルのライセンス契約を締結し、複数の標的を対象とした独占オプションを含んでいます。
* 2024年10月: SK pharmtecoは、韓国の世宗市にペプチドおよび低分子API施設を建設するため、2.6億米ドルを投じました。2026年後半に稼働開始予定で、300人の新規雇用を創出します。
* 2024年5月: Donaldson CompanyとPolyPeptide Groupは、ペプチド精製用の生産規模の溶剤回収システムを設計する共同プログラムを立ち上げ、溶剤使用量を40%削減することを目指しています。
このレポートは、世界のペプチド合成市場に関する詳細な分析を提供しています。ペプチドは、低分子医薬品とタンパク質の中間に位置する、高い活性と特異性を持つ医薬品化合物であり、合成の容易さ、入手可能性、低毒性といった利点から、医薬品、栄養補助食品、化粧品産業など幅広い分野での応用が拡大しています。これにより、ペプチド合成技術の迅速な進歩に対する高い需要が生じています。
市場規模は、2025年に0.95億米ドルと評価されており、2030年までには1.29億米ドルに達すると予測されています。
市場の主要な推進要因としては、ペプチドベース治療薬の受容拡大、標的療法を必要とする慢性疾患の有病率増加、固相合成および自動合成技術の進歩が挙げられます。また、医薬品受託開発製造サービス(CDMO)の拡大、ライフサイエンス研究における政府および民間資金の増加、新規ペプチドの迅速承認を支援する規制環境も市場成長を後押ししています。
一方で、市場の阻害要因としては、高い生産コストとスケールアップの課題、厳格な規制および品質要件、特殊な原材料の入手可能性の制限、低分子医薬品やバイオ医薬品といった代替モダリティとの競合が存在します。
主要なトレンドとして、バイオ医薬品企業がアセットライトモデルを志向する傾向が強まっており、複雑で資本集約的なペプチド生産を、エンドツーエンドのGMP準拠サービスを提供するCDMOに外部委託する動きが加速しています。これにより、CDMOはインハウス製造よりも急速に成長しています。
地域別では、アジア太平洋地域が最も急速な成長を遂げると予測されており、2030年まで年平均成長率7.65%で拡大する見込みです。これは、中国と韓国における生産能力の増強とコスト競争力のあるサービスが主な要因です。
大規模なペプチド製造における最大の課題は、高いプロセス質量強度と厳格な不純物管理による高コストであり、より環境に優しく効率的な技術の採用が喫緊の課題となっています。
市場は以下の主要なセグメントに分類され、詳細な分析が行われています。
技術別:
固相合成(手動SPPS、自動SPPS、マイクロ波アシストSPPS)、液相合成(バッチLPPS、連続フローLPPS)、ハイブリッド・組換え合成、無細胞・酵素的合成が含まれます。特に固相合成は、長年のプロセス最適化と試薬の広範な利用可能性により、2024年には市場シェアの72.34%を占める主要な技術となっています。
製品タイプ別:
装置(ペプチド合成装置、切断・脱保護システム、精製(Prep-HPLC)、凍結乾燥機)、試薬・消耗品(アミノ酸ビルディングブロック、レジン、カップリング試薬・活性化剤、溶媒、酵素、その他の試薬・消耗品)、サービス(カスタム/カタログペプチド合成、GMPペプチド製造、ペプチドライブラリ設計、翻訳後修飾サービス)に分けられます。
エンドユーザー別:
製薬・バイオテクノロジー企業、ペプチドCDMO・CRO、学術・研究機関、診断ラボ、食品・栄養補助食品メーカー、化粧品メーカーが対象となります。
地域別:
北米(米国、カナダ、メキシコ)、欧州(ドイツ、英国、フランス、イタリア、スペイン、その他欧州)、アジア太平洋(中国、日本、インド、オーストラリア、韓国、その他アジア太平洋)、中東・アフリカ(GCC、南アフリカ、その他中東・アフリカ)、南米(ブラジル、アルゼンチン、その他南米)の主要21カ国における市場規模と予測が提供されています。
競争環境については、市場集中度、市場シェア分析、およびAAPPTec、Bachem Holding AG、Thermo Fisher Scientific Inc.、GenScript、Merck KGaA (Sigma-Aldrich)、Polypeptide Group、Lonzaなど多数の主要企業のプロファイルが詳細に分析されています。これらの企業プロファイルには、グローバルおよび市場レベルの概要、主要事業セグメント、財務情報、従業員数、市場ランク、市場シェア、製品とサービス、最近の動向の分析が含まれています。
最後に、レポートは市場の機会と将来の展望、特に未開拓領域と満たされていないニーズの評価についても言及しています。

1. はじめに
- 1.1 調査の前提と市場の定義
- 1.2 調査範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場概況
- 4.1 市場概要
-
4.2 市場の推進要因
- 4.2.1 ペプチドベース治療薬の受容の増加
- 4.2.2 標的療法を必要とする慢性疾患の有病率の増加
- 4.2.3 固相合成および自動合成技術の進歩
- 4.2.4 医薬品受託開発製造サービスの拡大
- 4.2.5 ライフサイエンス研究における政府および民間資金の増加
- 4.2.6 新規ペプチドの迅速承認に対する規制支援
-
4.3 市場の阻害要因
- 4.3.1 高い生産コストとスケーラビリティの課題
- 4.3.2 厳格な規制および品質要件
- 4.3.3 特殊な原材料の入手可能性の制限
- 4.3.4 低分子医薬品やバイオ医薬品などの代替モダリティとの競合
- 4.4 規制環境
-
4.5 ポーターの5つの力分析
- 4.5.1 新規参入者の脅威
- 4.5.2 買い手の交渉力
- 4.5.3 供給者の交渉力
- 4.5.4 代替品の脅威
- 4.5.5 競争の激しさ
5. 市場規模と成長予測(金額、米ドル)
-
5.1 手法別
- 5.1.1 固相法
- 5.1.1.1 手動SPPS
- 5.1.1.2 自動SPPS
- 5.1.1.3 マイクロ波アシストSPPS
- 5.1.2 液相法
- 5.1.2.1 バッチLPPS
- 5.1.2.2 連続フローLPPS
- 5.1.3 ハイブリッド & 組換え
- 5.1.4 無細胞 / 酵素的
-
5.2 製品タイプ別
- 5.2.1 装置
- 5.2.1.1 ペプチド合成装置
- 5.2.1.2 切断 & 脱保護システム
- 5.2.1.3 精製 (分取HPLC)
- 5.2.1.4 凍結乾燥機
- 5.2.2 試薬 & 消耗品
- 5.2.2.1 アミノ酸ビルディングブロック
- 5.2.2.2 樹脂
- 5.2.2.3 カップリング試薬 & 活性化剤
- 5.2.2.4 溶媒
- 5.2.2.5 酵素
- 5.2.2.6 その他の試薬 & 消耗品
- 5.2.3 サービス
- 5.2.3.1 受託 / カタログペプチド合成
- 5.2.3.2 GMPペプチド製造
- 5.2.3.3 ペプチドライブラリー設計
- 5.2.3.4 翻訳後修飾サービス
-
5.3 エンドユーザー別
- 5.3.1 製薬 & バイオテクノロジー企業
- 5.3.2 ペプチドCDMO & CRO
- 5.3.3 学術 & 研究機関
- 5.3.4 診断ラボ
- 5.3.5 食品 & 栄養補助食品メーカー
- 5.3.6 化粧品メーカー
-
5.4 地域別
- 5.4.1 北米
- 5.4.1.1 米国
- 5.4.1.2 カナダ
- 5.4.1.3 メキシコ
- 5.4.2 欧州
- 5.4.2.1 ドイツ
- 5.4.2.2 英国
- 5.4.2.3 フランス
- 5.4.2.4 イタリア
- 5.4.2.5 スペイン
- 5.4.2.6 その他の欧州
- 5.4.3 アジア太平洋
- 5.4.3.1 中国
- 5.4.3.2 日本
- 5.4.3.3 インド
- 5.4.3.4 オーストラリア
- 5.4.3.5 韓国
- 5.4.3.6 その他のアジア太平洋
- 5.4.4 中東 & アフリカ
- 5.4.4.1 GCC
- 5.4.4.2 南アフリカ
- 5.4.4.3 その他の中東 & アフリカ
- 5.4.5 南米
- 5.4.5.1 ブラジル
- 5.4.5.2 アルゼンチン
- 5.4.5.3 その他の南米
6. 競合情勢
- 6.1 市場集中度
- 6.2 市場シェア分析
-
6.3 企業プロファイル(グローバル概要、市場概要、主要事業セグメント、財務、従業員数、主要情報、市場順位、市場シェア、製品とサービス、および最近の動向の分析を含む)
- 6.3.1 AAPPTec
- 6.3.2 AnaSpec
- 6.3.3 Bachem Holding AG
- 6.3.4 CEM Corporation
- 6.3.5 CSBio
- 6.3.6 Biosynth (Vivitide)
- 6.3.7 Thermo Fisher Scientific Inc.
- 6.3.8 GenScript
- 6.3.9 JPT Peptide Technologies
- 6.3.10 ProteoGenix
- 6.3.11 Novozymes A/S (Novonesis)
- 6.3.12 Polypeptide Group
- 6.3.13 Merck KGaA (Sigma-Aldrich)
- 6.3.14 AmbioPharm
- 6.3.15 Peptide 2.0
- 6.3.16 Lonza
- 6.3.17 Almac Sciences
- 6.3.18 Pepscan
- 6.3.19 Bionova Scientific
- 6.3.20 IRIS Biotech
- 6.3.21 Senn Chemicals
7. 市場機会と将来展望
*** 本調査レポートに関するお問い合わせ ***

ペプチド合成は、アミノ酸を特定の順序で結合させ、人工的にペプチドを製造する技術です。ペプチドとは、アミノ酸がアミド結合(ペプチド結合)によって数個から数十個、あるいはそれ以上連なった生体分子であり、タンパク質の一部を構成したり、ホルモンや神経伝達物質として生体内で重要な役割を果たしたりしています。天然には存在しない配列や、特定の修飾が施されたペプチドを合成することで、医薬品開発、診断薬、基礎研究、さらには化粧品や食品といった幅広い分野でその応用が期待されています。この技術は、生命科学の進展に不可欠な基盤技術の一つとして、日々進化を続けています。
ペプチド合成にはいくつかの主要な方法があります。最も広く用いられているのは「固相合成法(Solid-Phase Peptide Synthesis, SPPS)」です。これは、1960年代にロバート・メリフィールドによって開発された画期的な手法で、最初のアミノ酸を不溶性の樹脂に結合させ、その後、保護基の脱保護と次のアミノ酸の結合というサイクルを繰り返すことで、ペプチド鎖を段階的に伸長させていきます。この方法の最大の利点は、反応ごとに生成物を精製する必要がなく、最終的に樹脂からペプチドを切り出すだけで目的のペプチドが得られるため、操作が簡便で自動化に適している点です。固相合成法には、主にFmoc(9-フルオレニルメトキシカルボニル)法とBoc(t-ブトキシカルボニル)法がありますが、温和な条件で脱保護が可能で、副反応が少ないFmoc法が現在の主流となっています。しかし、長鎖ペプチドの合成では、反応効率の低下や副生成物の増加、ラセミ化といった課題も存在します。
これに対し、「液相合成法(Liquid-Phase Peptide Synthesis, LPPS)」は、反応を溶液中で行い、各ステップで中間体を精製しながらペプチド鎖を伸長させる方法です。この方法は、固相合成法に比べて操作が複雑で自動化が難しいという欠点がありますが、中間体の構造確認が容易であり、特に大量合成や、固相合成では困難な特定の構造を持つペプチドの合成に適しています。
また、固相合成法と液相合成法の利点を組み合わせた「ハイブリッド法」も開発されています。代表的なものに「セグメントカップリング」や「化学ライゲーション(Chemical Ligation)」があります。これらは、比較的短いペプチド断片を固相または液相で合成し、それらを溶液中で結合させることで、長鎖や複雑な構造を持つペプチド、さらにはタンパク質を効率的に合成する手法です。特に「ネイティブケミカルライゲーション(Native Chemical Ligation, NCL)」は、天然のペプチド結合を形成しながら、長鎖ペプチドやタンパク質を合成できる強力なツールとして注目されています。
さらに、プロテアーゼなどの酵素を利用してペプチド結合を形成する「酵素法」も研究されています。この方法は、温和な条件下で反応が進行し、ラセミ化が少ないという利点がありますが、基質特異性や収率の面で課題があり、実用化にはさらなる研究が必要です。
ペプチド合成の用途は多岐にわたります。最も重要な応用分野の一つは「医薬品開発」です。ペプチドは、その高い特異性と低い毒性から、次世代医薬品の候補として注目されています。例えば、糖尿病治療薬であるGLP-1アナログ、がん治療薬、抗ウイルス薬、免疫抑制剤など、多くのペプチド医薬品が既に市場に投入されており、さらに多くの候補が臨床開発段階にあります。また、リード化合物の探索や最適化、ワクチン開発においても合成ペプチドは重要な役割を担っています。
「診断薬」分野では、特定の疾患マーカーに対する抗体産生や、抗原検出のためのプローブとして合成ペプチドが利用されています。これにより、疾患の早期発見や病態のモニタリングが可能になります。
「基礎研究」においては、タンパク質の機能解析、シグナル伝達経路の解明、酵素の活性部位の研究、構造生物学におけるモデルペプチドの提供など、生命現象の理解を深める上で不可欠なツールとなっています。特定の配列を持つペプチドを合成し、その生物学的活性を評価することで、生命のメカニズムを解き明かすことができます。
その他、「化粧品」分野では、抗酸化作用、保湿効果、コラーゲン産生促進作用などを持つ機能性ペプチドがアンチエイジング製品に配合されています。「食品」分野でも、血圧降下作用や免疫賦活作用を持つ機能性ペプチドが特定保健用食品などに利用されています。
ペプチド合成を支える「関連技術」も多岐にわたります。合成効率と純度を決定づける重要な要素として、「アミノ酸保護基」や「カップリング試薬」の開発が挙げられます。FmocやBocといった保護基、HBTUやHATUなどの高性能なカップリング試薬の登場が、固相合成法の発展を大きく加速させました。合成されたペプチドの品質を保証するためには、「ペプチドシーケンサー」による配列確認、「質量分析法(MS)」による分子量や修飾の確認、「高速液体クロマトグラフィー(HPLC)」による精製および純度分析が不可欠です。また、合成プロセスを効率化し、ハイスループット化を実現する「自動合成装置」の進化も、ペプチド合成技術の普及に大きく貢献しています。
「市場背景」を見ると、ペプチド合成市場は、ペプチド医薬品の需要増加とバイオ医薬品市場全体の拡大を背景に、堅調な成長を続けています。特に、糖尿病、がん、自己免疫疾患といった慢性疾患の治療薬としてのペプチド医薬品の成功が、市場を牽引しています。この市場では、ペプチドの受託合成・製造を行う「受託製造開発機関(CDMO/CMO)」の役割が非常に大きくなっています。これらの企業は、研究開発段階から商業生産まで、高品質なペプチドを安定的に供給することで、製薬企業の開発を支援しています。一方で、長鎖ペプチドや複雑な修飾を持つペプチドの合成における効率とコスト、品質管理、そして厳格な規制要件への対応は、依然として大きな課題です。また、主要なペプチド医薬品の特許切れに伴い、後発ペプチド医薬品(バイオシミラー)の開発競争も激化しています。
「将来展望」として、ペプチド合成技術はさらなる進化が期待されています。合成技術の面では、長鎖ペプチドや複雑な構造を持つペプチドを、より高効率かつ低コストで合成するための新しい保護基、カップリング試薬、合成戦略の開発が進むでしょう。D-アミノ酸や非天然アミノ酸、多様な修飾が施されたペプチドの合成技術も向上し、機能性ペプチドの設計自由度がさらに高まります。また、AIや機械学習を活用した合成経路の最適化、自動化技術のさらなる発展により、研究開発のスピードが加速すると考えられます。
応用分野では、経口投与可能なペプチド医薬品や、特定の細胞や組織に選択的に作用する標的指向型ペプチド医薬品の開発が加速するでしょう。個別化医療の進展に伴い、患者個々の特性に合わせたペプチドワクチンや診断薬の開発も進むと予想されます。さらに、ペプチドを足場とした新規マテリアルの開発や、ナノテクノロジーとの融合による革新的な応用も期待されています。環境負荷の低いグリーンケミストリーの観点から、より持続可能な合成法の開発も重要なテーマとなるでしょう。ペプチド合成は、今後も生命科学と医療のフロンティアを切り拓く上で、中心的な役割を担い続けることでしょう。