医薬品受託開発製造機関(CDMO)市場規模と展望、2025年~2033年

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
## 医薬品受託開発製造機関(CDMO)市場に関する詳細分析レポート
### 市場概要
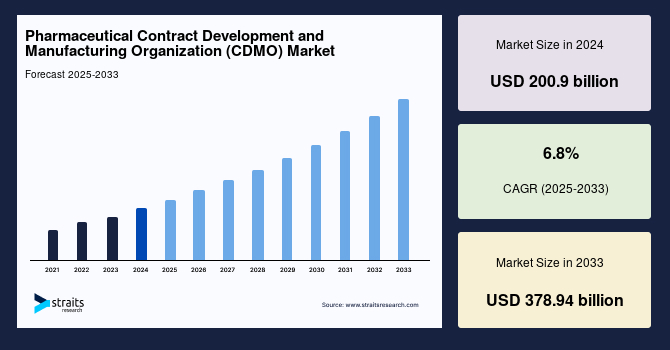
世界の医薬品受託開発製造機関(CDMO)市場は、2024年に2,009億米ドルの規模に達しました。この市場は、2025年には2,146億9,000万米ドル、そして2033年までには3,789億4,000万米ドルに達すると予測されており、予測期間(2025年~2033年)における年平均成長率(CAGR)は6.9%と堅調な成長が見込まれています。
この市場の成長は、主に先進的な製造技術とプロセスの導入、医薬品開発の複雑化、そして費用対効果の高いソリューションへの高まる需要によって牽引されています。特に、CDMOは連続生産のような運用戦略を採用することで製造効率を向上させ、廃棄物を最小限に抑え、コスト削減を実現することが期待されています。これは、新規医薬品承認の割合が増加しているにもかかわらず、自社製造能力を持たない中小規模の製薬企業にとって特に重要であり、これらの企業が新たな技術の導入をCDMOに促す要因となっています。
医薬品開発の複雑化は、CDMO市場の拡大をさらに加速させています。世界保健機関(WHO)の2022年の調査によると、新薬開発にかかる費用は4,340万米ドルから42億米ドルに及ぶと推定されています。CDMOにアウトソーシングすることで、製薬企業は高額な初期投資や間接費を負担することなく、専門的な専門知識と高度な製造能力にアクセスできます。このアプローチにより、企業は中核事業に集中し、財務リスクを低減し、運用上の柔軟性を高めることが可能となり、今後数年間のCDMO市場の成長をさらに促進するでしょう。
希少疾患治療を目的としたバイオ医薬品の需要増加も、医薬品CDMO市場における重要なトレンドです。特に、エクソソームベースの治療法のような専門的な製造能力への関心が高まっています。製薬企業がこれらの革新的な治療法を開発する際、処方開発や製造といった不可欠なサービスをCDMOに委託しています。このCDMOへの依存は、製薬企業が研究開発プロセスを合理化し、生産性を向上させ、医薬品開発のタイムラインを加速させると同時に、コスト削減とリスク軽減を実現する上で不可欠です。
さらに、製薬業界では持続可能性への関心が高まっており、CDMOもこの動きに追随しています。CDMOは環境への影響を最小限に抑えるため、グリーンケミストリーの実践や持続可能な製造プロセスを導入しています。この持続可能性へのシフトは、環境目標を支持し、運用効率を高め、環境に配慮した医薬品開発・製造ソリューションへの高まる需要と合致しており、市場の成長を後押しする重要な要素となっています。
### 成長要因
医薬品受託開発製造機関(CDMO)市場の成長を牽引する主要な要因は多岐にわたり、製薬業界の進化するニーズと課題に深く根差しています。
1. **先進的な製造技術とプロセスの採用:**
CDMOは、製造効率の向上とコスト削減を目指し、連続生産(Continuous Manufacturing)のような先進的な運用戦略を積極的に導入しています。連続生産は、バッチ生産と比較して生産サイクルを短縮し、廃棄物を削減し、品質管理を強化できるという利点があります。これにより、CDMOは顧客である製薬企業に対して、より迅速かつ費用対効果の高い製造ソリューションを提供できるようになり、市場競争力を高めています。特に、中小規模の製薬企業は自社でこれらの高価な技術を導入することが困難であるため、CDMOの先進技術への依存度が高まっています。
2. **中小製薬企業の台頭と製造能力の不足:**
近年、新規医薬品承認において中小規模の製薬企業が占める割合が増加しています。これらの企業は革新的な創薬に注力する一方で、多くの場合、大規模な製造施設や複雑な製造プロセスを管理する能力を欠いています。そのため、医薬品開発の初期段階から商業生産に至るまで、CDMOの専門知識と製造インフラに大きく依存しています。CDMOは、これらの企業が必要とするスケーラブルな製造ソリューションと規制対応能力を提供することで、新薬の市場投入を加速させる重要なパートナーとなっています。
3. **医薬品開発の複雑化と費用対効果の高いソリューションへの需要:**
新薬開発は、分子構造の複雑化、標的治療の多様化、個別化医療の進展により、ますます複雑になっています。また、前述の通り、開発コストは非常に高額であり、製薬企業にとって大きな負担となっています。CDMOは、特定の治療領域における専門知識、高度な分析技術、および最新の製造設備を提供することで、製薬企業がこれらの複雑な課題を克服し、開発リスクとコストを削減するのを支援します。これにより、製薬企業は中核的な研究開発活動に集中し、CDMOは製造と開発の専門性を活かすという効率的な分業体制が確立されています。
4. **希少疾患治療薬としてのバイオ医薬品需要の増加:**
バイオ医薬品、特に希少疾患や難治性疾患を対象とした治療薬の開発が活発化しています。これらの薬剤は、細胞・遺伝子治療、エクソソームベースの治療法など、高度に専門化された製造プロセスを必要とします。CDMOは、これらの特殊なモダリティに対応するための専門的な施設、技術、および規制に関する深い知識を有しており、製薬企業がこれらの革新的な治療法を迅速かつ効率的に開発・製造できるよう支援しています。これにより、製薬企業は研究開発プロセスを合理化し、生産性を向上させ、市場投入までの時間を短縮することが可能になります。
5. **持続可能な慣行への移行:**
環境意識の高まりと規制強化に伴い、製薬業界全体で持続可能性への取り組みが加速しています。CDMOは、グリーンケミストリーの原則に基づいた製造プロセスの導入、エネルギー効率の改善、廃棄物削減、水資源の管理など、環境負荷の低い製造ソリューションを提供することで、このトレンドに対応しています。これにより、CDMOは環境目標を達成するだけでなく、顧客企業からの環境に配慮した製造への要求に応え、企業の社会的責任(CSR)を果たす上でも重要な役割を担っています。
6. **医薬品開発プロセスと規制要件の複雑化:**
世界各地で異なる規制要件、データ提出の複雑さ、および品質基準の厳格化は、製薬企業にとって大きな課題です。CDMOは、これらの複雑な規制環境をナビゲートするための専門知識と経験を有しており、医薬品開発の各段階(前臨床、臨床試験、商業生産)における規制遵守を保証します。これにより、製薬企業は規制当局からの承認プロセスを円滑に進め、リスクを低減し、市場投入までの時間を短縮することができます。CDMOは、最先端の技術と厳格な品質管理システムを組み合わせることで、製薬企業が新たな治療法を市場に投入する際の効率性を高める不可欠な存在となっています。
7. **臨床試験数の増加:**
世界的に新薬開発のための臨床試験数が増加しており、特に複雑な疾患を対象とした薬剤においては、より多くの試験段階と被験者数が必要とされています。製薬企業は、臨床試験で使用される医薬品の製造や品質管理、さらには規制当局への提出資料の作成において、しばしばリソースや専門知識が不足しています。CDMOは、治験薬の製造、製剤開発、品質保証、および規制対応サービスといった専門的なサポートを提供することで、臨床試験の加速、コスト削減、およびリスク軽減に貢献しています。このCDMOへの依存は、市場成長に大きく寄与しています。
### 阻害要因
医薬品受託開発製造機関(CDMO)市場の成長を妨げるいくつかの重要な要因も存在します。
1. **規制遵守の失敗と品質管理の課題:**
医薬品業界において、規制基準の遵守と高品質な医薬品の製造は最も重要です。CDMOは、医薬品原薬や製剤を自社ブランドで製造することが多く、その品質が直接、顧客である製薬企業の評判と患者の安全性に影響を与えます。そのため、CDMOが規制要件を満たせず、品質問題を引き起こした場合、その事業とブランドの評判に深刻な影響を与える可能性があります。これには、製品のリコール、法的措置、顧客からの信頼喪失などが含まれます。
2. **複雑なデータ管理と多国間規制への対応:**
医薬品開発および臨床試験プロセスには、規制当局への広範なデータ提出が必要です。このデータの管理は、その量と複雑さから大きな課題を伴います。特に、異なる国々で多様な製剤の申請を行う場合、各国特有の規制要件、データ形式、および言語に対応する必要があり、このプロセスは極めて複雑です。これらの複雑さは、規制当局への提出書類におけるエラーのリスクを高め、承認プロセスを遅延させる可能性があります。CDMOは、世界中の規制要件に対応するための専門知識とシステムを維持する必要があり、これが運用コストの増加や、潜在的な事業リスクにつながる可能性があります。規制要件の不遵守は、CDMOの将来的な成長を阻害する主要な要因の一つとなると予測されています。
### 機会
医薬品受託開発製造機関(CDMO)市場には、将来の成長を促進するいくつかの重要な機会が存在します。
1. **プロセス自動化の統合:**
プロセス自動化の導入は、医薬品CDMOにとって生産効率と信頼性を飛躍的に向上させる変革的な機会を提供します。先進的なソフトウェア、センサー、プログラマブルロジックコントローラー(PLC)などを活用することで、CDMOは製造プロセスを合理化し、人的エラーを削減し、全体的な生産性を大幅に向上させることができます。これにより、製品品質の一貫性が確保されるだけでなく、運用コストの削減と市場投入までの期間短縮が実現され、CDMOはサプライチェーンにおいてより競争力のある存在となります。自動化は、特に複雑なバイオ医薬品の製造や、高い再現性が求められる無菌充填などのプロセスにおいて、その真価を発揮します。
2. **中小バイオテクノロジー企業の成長:**
中小規模のバイオテクノロジー企業は、革新的な医薬品候補の開発において重要な役割を担っていますが、多くの場合、自社で大規模な製造施設を構築・維持するリソースや専門知識を持っていません。これらの企業は、製品を臨床開発から商業生産へとスケールアップするために、外部の製造専門知識を必要とします。CDMOは、これらの企業に対して、柔軟かつスケーラブルな製造ソリューション、規制に関する深い知識、および高度な技術プラットフォームを提供することで、彼らの成長を支援する不可欠なパートナーとしての地位を確立しています。このセグメントからの需要の増加は、CDMO市場にとって大きな成長機会をもたらします。
### セグメント分析
医薬品受託開発製造機関(CDMO)市場は、サービスタイプ、研究フェーズ、およびエンドユーザーに基づいて細分化されています。
#### サービスタイプ別
市場は、医薬品開発サービス、医薬品製造サービス、バイオ医薬品製造サービス、包装・表示サービス、充填・仕上げサービス、その他に分類されます。
* **医薬品製造サービス**が、市場収益において最大のシェアを占めています。これは、医薬品原薬(API)や最終剤形(FDFs:錠剤、注射剤など)に対する継続的な高い需要によって牽引されています。また、複雑な製剤やスペシャリティ医薬品の台頭もこのセグメントの成長を後押ししており、費用対効果が高く効率的な製造ソリューションに対する業界のニーズを浮き彫りにしています。CDMOは、これらの多様な製造ニーズに対応するための専門的な設備と技術を提供し、製薬企業の製品供給を支えています。
* **医薬品開発サービス**には、前臨床から臨床開発初期段階における製剤開発、分析法開発などが含まれます。
* **バイオ医薬品製造サービス**は、抗体、ワクチン、細胞・遺伝子治療薬など、複雑な生物学的製剤の製造を専門としています。この分野は、バイオ医薬品の市場拡大に伴い、急速な成長が見込まれています。
* **包装・表示サービス**は、製品の安全性とトレーサビリティを確保するために不可欠であり、規制要件に準拠した多様な包装ソリューションを提供します。
* **充填・仕上げサービス**は、特に注射剤や無菌製剤において、最終製品の無菌性と品質を保証する上で極めて重要です。
#### 研究フェーズ別
市場は、前臨床、フェーズI、フェーズII、フェーズIII、フェーズIVに分類されます。
* **フェーズIII**が、世界の市場において最大の収益シェアを占めています。このフェーズは、医薬品の有効性と安全性を大規模に評価するために極めて重要であり、多くの場合、規制当局の承認を決定づける段階となります。フェーズIII試験には多大な投資と膨大なデータ要件が伴うため、製薬企業は臨床試験受託機関(CRO)を含むCDMOに大きく依存しています。これにより、フェーズIII試験は医薬品開発における主要な焦点となり、CDMOの重要なサービス提供領域となっています。
* **前臨床フェーズ**では、初期の安全性評価と薬物動態研究が行われます。
* **フェーズI**では、少数の健康な被験者または患者を対象に、安全性と薬物動態が評価されます。
* **フェーズII**では、限られた数の患者を対象に、有効性とさらなる安全性評価が行われます。
* **フェーズIV**は、市販後調査であり、長期的な安全性や新たな適応症の探索が行われます。
#### エンドユーザー別
市場は、大手製薬企業、中小製薬企業、ジェネリック製薬企業、その他に分類されます。
* **大手製薬企業**が、世界の市場において支配的なシェアを占めています。これらの企業は、複雑な医薬品開発プロセスや大量生産の課題に直面することが多く、専門的な専門知識とスケーラブルな製造ソリューションをCDMOに依存しています。CDMOとのパートナーシップは、大手製薬企業の業務を合理化し、コストを削減し、市場投入までの時間を短縮する上で不可欠であり、このセグメントにおけるCDMOの優位性を強化しています。
* **中小製薬企業**は、自社製造能力の不足を補うためにCDMOを利用します。
* **ジェネリック製薬企業**は、コスト効率の高い製造と迅速な市場投入を実現するためにCDMOのサービスを活用します。
### 地域分析
世界の医薬品受託開発製造機関(CDMO)市場は、地域によって異なる成長ダイナミクスを示しています。
#### 北米
北米は、世界の医薬品CDMO市場を支配しています。このリーダーシップは、主要な製薬およびバイオテクノロジーメーカーの存在、バイオ医薬品の研究開発に対する堅調な資金提供、および細胞・遺伝子治療に対する需要の増加によって牽引されています。特に米国では、医薬品の供給不足が深刻な懸念事項となっており、これはしばしば開発の遅延、製造中止、製造品質の問題に起因しています。CDMOは、これらの課題に対処し、安定した医薬品供給を確保するための重要なソリューションを提供しています。強力なイノベーションエコシステムと高度な技術インフラは、北米がCDMOサービスプロバイダーにとって魅力的な地域である理由です。
#### アジア太平洋地域
アジア太平洋地域は、医薬品CDMO市場において最も速い成長率を記録すると予測されています。この成長は、米国や他の先進国と比較して低い運営コスト、糖尿病や心臓病などの慢性疾患の罹患率上昇による新薬開発需要の増加に起因しています。慢性疾患の増加は、新たな治療法の必要性を高め、製薬企業が専門知識と効率性を求めてCDMOに研究開発および製造プロセスをアウトソーシングする動機付けとなっています。さらに、臨床試験の民営化が進み、中国やインドなどの新興国における研究アウトソーシングが増加しています。大手製薬企業は、臨床データ管理やファーマコビジランスなどのサービスをこれらの地域のCDMOに委託しており、これが地域の市場成長をさらに加速させています。政府の支援、熟練労働者の増加、およびインフラの改善も、アジア太平洋地域をCDMO投資にとって魅力的なハブにしています。
### 競争環境
医薬品受託開発製造機関(CDMO)市場は、医薬品生産および開発サービスのアウトソーシング需要の増加により、堅調な成長を遂げています。このセクションでは、確立された多国籍企業から新興企業まで、業界のダイナミックな状況に貢献する多様なプレーヤーに関する貴重な市場インサイトを提供します。
**WuXi Apptec:**
WuXi Apptecは、医薬品CDMO市場における主要な新興プレーヤーとして際立っています。2000年に設立され、上海に本社を置く同社は、サービス提供範囲とグローバル展開を急速に拡大しました。WuXi Apptecは、創薬、開発、製造を含む医薬品バリューチェーン全体にわたる包括的なサービススイートを提供しています。イノベーションと技術統合への強い重点は、急速に進化するバイオ医薬品業界において、同社を主要な競合他社としての地位に位置づけています。同社は、遺伝子・細胞治療、バイオ医薬品、低分子医薬品など、幅広いモダリティに対応する能力で知られています。
**Valo Health:**
Valo Healthは、最近の開発を通じて市場に影響を与えている企業の一つとして言及されています。詳細な情報は提供されていませんが、このような企業が市場に参入し、革新的なアプローチで競争環境を活性化させていることを示唆しています。
アナリストの見解によると、世界の医薬品CDMO業界は、製薬企業が業務を合理化し、創薬に注力するという高まる需要によって大きく進化してきました。連続生産やデジタル化といった主要なイノベーションは、効率性と品質管理を向上させています。また、持続可能性も優先事項となっており、CDMOは環境への影響を軽減するためにグリーンプラクティスをますます採用しています。さらに、中小規模のバイオテクノロジー企業の成長は新たな機会を提示しており、これらの企業は生産をスケールアップするために外部の製造専門知識を必要とすることが多いため、CDMOは医薬品業界における重要なパートナーとしての地位を確立しています。
市場は、確立された大手企業と、特定のニッチ市場や技術革新に焦点を当てる新興企業が共存する、活発な競争環境を呈しています。主要なプレーヤーは、M&Aを通じて能力を拡大したり、特定の治療領域や技術プラットフォームに特化したりすることで、市場シェアを拡大しようとしています。
Report Coverage & Structure
“`html
- 目次
- セグメンテーション
- 調査方法
- 無料サンプルを入手
- 目次
- エグゼクティブサマリー
- 調査範囲とセグメンテーション
- 調査目的
- 制約と仮定
- 市場範囲とセグメンテーション
- 考慮される通貨と価格設定
- 市場機会評価
- 新興地域/国
- 新興企業
- 新興アプリケーション/最終用途
- 市場動向
- 促進要因
- 市場警戒要因
- 最新のマクロ経済指標
- 地政学的な影響
- 技術的要因
- 市場評価
- ポーターの5つの競争要因分析
- バリューチェーン分析
- 規制の枠組み
- 北米
- 欧州
- アジア太平洋
- 中東・アフリカ
- 中南米
- ESG動向
- 世界の医薬品受託開発製造機関(CDMO)市場規模分析
- 世界の医薬品受託開発製造機関(CDMO)市場の紹介
- サービスタイプ別
- はじめに
- サービスタイプ別(金額)
- 医薬品開発サービス
- 金額別
- 医薬品製造サービス
- 金額別
- 医薬品原薬製造サービス
- 医薬品原薬製造サービス(金額別)
- 医薬品製剤製造サービス
- 医薬品製剤製造サービス(金額別)
- バイオ医薬品製造サービス
- 金額別
- バイオ医薬品原薬製造サービス
- バイオ医薬品原薬製造サービス(金額別)
- バイオ医薬品製剤製造サービス
- バイオ医薬品製剤製造サービス(金額別)
- 包装・ラベリングサービス
- 金額別
- 充填・包装サービス
- 金額別
- その他
- 金額別
- 研究フェーズ別
- はじめに
- 研究フェーズ別(金額)
- 前臨床
- 金額別
- 第I相
- 金額別
- 第II相
- 金額別
- 第III相
- 金額別
- 第IV相
- 金額別
- エンドユーザー別
- はじめに
- エンドユーザー別(金額)
- 大手製薬会社
- 金額別
- 中小規模製薬会社
- 金額別
- ジェネリック製薬会社
- 金額別
- その他
- 金額別
- サービスタイプ別
- 世界の医薬品受託開発製造機関(CDMO)市場の紹介
- 北米市場分析
- はじめに
- サービスタイプ別
- はじめに
- サービスタイプ別(金額)
- 医薬品開発サービス
- 金額別
- 医薬品製造サービス
- 金額別
- 医薬品原薬製造サービス
- 医薬品原薬製造サービス(金額別)
- 医薬品製剤製造サービス
- 医薬品製剤製造サービス(金額別)
- バイオ医薬品製造サービス
- 金額別
- バイオ医薬品原薬製造サービス
- バイオ医薬品原薬製造サービス(金額別)
- バイオ医薬品製剤製造サービス
- バイオ医薬品製剤製造サービス(金額別)
- 包装・ラベリングサービス
- 金額別
- 充填・包装サービス
- 金額別
- その他
- 金額別
- 研究フェーズ別
- はじめに
- 研究フェーズ別(金額)
- 前臨床
- 金額別
- 第I相
- 金額別
- 第II相
- 金額別
- 第III相
- 金額別
- 第IV相
- 金額別
- エンドユーザー別
- はじめに
- エンドユーザー別(金額)
- 大手製薬会社
- 金額別
- 中小規模製薬会社
- 金額別
- ジェネリック製薬会社
- 金額別
- その他
- 金額別
- 米国
- サービスタイプ別
- はじめに
- サービスタイプ別(金額)
- 医薬品開発サービス
- 金額別
- 医薬品製造サービス
- 金額別
- 医薬品原薬製造サービス
- 医薬品原薬製造サービス(金額別)
- 医薬品製剤製造サービス
- 医薬品製剤製造サービス(金額別)
- バイオ医薬品製造サービス
- 金額別
- バイオ医薬品原薬製造サービス
- バイオ医薬品原薬製造サービス(金額別)
- バイオ医薬品製剤製造サービス
- バイオ医薬品製剤製造サービス(金額別)
- 包装・ラベリングサービス
- 金額別
- 充填・包装サービス
- 金額別
- その他
- 金額別
- 研究フェーズ別
- はじめに
- 研究フェーズ別(金額)
- 前臨床
- 金額別
- 第I相
- 金額別
- 第II相
- 金額別
- 第III相
- 金額別
- 第IV相
- 金額別
- エンドユーザー別
- はじめに
- エンドユーザー別(金額)
- 大手製薬会社
- 金額別
- 中小規模製薬会社
- 金額別
- ジェネリック製薬会社
- 金額別
- その他
- 金額別
- サービスタイプ別
- カナダ
- 欧州市場分析
- はじめに
- サービスタイプ別
- はじめに
- サービスタイプ別(金額)
- 医薬品開発サービス
- 金額別
- 医薬品製造サービス
- 金額別
- 医薬品原薬製造サービス
- 医薬品原薬製造サービス(金額別)
- 医薬品製剤製造サービス
- 医薬品製剤製造サービス(金額別)
- バイオ医薬品製造サービス
- 金額別
- バイオ医薬品原薬製造サービス
- バイオ医薬品原薬製造サービス(金額別)
- バイオ医薬品製剤製造サービス
- バイオ医薬品製剤製造サービス(金額別)
- 包装・ラベリングサービス
- 金額別
- 充填・包装サービス
- 金額別
- その他
- 金額別
- 研究フェーズ別
- はじめに
- 研究フェーズ別(金額)
- 前臨床
- 金額別
- 第I相
- 金額別
- 第II相
- 金額別
- 第III相
- 金額別
- 第IV相
- 金額別
- エンドユーザー別
- はじめに
- エンドユーザー別(金額)
- 大手製薬会社
- 金額別
- 中小規模製薬会社
- 金額別
- ジェネリック製薬会社
- 金額別
- その他
- 金額別
- 英国
- サービスタイプ別
- はじめに
- サービスタイプ別(金額)
- 医薬品開発サービス
- 金額別
- 医薬品製造サービス
- 金額別
- 医薬品原薬製造サービス
- 医薬品原薬製造サービス(金額別)
- 医薬品製剤製造サービス
- 医薬品製剤製造サービス(金額別)
- バイオ医薬品製造サービス
- 金額別
- バイオ医薬品原薬製造サービス
- バイオ医薬品原薬製造サービス(金額別)
- バイオ医薬品製剤製造サービス
- バイオ医薬品製剤製造サービス(金額別)
- 包装・ラベリングサービス
- 金額別
- 充填・包装サービス
- 金額別
- その他
- 金額別
- 研究フェーズ別
- はじめに
- 研究フェーズ別(金額)
- 前臨床
- 金額別
- 第I相
- 金額別
- 第II相
- 金額別
- 第III相
- 金額別
- 第IV相
- 金額別
- エンドユーザー別
- はじめに
- エンドユーザー別(金額)
- 大手製薬会社
- 金額別
- 中小規模製薬会社
- 金額別
- ジェネリック製薬会社
- 金額別
- その他
- 金額別
- サービスタイプ別
- ドイツ
- フランス
- スペイン
- イタリア
- ロシア
- 北欧諸国
- ベネルクス
- その他の欧州地域
- アジア太平洋市場分析
- はじめに
- サービスタイプ別
- はじめに
- サービスタイプ別(金額)
- 医薬品開発サービス
- 金額別
- 医薬品製造サービス
- 金額別
- 医薬品原薬製造サービス
- 医薬品原薬製造サービス(金額別)
- 医薬品製剤製造サービス
- 医薬品製剤製造サービス(金額別)
- バイオ医薬品製造サービス
- 金額別
- バイオ医薬品原薬製造サービス
- バイオ医薬品原薬製造サービス(金額別)
- バイオ医薬品製剤製造サービス
- バイオ医薬品製剤製造サービス(金額別)
- 包装・ラベリングサービス
- 金額別
- 充填・包装サービス
- 金額別
- その他
- 金額別
- 研究フェーズ別
- はじめに
- 研究フェーズ別(金額)
- 前臨床
- 金額別
- 第I相
- 金額別
- 第II相
- 金額別
- 第III相
- 金額別
- 第IV相
- 金額別
- エンドユーザー別
- はじめに
- エンドユーザー別(金額)
- 大手製薬会社
- 金額別
- 中小規模製薬会社
- 金額別
- ジェネリック製薬会社
- 金額別
- その他
- 金額別
- 中国
- サービスタイプ別
- はじめに
- サービスタイプ別(金額)
- 医薬品開発サービス
- 金額別
- 医薬品製造サービス
- 金額別
- 医薬品原薬製造サービス
- 医薬品原薬製造サービス(金額別)
- 医薬品製剤製造サービス
- 医薬品製剤製造サービス(金額別)
- バイオ医薬品製造サービス
- 金額別
- バイオ医薬品原薬製造サービス
- バイオ医薬品原薬製造サービス(金額別)
- バイオ医薬品製剤製造サービス
- バイオ医薬品製剤製造サービス(金額別)
- 包装・ラベリングサービス
- 金額別
- 充填・包装サービス
- 金額別
- その他
- 金額別
- 研究フェーズ別
- はじめに
- 研究フェーズ別(金額)
- 前臨床
- 金額別
- 第I相
- 金額別
- 第II相
- 金額別
- 第III相
- 金額別
- 第IV相
- 金額別
- エンドユーザー別
- はじめに
- エンドユーザー別(金額)
- 大手製薬会社
- 金額別
- 中小規模製薬会社
- 金額別
- ジェネリック製薬会社
- 金額別
- その他
- 金額別
- サービスタイプ別
- 韓国
- 日本
- インド
- オーストラリア
- 台湾
- 東南アジア
- その他のアジア太平洋地域
- 中東・アフリカ市場分析
- はじめに
- サービスタイプ別
- はじめに
- サービスタイプ別(金額)
- 医薬品開発サービス
- 金額別
- 医薬品製造サービス
- 金額別
- 医薬品原薬製造サービス
- 医薬品原薬製造サービス(金額別)
- 医薬品製剤製造サービス
- 医薬品製剤製造サービス(金額別)
- バイオ医薬品製造サービス
- 金額別
- バイオ医薬品原薬製造サービス
- バイオ医薬品原薬製造サービス(金額別)
- バイオ医薬品製剤製造サービス
- バイオ医薬品製剤製造サービス(金額別)
- 包装・ラベリングサービス
- 金額別
- 充填・包装サービス
- 金額別
- その他
- 金額別
- 研究フェーズ別
- はじめに
- 研究フェーズ別(金額)
- 前臨床
- 金額別
- 第I相
- 金額別
- 第II相
- 金額別
- 第III相
- 金額別
- 第IV相
- 金額別
- エンドユーザー別
- はじめに
- エンドユーザー別(金額)
- 大手製薬会社
- 金額別
- 中小規模製薬会社
- 金額別
- ジェネリック製薬会社
- 金額別
- その他
- 金額別
- アラブ首長国連邦
- サービスタイプ別
- はじめに
- サービスタイプ別(金額)
- 医薬品開発サービス
- 金額別
- 医薬品製造サービス
- 金額別
- 医薬品原薬製造サービス
- 医薬品原薬製造サービス(金額別)
- 医薬品製剤製造サービス
- 医薬品製剤製造サービス(金額別)
- バイオ医薬品製造サービス
- 金額別
- バイオ医薬品原薬製造サービス
- バイオ医薬品原薬製造サービス(金額別)
- バイオ医薬品製剤製造サービス
- バイオ医薬品製剤製造サービス(金額別)
- 包装・ラベリングサービス
- 金額別
- 充填・包装サービス
- 金額別
- その他
- 金額別
- 研究フェーズ別
- はじめに
- 研究フェーズ別(金額)
- 前臨床
- 金額別
- 第I相
- 金額別
- 第II相
- 金額別
- 第III相
- 金額別
- 第IV相
- 金額別
- エンドユーザー別
- はじめに
- エンドユーザー別(金額)
- 大手製薬会社
- 金額別
- 中小規模製薬会社
- 金額別
- ジェネリック製薬会社
- 金額別
- その他
- 金額別
- サービスタイプ別
- トルコ
- サウジアラビア
- 南アフリカ
- エジプト
- ナイジェリア
- その他の中東・アフリカ地域
- 中南米市場分析
- はじめに
- サービスタイプ別
- はじめに
- サービスタイプ別(金額)
- 医薬品開発サービス
- 金額別
- 医薬品製造サービス
- 金額別
- 医薬品原薬製造サービス
- 医薬品原薬製造サービス(金額別)
- 医薬品製剤製造サービス
- 医薬品製剤製造サービス(金額別)
- バイオ医薬品製造サービス
- 金額別
- バイオ医薬品原薬製造サービス
- バイオ医薬品原薬製造サービス(金額別)
- バイオ医薬品製剤製造サービス
- バイオ医薬品製剤製造サービス(金額別)
- 包装・ラベリングサービス
- 金額別
- 充填・包装サービス
- 金額別
- その他
- 金額別
- 研究フェーズ別
- はじめに
- 研究フェーズ別(金額)
- 前臨床
- 金額別
- 第I相
- 金額別
- 第II相
- 金額別
- 第III相
- 金額別
- 第IV相
- 金額別
- エンドユーザー別
- はじめに
- エンドユーザー別(金額)
- 大手製薬会社
- 金額別
- 中小規模製薬会社
- 金額別
- ジェネリック製薬会社
- 金額別
- その他
- 金額別
- ブラジル
- サービスタイプ別
- はじめに
- サービスタイプ別(金額)
- 医薬品開発サービス
- 金額別
- 医薬品製造サービス
- 金額別
- 医薬品原薬製造サービス
- 医薬品原薬製造サービス(金額別)
- 医薬品製剤製造サービス
- 医薬品製剤製造サービス(金額別)
- バイオ医薬品製造サービス
- 金額別
- バイオ医薬品原薬製造サービス
- バイオ医薬品原薬製造サービス(金額別)
- バイオ医薬品製剤製造サービス
- バイオ医薬品製剤製造サービス(金額別)
- 包装・ラベリングサービス
- 金額別
- 充填・包装サービス
- 金額別
- その他
- 金額別
- 研究フェーズ別
- はじめに
- 研究フェーズ別(金額)
- 前臨床
- 金額別
- 第I相
- 金額別
- 第II相
- 金額別
- 第III相
- 金額別
- 第IV相
- 金額別
- エンドユーザー別
- はじめに
- エンドユーザー別(金額)
- 大手製薬会社
- 金額別
- 中小規模製薬会社
- 金額別
- ジェネリック製薬会社
- 金額別
- その他
- 金額別
- サービスタイプ別
- メキシコ
- アルゼンチン
- チリ
- コロンビア
- その他の中南米地域
- 競合状況
- 医薬品受託開発製造機関(CDMO)市場のプレーヤー別シェア
- M&A契約と提携分析
- 市場プレーヤー評価
- Thermo Fisher Scientific, Inc.
- 概要
- 企業情報
- 収益
- 平均販売価格 (ASP)
- SWOT分析
- 最近の動向
- Lonza Group
- WuXi Apptec
- WuXi Biologics
- AbbVie, Inc.
- Catalent, Inc.
- Samsung Biologics
- Evonik Industries AG
- FUJIFILM Holding Corporation
- Siegfried Holding AG
- Boehringer Ingelheim International
- Merck KGaA
- Almac Group
- Charles River Laboratories
- Asychem Inc.
- Thermo Fisher Scientific, Inc.
- 調査方法
- 調査データ
- 二次データ
- 主要な二次情報源
- 二次情報源からの主要データ
- 一次データ
- 一次情報源からの主要データ
- 一次データの内訳
- 二次データ
- 二次・一次調査
- 主要な業界インサイト
- 市場規模の推定
- ボトムアップアプローチ
- トップダウンアプローチ
- 市場予測
- 調査の仮定
- 仮定
- 制約
- リスク評価
- 調査データ
- 付録
- ディスカッションガイド
- カスタマイズオプション
- 関連レポート
- 免責事項
“`
*** 本調査レポートに関するお問い合わせ ***

医薬品受託開発製造機関(CDMO:Contract Development and Manufacturing Organization)とは、製薬企業やバイオベンチャーから医薬品の研究開発段階から商用生産段階に至るまでのプロセスを包括的に受託する専門機関を指します。従来、医薬品の開発と製造はそれぞれCRO(Contract Research Organization:医薬品開発業務受託機関)やCMO(Contract Manufacturing Organization:医薬品製造受託機関)が担うことが一般的でしたが、CDMOはこれら両方の機能を統合し、薬物候補の探索から前臨床・臨床開発、製剤開発、治験薬製造、そして最終的な商業生産まで、一貫したサービスを提供します。これにより、クライアント企業は自社で大規模な設備投資や専門人材を抱えることなく、医薬品開発・製造の専門知識とインフラを活用できるようになります。
CDMOが手掛ける医薬品の種類は多岐にわたります。低分子医薬品の原薬合成から製剤化、高分子医薬品であるバイオ医薬品(抗体医薬、組換えタンパク質など)の細胞株開発、培養、精製、無菌製剤化、さらには近年急速に発展している再生医療等製品、細胞・遺伝子治療薬、ワクチンといった先端モダリティまで、幅広い領域に対応しています。サービス範囲も、特定の製造工程のみを受託する部分受託から、開発初期段階から最終製品までを一手に引き受けるフルサービスまで、クライアントのニーズに応じて柔軟に提供されます。
製薬企業がCDMOを利用する主な目的は、開発期間の短縮、コスト削減、そして専門性の高い技術やノウハウへのアクセスです。自社で全ての開発・製造設備を保有し、専門家を育成するには膨大な時間と投資が必要となりますが、CDMOを活用することで、これらのリソースを効率的に外部から調達できます。特に、新興のバイオベンチャー企業にとっては、資金や人的リソースが限られる中で、CDMOは医薬品開発を加速させる上で不可欠なパートナーとなっています。また、市場の需要変動に合わせた生産規模の柔軟な調整や、各国の規制要件に精通した品質管理体制の構築も、CDMOが提供する重要な価値の一つです。
CDMOの業務を支える関連技術は多岐にわたり、常に最新のイノベーションを取り入れています。例えば、製造面では、生産効率を高める連続生産技術や、バイオ医薬品製造におけるシングルユース(使い捨て)システムなどが挙げられます。品質管理においては、高度な分析機器(質量分析計、NMR、クロマトグラフィーなど)を用いた詳細な特性解析や、インプロセス管理技術が不可欠です。また、製剤技術では、薬物の安定性向上や体内吸収性を最適化するための様々な製剤化技術(ナノ粒子製剤、徐放性製剤など)が開発・適用されています。近年では、AIや機械学習を活用したプロセス最適化、デジタルツインによる製造プロセスのシミュレーション、データインテグリティを確保するための先進的なITシステム(LIMS、MESなど)の導入も進んでおり、これらデジタル技術が開発・製造の効率化と品質向上に大きく貢献しています。さらに、グローバルな医薬品規制要件(GMP:医薬品製造管理および品質管理基準)への深い理解と、それを遵守するための厳格な品質保証体制も、CDMOが提供する重要な技術的基盤と言えます。