パイロジェン試験市場の規模・シェア分析、成長動向と予測 (2025-2030年)
パイロジェン試験市場レポートは、製品別(キットおよび試薬、サービス、機器)、試験タイプ別(LAL試験、ウサギパイロジェン試験、モノサイト活性化試験、その他の試験タイプ)、エンドユーザー別(製薬・バイオテクノロジー企業、医療機器企業、その他のエンドユーザー)、および地域別に市場をセグメント化しています。市場規模と予測は、金額(米ドル)で提供されます。

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
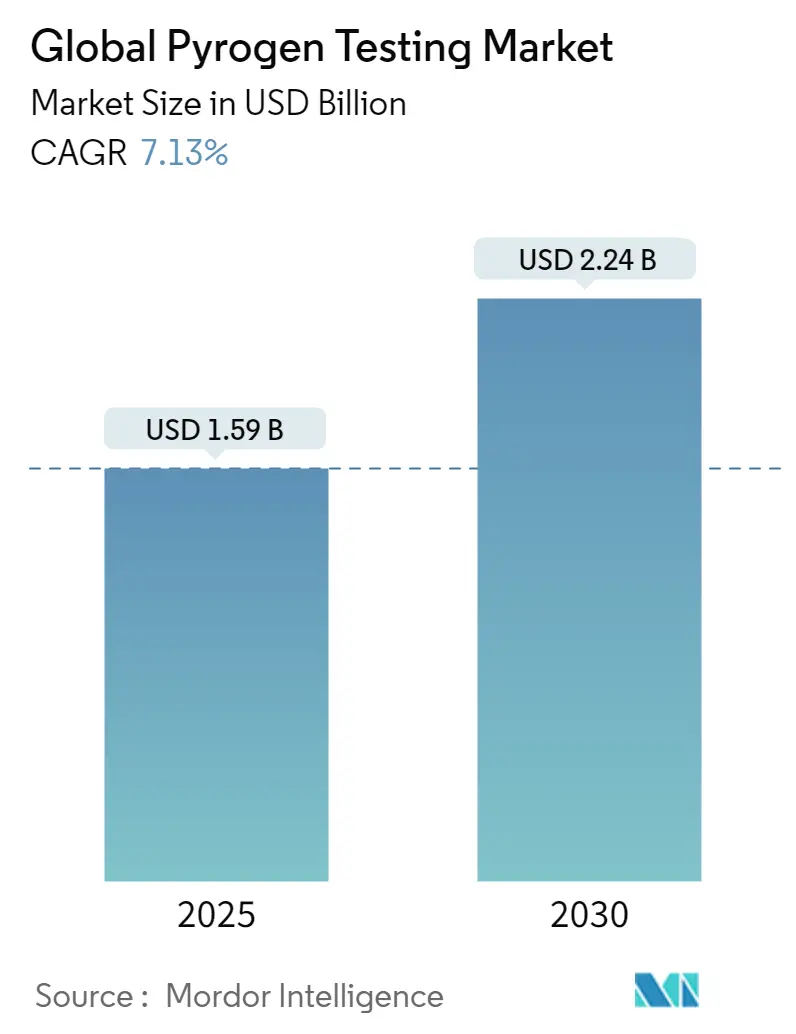
発熱性物質試験市場は、2025年に15.9億米ドルと評価され、2030年までに22.4億米ドルに達すると予測されており、予測期間中の年平均成長率(CAGR)は7.13%です。この持続的な成長は、バイオ医薬品の生産増加、組換えアッセイに対する強力な規制支援、品質管理(QC)サービスのアウトソーシングへの広範な移行によって推進されています。企業は手作業の介入を減らし、エラーを削減し、製品の迅速なリリースを実現するために自動化を採用しています。規制当局は、カブトガニの個体数を保護しつつ供給の継続性を確保するため、動物を使用しない試験を承認しています。アジア太平洋地域のメーカーは高スループットの生産能力を増強し、新たな需要を生み出しており、北米は依然としてQCラボの最大の設置基盤を維持しています。ワクチンへの継続的な資金提供、細胞・遺伝子治療パイプラインの拡大、費用対効果の高いマイクロ流体キットなどが、発熱性物質試験市場の長期的な拡大を後押ししています。
主要なレポートのポイント
* 製品別では、キット&試薬が2024年に44.51%の収益シェアを占め、機器は2030年までに8.21%の最速CAGRを記録すると予測されています。
* 試験タイプ別では、LAL試験が2024年に60.32%の収益シェアを占め、モノサイト活性化試験(MAT)は2030年までに7.85%の最速CAGRを記録すると予測されています。
* 用途別では、医薬品・バイオ医薬品が2024年に最大の収益シェアを占め、医療機器は2030年までに最も速いCAGRを記録すると予測されています。
* 地域別では、北米が2024年に最大の市場シェアを占め、アジア太平洋地域は2030年までに最も速いCAGRを記録すると予測されています。
主要な市場参加者には、Lonza Group AG、Merck KGaA、Associates of Cape Cod, Inc.、FUJIFILM Wako Pure Chemical Corporation、Charles River Laboratories International, Inc.などが含まれます。
このレポートは、発熱性物質試験市場に関する包括的な分析を提供しています。
1. 市場定義と調査範囲
発熱性物質試験市場は、非経口薬、ワクチン、バイオ医薬品、および高リスク医療機器に含まれるエンドトキシンやその他の発熱性汚染物質を検出するためのin-vitroキット、試薬、機器、ならびに契約サービスから生じる収益を対象としています。環境または食品分野のエンドトキシンアッセイ、動物由来の研究用試薬、および日常的な滅菌試験は本調査の範囲外とされています。
2. 市場規模と成長予測
世界のピロゲン試験市場は、2025年に15.9億米ドルに達すると予測されており、2030年までに年平均成長率(CAGR)7.13%で成長し、22.4億米ドルに達すると見込まれています。
3. 市場の主要な推進要因
市場の成長を牽引する主な要因は以下の通りです。
* バイオ医薬品およびバイオシミラーのパイプラインの急速な拡大。
* 受託研究・製造アウトソーシング(CRO/CMO)の需要増加。
* 組換えFactor C(rFC)アッセイに対する規制当局の承認と普及。
* 環境保護意識の高まりによる、動物由来成分不使用のエンドトキシン検出法への移行。
* マイクロ流体ベースの迅速な発熱性物質検出プラットフォームの技術革新。
* ワクチンおよび細胞・遺伝子治療薬の製造量の急増。
4. 市場の主な阻害要因
一方で、市場の成長を抑制する要因も存在します。
* カブトガニライセート(LAL試験の主要原料)の供給不安定性。
* 従来の品質管理プロトコルからrFCへの移行における不確実性。
* 単球活性化試験(MAT)結果のラボ間での変動性。
* 自動エンドトキシン分析装置の高額な初期導入費用。
5. 市場のセグメンテーション
市場は以下の主要なセグメントに基づいて詳細に分析されています。
* 製品別: キットおよび試薬、サービス、機器。
* 試験タイプ別: LAL試験、ウサギ発熱性物質試験、単球活性化試験、その他の試験タイプ。
* エンドユーザー別: 製薬・バイオテクノロジー企業、医療機器企業、その他のエンドユーザー。
* 地域別: 北米、欧州、アジア太平洋、中東・アフリカ、南米。各地域はさらに主要国に細分化されています。
6. 競争環境と主要企業
市場の主要プレーヤーには、Merck KGaA、GenScript、Lonza Group、BioMérieux、Ellab A/Sなどが挙げられます。レポートでは、これらの企業のプロファイル、市場シェア分析、製品・サービス、および最近の動向が詳細に記述されています。
7. 調査方法の信頼性
Mordor Intelligenceの調査は、厳格な方法論に基づいています。一次調査では、北米、欧州、アジア太平洋地域の製薬会社品質管理責任者、受託試験ラボのバリデーション担当者、規制コンサルタントへのインタビューを通じて、LALキット価格、rFC採用率、サービス処理能力に関する仮定を検証しました。二次調査では、米国FDAのリコールアーカイブ、EMA EudraGMDP証明書、USP章の改訂、WHO TRSノートなどの公開データセットをスクリーニングし、規制要件の変化を把握しています。市場規模の算出と予測は、注射剤の生産量とバッチあたりの平均試験頻度を関連付けるトップダウンアプローチと、主要なキットサプライヤーおよび受託ラボのボトムアップ集計を組み合わせたハイブリッドモデルを採用しています。この多角的なアプローチと厳密なデータ検証により、意思決定者が信頼できる透明性の高い市場ベースラインが提供されています。
8. 地域別市場動向とCDMOの役割
2025年には北米が最大の市場シェアを占めると予測されています。一方、アジア太平洋地域は、中国とインドにおけるバイオ医薬品製造の拡大に牽引され、2030年まで8.54%のCAGRで最も急速に成長する地域となる見込みです。受託開発製造機関(CDMO)は、大量の試験を専門施設に集約し、自動化システムへの投資を可能にすることで、試験あたりのコストを削減し、幅広い採用を促進するため、市場拡大において重要な役割を担っています。

1. はじめに
- 1.1 調査の前提 & 市場の定義
- 1.2 調査の範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場概観
- 4.1 市場概要
-
4.2 市場の推進要因
- 4.2.1 バイオ医薬品およびバイオシミラーパイプラインの急速な成長
- 4.2.2 受託研究および製造アウトソーシングの拡大
- 4.2.3 組換えC因子 (rFC) アッセイの規制当局による承認
- 4.2.4 環境保護を目的とした動物由来成分不使用のエンドトキシン検出への移行
- 4.2.5 マイクロ流体ベースの迅速発熱性物質検出プラットフォーム
- 4.2.6 ワクチンおよび細胞・遺伝子治療薬の製造量の急増
-
4.3 市場の阻害要因
- 4.3.1 カブトガニライセート供給の変動性
- 4.3.2 従来のQCプロトコルにおけるrFC移行時の不確実性
- 4.3.3 単球活性化試験結果のラボ間変動
- 4.3.4 自動エンドトキシン分析装置の高額な初期費用
- 4.4 バリュー/サプライチェーン分析
- 4.5 規制環境
- 4.6 技術的展望
-
4.7 ポーターの5つの力分析
- 4.7.1 新規参入者の脅威
- 4.7.2 買い手の交渉力
- 4.7.3 供給者の交渉力
- 4.7.4 代替品の脅威
- 4.7.5 競争の激しさ
5. 市場規模と成長予測 (金額、百万米ドル)
-
5.1 製品別
- 5.1.1 キットおよび試薬
- 5.1.2 サービス
- 5.1.3 機器
-
5.2 テストタイプ別
- 5.2.1 LALテスト
- 5.2.2 ウサギ発熱性物質試験
- 5.2.3 単球活性化試験
- 5.2.4 その他のテストタイプ
-
5.3 エンドユーザー別
- 5.3.1 製薬 & バイオテクノロジー企業
- 5.3.2 医療機器企業
- 5.3.3 その他のエンドユーザー
-
5.4 地域別
- 5.4.1 北米
- 5.4.1.1 米国
- 5.4.1.2 カナダ
- 5.4.1.3 メキシコ
- 5.4.2 欧州
- 5.4.2.1 ドイツ
- 5.4.2.2 英国
- 5.4.2.3 フランス
- 5.4.2.4 イタリア
- 5.4.2.5 スペイン
- 5.4.2.6 その他の欧州
- 5.4.3 アジア太平洋
- 5.4.3.1 中国
- 5.4.3.2 日本
- 5.4.3.3 インド
- 5.4.3.4 オーストラリア
- 5.4.3.5 韓国
- 5.4.3.6 その他のアジア太平洋
- 5.4.4 中東 & アフリカ
- 5.4.4.1 GCC
- 5.4.4.2 南アフリカ
- 5.4.4.3 その他の中東 & アフリカ
- 5.4.5 南米
- 5.4.5.1 ブラジル
- 5.4.5.2 アルゼンチン
- 5.4.5.3 その他の南米
6. 競合情勢
- 6.1 市場シェア分析
-
6.2 企業プロファイル(グローバルレベルの概要、市場レベルの概要、主要セグメント、利用可能な財務情報、戦略情報、主要企業の市場ランク/シェア、製品&サービス、および最近の動向を含む)
- 6.2.1 アソシエイツ・オブ・ケープコッド社
- 6.2.2 バイオメリューSA
- 6.2.3 チャールズ・リバー・ラボラトリーズ社
- 6.2.4 エラブA/S
- 6.2.5 ジェンスクリプト・バイオテック
- 6.2.6 ロンザ・グループ
- 6.2.7 メルクKGaA
- 6.2.8 サーモフィッシャーサイエンティフィック社
- 6.2.9 富士フイルム和光純薬株式会社
- 6.2.10 ウーシー・アップテック
- 6.2.11 ユーロフィン・サイエンティフィック
- 6.2.12 マイクロコート・バイオテクノロジーGmbH
- 6.2.13 ソテラ・ヘルス(ネルソン・ラボ)
- 6.2.14 サンキン
- 6.2.13 生化学工業株式会社
- 6.2.16 ハイグロスGmbH
- 6.2.17 トキシン・テクノロジー社
- 6.2.18 ラボール・ドクター・メルク&コレゲン
- 6.2.19 エンドセーフ(チャールズ・リバー)
7. 市場機会&将来展望
*** 本調査レポートに関するお問い合わせ ***

パイロジェン試験は、医薬品や医療機器の安全性評価において極めて重要な試験の一つでございます。この試験は、製品が患者に発熱反応を引き起こす可能性のある物質、すなわちパイロジェンを含んでいないことを確認するために実施されます。
定義
パイロジェンとは、生体内に侵入すると発熱反応を引き起こす物質の総称でございます。これには、グラム陰性菌の細胞壁由来のリポ多糖(LPS)であるエンドトキシンが代表的ですが、グラム陽性菌の成分、ウイルス、真菌、合成高分子、あるいは医薬品の製造工程で生じる不純物など、エンドトキシン以外の非エンドトキシン性パイロジェンも存在します。パイロジェン試験の目的は、注射剤、輸液、ワクチン、生物学的製剤、あるいは体内に直接接触する医療機器などが、これらの発熱性物質によって汚染されていないことを保証し、患者の安全を確保することにあります。特に、直接血管内に投与される製品や、長期間体内に留まる医療機器においては、微量のパイロジェンであっても重篤な副作用を引き起こす可能性があるため、厳格な管理が求められます。
種類
パイロジェン試験には、主に以下の三つの方法がございます。
1. ウサギ発熱試験(Rabbit Pyrogen Test)
これは最も歴史が長く、長らく公定法として用いられてきた試験法でございます。健康なウサギの耳静脈に検体を投与し、その後の体温上昇を一定時間測定することで、発熱反応の有無を評価します。ウサギはヒトと同様にパイロジェンに対して発熱反応を示すため、生体における反応を直接的に評価できるという利点があります。しかし、動物を使用することから、個体差によるばらつき、試験に要する時間とコスト、動物愛護の観点からの倫理的問題、そしてエンドトキシン以外の非エンドトキシン性パイロジェンに対する感度が低い場合があるといった課題も指摘されております。
2. リムルス試験(LAL Test - Limulus Amebocyte Lysate Test)
カブトガニの血球抽出液(リムルス試薬)を用いる試験法で、エンドトキシンに特異的に反応するという特徴がございます。エンドトキシンが存在すると、リムルス試薬中のタンパク質が凝固・ゲル化する反応を利用しており、ゲル化法、比色法、濁度法などのバリエーションがあります。この試験は、ウサギ発熱試験に比べて迅速かつ高感度であり、定量性にも優れているため、現在では多くの医薬品や医療機器のエンドトキシン試験として広く採用されております。動物を使用しない(カブトガニは使用しますが、ウサギのような哺乳類ではありません)という点も利点とされます。しかし、エンドトキシン以外の非エンドトキシン性パイロジェンを検出できないという限界がございます。
3. モノサイト活性化試験(MAT - Monocyte Activation Test)
ヒトの単球(または単球由来の細胞株)を用いるin vitro試験法でございます。パイロジェンが単球を活性化させ、インターロイキン-6(IL-6)などのサイトカインを産生させる反応を利用して、パイロジェンの存在を検出します。この試験の最大の利点は、エンドトキシンだけでなく、非エンドトキシン性パイロジェンも検出できる可能性が高い点にあります。また、ヒト由来の細胞を使用するため、ヒト生体における反応をより正確に予測できると考えられており、動物を使用しないという点も大きなメリットです。特に、生物学的製剤など、非エンドトキシン性パイロジェンによる発熱リスクが懸念される製品の試験法として注目されており、欧州薬局方では公定法として収載されております。一方で、LAL試験に比べて操作が複雑であり、コストが高い場合があるといった課題もございます。
用途
パイロジェン試験は、多岐にわたる製品の品質管理と安全性評価に不可欠でございます。
* 医薬品: 注射剤、輸液、ワクチン、血液製剤、生物学的製剤、点眼剤など、体内に直接投与される医薬品全般。
* 医療機器: 人工透析器、カテーテル、インプラント、手術器具、注射針など、体内に挿入または接触する医療機器。
* 原材料: 医薬品や医療機器の製造に使用される精製水、注射用水、試薬、容器、フィルターなど。
* 製造工程管理: 製造ラインにおける汚染の監視や、洗浄・滅菌工程のバリデーション。
* 研究開発: 新規医薬品や医療機器の開発段階における安全性スクリーニング。
関連技術
パイロジェン試験の信頼性を高め、効率化するための関連技術も進化しております。
* エンドトキシン除去技術: 医薬品製造工程において、限外ろ過膜や吸着剤などを用いてエンドトキシンを除去する技術は、製品の安全性を確保する上で極めて重要です。
* 無菌試験: パイロジェン試験とは異なりますが、医薬品の安全性評価において、微生物の混入がないことを確認する無菌試験は、パイロジェン試験と並んで必須の試験でございます。
* 細胞培養技術: MATの基盤となる技術であり、安定した細胞株の維持や培養条件の最適化が試験の精度に直結します。
* 分子生物学的手法: サイトカインの定量にはELISA(酵素免疫測定法)などが用いられ、高感度な検出を可能にしています。
* 自動化・ハイスループットスクリーニング: 試験の効率化とコスト削減のため、自動化された分析装置やハイスループットスクリーニングシステムが開発・導入されております。
市場背景
近年、パイロジェン試験を取り巻く市場環境は大きく変化しております。
* 規制の厳格化と国際調和: 各国の薬局方(日本薬局方、米国薬局方、欧州薬局方など)において、パイロジェン試験の要件が厳格化され、国際的な規制調和の動きが進んでおります。特に、動物愛護の観点から、ウサギ発熱試験からLAL試験、そしてMATへの移行が推奨される傾向にあります。
* バイオ医薬品の台頭: 抗体医薬品や遺伝子治療薬などのバイオ医薬品は、その製造工程や製品特性上、非エンドトキシン性パイロジェンによる汚染リスクが懸念されることがあり、MATの重要性が増しております。
* コストと効率の追求: 医薬品開発の加速と製造コストの削減が求められる中で、より迅速かつ低コストで、かつ高感度な試験法のニーズが高まっております。
* サプライチェーンの複雑化: グローバルなサプライチェーンにおいて、原材料から最終製品に至るまでの全工程でのパイロジェン管理が課題となっております。
将来展望
パイロジェン試験の将来は、さらなる技術革新と規制環境の変化によって形成されるでしょう。
* MATの普及と標準化: 非エンドトキシン性パイロジェン検出の重要性が高まるにつれて、MATはより多くの製品に適用され、国際的な標準化がさらに進むと予想されます。より簡便で高感度なMATキットの開発も期待されます。
* in silico/in vitroモデルの進化: 動物実験のさらなる削減を目指し、コンピュータシミュレーション(in silico)や、より高度な細胞モデル(in vitro)を用いたパイロジェン検出技術の研究開発が進むでしょう。
* 高感度化・迅速化: 微量のパイロジェンをより短時間で検出できる技術や、リアルタイムモニタリングが可能なシステムの開発が期待されます。これにより、製造工程における迅速な品質管理が可能になります。
* 多項目同時検出: エンドトキシンだけでなく、複数の非エンドトキシン性パイロジェンを同時に、かつ特異的に検出できるマルチプレックスアッセイの開発が進む可能性があります。
* AI・データ解析の活用: 試験結果のビッグデータをAIで解析し、汚染源の特定、リスク予測、品質管理の最適化に活用する動きが加速するでしょう。
* 個別化医療への対応: 将来的には、患者個々の感受性に応じたパイロジェンリスク評価など、個別化医療の進展に伴う新たな安全性評価のニーズが生まれる可能性もございます。
パイロジェン試験は、医薬品や医療機器の安全性を確保するための最後の砦とも言える重要な工程であり、その技術と規制は今後も進化し続けることでしょう。