リアルワールドエビデンスソリューション市場:市場規模、シェア分析、成長動向、予測(2025-2030年)
リアルワールドエビデンスソリューション市場レポートは、コンポーネント(サービスなど)、展開モード(クラウドベースなど)、治療領域(医薬品開発・承認など)、アプリケーション(医薬品開発・承認など)、エンドユーザー(製薬・医療機器企業など)、および地域(北米、欧州など)別に分類されます。市場予測は金額(米ドル)で提供されます。

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
リアルワールドエビデンス(RWE)ソリューション市場は、2025年から2030年にかけて力強い成長が見込まれています。本市場は、コンポーネント、展開モード、治療領域、アプリケーション、エンドユーザー、および地域別にセグメント化されており、市場予測は米ドル(USD)建てで提供されています。
市場概要:
* 調査期間: 2019年~2030年
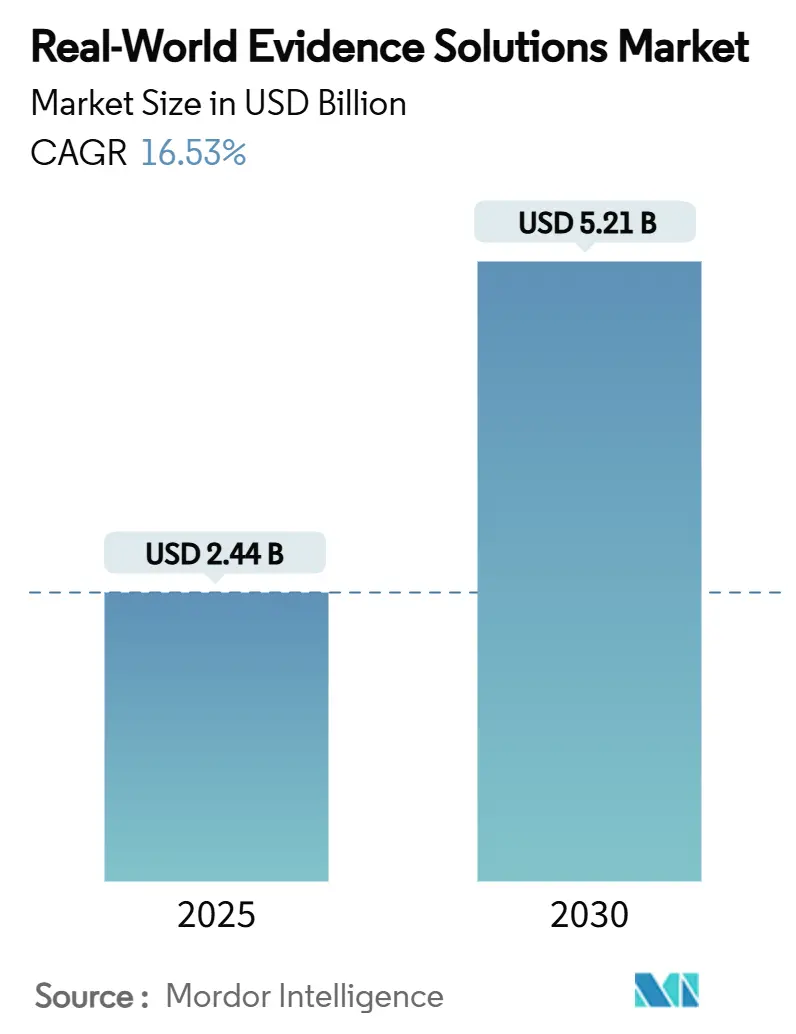
* 市場規模(2025年): 24.4億米ドル
* 市場規模(2030年): 52.1億米ドル
* 成長率(2025年~2030年): 年平均成長率(CAGR)16.53%
* 最も急速に成長する市場: アジア太平洋地域
* 最大の市場: 北米
* 市場集中度: 中程度
* 主要企業: IQVIA Inc.、Optum Inc.、Oracle Health、ICON plc、IBMなど(順不同)
市場分析:
RWEソリューション市場は、2025年には24.4億米ドルに達し、2030年には52.1億米ドルに成長し、CAGR 16.53%で力強く拡大すると予測されています。この成長は、デジタル化された臨床、ゲノム、および管理データセットの急速な増加、米国、欧州連合、日本の規制当局による非介入研究の受け入れの増加、および医薬品開発におけるRWEの活用拡大によって牽引されています。
RWEソリューション市場の成長を促進する主な要因は以下の通りです。
* デジタル化された臨床、ゲノム、および管理データセットの急速な増加
* 米国、欧州連合、日本の規制当局による非介入研究の受け入れの増加
* 医薬品開発におけるRWEの活用拡大
* 医薬品開発コストの増加と市場投入までの期間の短縮の必要性
* 個別化医療への需要の高まり
* リアルタイムデータとエビデンスに基づく意思決定の必要性
しかし、RWEソリューション市場の成長は、データプライバシーとセキュリティに関する懸念、データ統合と標準化の課題、およびRWEの複雑さに対する理解不足によって抑制される可能性があります。
市場は、コンポーネント(サービス、データセット)、展開モード(オンプレミス、クラウドベース)、治療領域(腫瘍学、心血管疾患、神経学、免疫学、希少疾患など)、アプリケーション(規制当局への提出、市販後調査、臨床試験設計と最適化、市場アクセスと償還、リスク管理など)、エンドユーザー(製薬・バイオテクノロジー企業、医療機器企業、医療提供者、学術・研究機関、政府機関など)、および地域(北米、欧州、アジア太平洋、ラテンアメリカ、中東・アフリカ)に基づいてセグメント化されています。
地域別では、北米が最大の市場シェアを占めており、これは主要な製薬・バイオテクノロジー企業の存在、高度な医療インフラ、およびRWE研究への多額の投資に起因しています。アジア太平洋地域は、医療費の増加、慢性疾患の有病率の上昇、およびRWEソリューションに対する意識の高まりにより、最も急速に成長する市場と予測されています。
主要企業は、市場での競争力を維持するために、戦略的提携、買収、新製品開発に注力しています。例えば、IQVIA Inc.は、RWEソリューションのポートフォリオを拡大するために、様々な企業と提携しています。Optum Inc.は、データ分析とRWEサービスを強化するために、技術革新に投資しています。Oracle Healthは、医療データプラットフォームとRWE機能を統合することで、市場での地位を強化しています。
リアルワールドエビデンス(RWE)ソリューション市場に関する本レポートは、市場の定義、規模、成長予測、主要な促進要因と抑制要因、および競争環境について詳細に分析しています。
1. 市場定義と範囲
リアルワールドエビデンスソリューション市場は、電子カルテ、請求データ、薬局調剤データ、患者生成データ、コネクテッドデバイスからのフィードなど、多様なリアルワールドデータを構造化されたエビデンスに変換するソフトウェアプラットフォーム、キュレーションされたデータセット、およびプロフェッショナルサービスから得られる総収益として定義されます。これらのソリューションは、ライフサイエンス企業、医療保険者、医療提供者、および規制当局が、研究、安全性評価、償還、商業化に関する意思決定を行うために利用されます。本調査は、北米、欧州、アジア太平洋、ラテンアメリカ、中東およびアフリカの17カ国におけるクラウドベース、オンプレミス、ハイブリッドの展開モードを対象としています。ただし、単独のコンシューマーウェルネスアプリ、ウェアラブルセンサーの生データブローカー、一般的な病院ITアウトソーシング費用は市場範囲から除外されています。
2. 市場規模と成長予測
リアルワールドエビデンスソリューション市場は、2025年に24.4億米ドルと評価されており、2030年までに52.1億米ドルに達すると予測されています。予測期間中の年平均成長率(CAGR)は16.53%と、堅調な成長が見込まれています。
3. 市場促進要因
市場の成長を牽引する主な要因は以下の通りです。
* 主要機関における規制当局の承認拡大: 各国の規制当局がRWEの利用を積極的に受け入れています。
* 医療データのデジタル化の進展: 電子カルテなどのデジタル化された医療データが増加しています。
* 医薬品開発における外部対照群の利用: 臨床試験において外部対照群としてRWEが活用されています。
* 価値に基づく償還モデルの導入: 医療費償還において、治療の価値に基づいたモデルが採用されつつあります。
* 人工知能(AI)および高度な分析プラットフォームの成熟: AI技術の進化がRWEの生成と分析を効率化しています。
* CRO、テクノロジーベンダー、医療システム間の戦略的連携: 業界内の協力関係がRWEソリューションの普及を後押ししています。
4. 市場抑制要因
一方で、市場の成長を妨げる課題も存在します。
* データプライバシーと相互運用性の課題: 異なるシステム間でのデータ共有やプライバシー保護が複雑です。
* 国境を越えた研究における規制の断片化: 各国の規制が異なるため、国際的な研究が困難になる場合があります。
* キュレーションされた縦断的データセットの高額な取得・ライセンス費用: 高品質なデータセットの利用には多大なコストがかかります。
* RWE研究における方法論的厳密性とバイアスに対するステークホルダーの懐疑論: RWEの信頼性や偏りに対する懸念が一部の利害関係者に存在します。
5. 主要なセグメンテーション
* コンポーネント別: サービスが市場の55%を占めており、研究デザイン、データキュレーション、規制戦略において外部専門家への依存が高いことを示しています。データセットには、臨床現場データ、請求・会計データ、薬局調剤データ、患者主導・PROデータなどが含まれます。ソフトウェア&分析プラットフォームも重要な要素です。
* 展開モード別: クラウドベース、オンプレミス、ハイブリッドの3種類があります。
* 治療領域別: オンコロジー(腫瘍学)が市場の35%を占め、最大のシェアを保持しています。これは、バイオマーカーが豊富なレジストリと高い新薬上市速度が、精密医療承認のための継続的なエビデンス生成を必要としているためです。その他、循環器、糖尿病、神経学、精神医学、免疫学などが含まれます。
* アプリケーション別: 医薬品開発・承認、医療機器開発・承認、ファーマコビジランス・安全性研究、規制当局の意思決定・償還などが挙げられます。
* エンドユーザー別: 製薬・医療機器企業、CRO(医薬品開発業務受託機関)、医療提供者・支払い者ネットワークなどが主要なエンドユーザーです。
* 地域別: アジア太平洋地域は、2030年までのCAGRが17.8%と最も速い成長を遂げる地域です。これは、中国、日本、オーストラリアにおける医療記録の急速なデジタル化と、外国のリアルワールドデータに対する規制当局の受け入れ拡大が要因です。北米、欧州、中東・アフリカ、南米も重要な市場です。
6. AIの役割と課題への対応
AIは、非構造化データからの自動抽出、手動レビュー時間の短縮、予測的洞察の提供を可能にし、ベンダーがプレミアムライセンス料を獲得し、市場全体の成長を上回る速度で成長することを可能にしています。データプライバシー規制の断片化や相互運用性の課題は国境を越えた研究を阻害するものの、トークン化やフェデレーテッドラーニングといった技術が、強力なエンジニアリング能力を持つベンダーにとってこれらの障害を緩和しています。
7. 調査方法論の信頼性
本レポートの調査は、ファーマコビジランス担当者、HEOR(医療経済・アウトカム研究)責任者、CRO幹部、保険者、医療システム情報担当者への構造化インタビューや調査を含む一次調査と、FDA、EMA、CMSなどの公的機関の資料、業界団体、査読付きジャーナル、企業報告書などの二次調査を組み合わせて実施されています。市場規模の算出と予測は、EHR普及率、グローバルなバイオ医薬品R&D支出、FDA承認数、クラウドサービス価格動向などの主要変数を多変量回帰分析で統合するトップダウンおよびボトムアップのアプローチを採用しています。モデル出力は独立した指標で検証され、毎年更新されることで、透明性と信頼性の高いベースラインを提供しています。
リアルワールドエビデンスソリューション市場は、規制当局の受け入れ拡大、デジタルヘルスケアデータの増加、技術の進歩に支えられ、今後も力強い成長が期待されます。データプライバシーや相互運用性といった課題は残るものの、技術革新と戦略的連携により克服されつつあります。

1. はじめに
- 1.1 調査の前提 & 市場の定義
- 1.2 調査範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場概況
- 4.1 市場概要
-
4.2 市場の推進要因
- 4.2.1 主要機関における規制上の承認
- 4.2.2 デジタル化された医療データの拡大
- 4.2.3 医薬品における外部対照群の使用
- 4.2.4 価値に基づく償還モデル
- 4.2.5 人工知能と高度な分析プラットフォームの成熟
- 4.2.6 CRO、テクノロジーベンダー、医療システム間の戦略的コラボレーション
-
4.3 市場の阻害要因
- 4.3.1 データプライバシーと相互運用性の課題
- 4.3.2 国境を越えた研究における規制の断片化
- 4.3.3 キュレーションされた縦断的データセットの高額な取得およびライセンス費用
- 4.3.4 RWE研究における方法論的厳密性とバイアスに関する利害関係者の懐疑論
-
4.4 ポーターの5つの力分析
- 4.4.1 新規参入者の脅威
- 4.4.2 買い手の交渉力
- 4.4.3 供給者の交渉力
- 4.4.4 代替品の脅威
- 4.4.5 競争の激しさ
5. 市場規模 & 成長予測 (金額、米ドル)
-
5.1 コンポーネント別
- 5.1.1 サービス
- 5.1.2 データセット
- 5.1.2.1 臨床現場データ
- 5.1.2.2 請求および会計データ
- 5.1.2.3 調剤データ
- 5.1.2.4 患者主導型およびPROデータ
- 5.1.2.5 その他のコンポーネント
- 5.1.3 ソフトウェアおよび分析プラットフォーム
-
5.2 展開モード別
- 5.2.1 クラウドベース
- 5.2.2 オンプレミス
- 5.2.3 ハイブリッド
-
5.3 治療領域別
- 5.3.1 腫瘍学
- 5.3.2 循環器学
- 5.3.3 糖尿病
- 5.3.4 神経学
- 5.3.5 精神医学
- 5.3.6 免疫学
- 5.3.7 その他の治療領域
-
5.4 アプリケーション別
- 5.4.1 医薬品開発および承認
- 5.4.2 医療機器開発および承認
- 5.4.3 医薬品安全性監視および安全性研究
- 5.4.4 規制上の意思決定および償還
-
5.5 エンドユーザー別
- 5.5.1 製薬会社および医療機器会社
- 5.5.2 医薬品開発業務受託機関 (CRO)
- 5.5.3 医療提供者および支払い者・提供者ネットワーク
- 5.5.4 その他のエンドユーザー
-
5.6 地域別
- 5.6.1 北米
- 5.6.1.1 米国
- 5.6.1.2 カナダ
- 5.6.1.3 メキシコ
- 5.6.2 ヨーロッパ
- 5.6.2.1 ドイツ
- 5.6.2.2 英国
- 5.6.2.3 フランス
- 5.6.2.4 イタリア
- 5.6.2.5 スペイン
- 5.6.2.6 その他のヨーロッパ
- 5.6.3 アジア太平洋
- 5.6.3.1 中国
- 5.6.3.2 日本
- 5.6.3.3 インド
- 5.6.3.4 韓国
- 5.6.3.5 オーストラリア
- 5.6.3.6 その他のアジア太平洋
- 5.6.4 中東およびアフリカ
- 5.6.4.1 GCC
- 5.6.4.2 南アフリカ
- 5.6.4.3 その他の中東およびアフリカ
- 5.6.5 南米
- 5.6.5.1 ブラジル
- 5.6.5.2 アルゼンチン
- 5.6.5.3 その他の南米
6. 競合情勢
- 6.1 市場集中度
- 6.2 戦略的動き
- 6.3 市場シェア分析
-
6.4 企業プロファイル(グローバルレベルの概要、市場レベルの概要、主要事業セグメント、財務、従業員数、主要情報、市場ランク、市場シェア、製品とサービス、および最近の動向の分析を含む)
- 6.4.1 IQVIA Inc.
- 6.4.2 Optum Inc.
- 6.4.3 Oracle Health
- 6.4.4 ICON plc
- 6.4.5 IBM
- 6.4.6 Syneos Health
- 6.4.7 TriNetX LLC
- 6.4.8 Thermo Fisher Scientific, Inc.
- 6.4.9 Flatiron Health
- 6.4.10 SAS Institute, Inc.
- 6.4.11 Aetion Inc.
- 6.4.12 Komodo Health
- 6.4.13 Medpace Holdings Inc.
- 6.4.14 ConcertAI
- 6.4.15 Tempus Labs
- 6.4.16 Clarivate
- 6.4.17 Clinerion Ltd.
- 6.4.18 Veeva Systems
- 6.4.19 Verto Health
7. 市場機会と将来の見通し
*** 本調査レポートに関するお問い合わせ ***

リアルワールドエビデンスソリューションとは、日常の臨床診療や患者さんの生活環境から得られる多様なデータ、すなわちリアルワールドデータ(RWD)を収集、統合、分析し、そこから得られるエビデンス(リアルワールドエビデンス、RWE)を医薬品開発、規制当局への申請、市販後調査、医療経済評価、臨床意思決定など、様々な医療・ヘルスケア分野の意思決定に活用するサービス、ツール、プラットフォームです。従来のランダム化比較試験(RCT)が厳密な条件下で特定の効果を検証するのに対し、RWEはより広範な患者集団や実臨床の状況を反映したデータから得られるため、医薬品や医療技術の「実世界での効果」を評価する上で非常に重要です。このソリューションは、RWDの潜在的な価値を最大限に引き出し、医療の質向上と効率化に貢献することを目指しています。
リアルワールドエビデンスソリューションは、そのデータソースや提供形態によって多岐にわたります。データソースの観点からは、電子カルテ(EHR/EMR)データ、医療費請求データ(レセプトデータ)、疾患レジストリデータ、患者報告アウトカム(PRO)データ、ウェアラブルデバイスやIoT機器からの生体データ、ゲノムデータなど、様々なRWDを扱います。これらはそれぞれ異なる特性を持ち、目的に応じて最適なデータソースが選択されます。提供形態の観点からは、大規模RWDを統合・標準化し、分析・解析するためのプラットフォームやツールとして提供されるもの、特定の研究課題に対応したカスタムデータセットや分析レポートとして提供されるもの、さらには専門家によるコンサルティングサービスと組み合わせて提供されるものなど、多様なサービス形態が存在します。
これらのソリューションは、製薬企業、医療機器メーカー、アカデミア、規制当局、医療機関など、幅広いステークホルダーに価値を提供します。例えば、製薬企業は新薬開発における臨床試験デザインの最適化、市販後の安全性・有効性評価、リアルワールドでの薬剤効果の検証にRWEを活用できます。規制当局は、医薬品の承認審査や市販後安全対策において、より実臨床に近いエビデンスを評価することが可能になります。医療機関は、診療ガイドラインの策定や医療の質の向上、医療経済性の評価にRWEを用いることで、より根拠に基づいた意思決定を行うことができます。
RWEソリューションの導入には、データのプライバシー保護、データガバナンス、データの品質管理、そして適切な解析手法の選択といった課題も伴います。そのため、これらのソリューションは、高度なデータサイエンス技術、統計解析能力、そして医療・薬事規制に関する深い専門知識を組み合わせて提供されることが不可欠です。これにより、信頼性の高いRWEを生成し、医療・ヘルスケア分野における意思決定の質を向上させることが期待されます。