徐放性賦形剤市場 規模・シェア分析 – 成長トレンド・予測 (2025年~2030年)
徐放性賦形剤市場レポートは、業界を製品タイプ別(ゼラチン、ポリマー、ミネラル、糖類、その他の製品タイプ)、投与経路別(経口、筋肉内、皮下、経皮、静脈内、その他の投与経路)、技術別(標的送達、マイクロカプセル化、ウースター法、その他の技術)、および地域別(北米、欧州、アジア太平洋など)に分類しています。

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
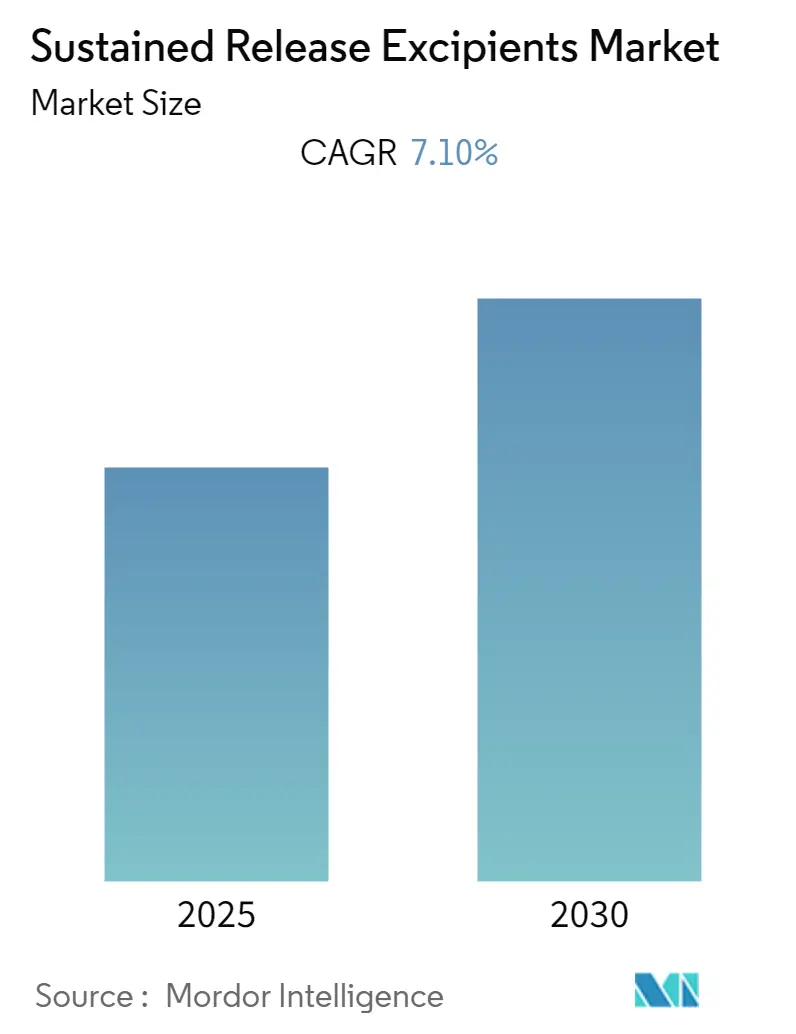
「徐放性賦形剤市場成長レポート2030」は、2025年から2030年までの期間における徐放性賦形剤市場の規模、シェア、成長トレンド、予測を詳細に分析しています。本レポートは、製品タイプ(ゼラチン、ポリマー、ミネラル、糖類、その他の製品タイプ)、投与経路(経口、筋肉内、皮下、経皮、静脈内、その他の投与経路)、技術(標的送達、マイクロカプセル化、ウースター法、その他の技術)、および地域(北米、欧州、アジア太平洋など)に基づいて市場をセグメント化しています。調査期間は2019年から2030年、推定基準年は2024年、予測期間は2025年から2030年です。この市場は予測期間中に年平均成長率(CAGR)7.10%を記録すると予想されており、アジア太平洋地域が最も急速に成長する市場であり、北米が最大の市場となっています。市場の集中度は低いとされています。
市場概要
徐放性賦形剤市場は、予測期間中に7.1%のCAGRで成長すると見込まれています。COVID-19パンデミックは当初、主要なAPI(原薬)およびジェネリック医薬品の供給元であるインドや中国からの輸出禁止による潜在的な不足により、市場に悪影響を及ぼしました。これにより、多くの国の政府はサプライチェーンの自給自足と、このような危機における不足を防ぐための規制を検討するようになりました。例えば、欧州委員会は2020年3月に、EUへの外国投資、特に医療市場に影響を与えるものについて、市民の健康需要を満たすEUの能力に悪影響を与えないようリスク評価の対象とすべきであるという新しいガイドラインを発表しました。COVID-19を取り巻く不確実性は、グローバルな医薬品サプライチェーンを維持することの課題を浮き彫りにしましたが、世界的に市場が再開されるにつれて、本市場は再び勢いを増しています。
市場成長の要因としては、主要市場プレーヤーによる製品発売の増加が挙げられます。例えば、2022年3月にはAthena Bioscience LLCが、高血圧治療薬として唯一の1日1回投与型クロニジン徐放性錠剤「Nexiclon XR」を発売しました。また、2022年7月にはDr. Reddy’s Laboratories Ltdが、米国FDAの承認を受けて、Toviaz(フェソテロジンフマル酸塩)のジェネリック治療等価品である「Dr. Reddy’s Fesoterodine Fumarate Extended-Release Tablets」を米国市場で発売しました。これらの取り組みは、予測期間中の市場成長を促進すると期待されています。
さらに、従来の剤形と比較して徐放性製剤が持つ利点も市場成長を後押ししています。医薬品マーケティング担当者にとって大きな課題の一つは、患者の服薬遵守です。1日に複数回投与が必要な薬剤の場合、患者の服薬受容性が著しく低下し、治療効果が不十分になるリスクがあります。このような場合、服薬受容性を高める標準的な解決策は、有効成分を長期間にわたって安定的に放出する剤形に医薬品を処方することです。徐放性プロファイルにより、最大24時間にわたって有効成分を調整された用量で放出することが可能になります。このような放出速度を達成する一般的な方法としては、フィルムコーティング、徐放性マトリックス、または徐放性薬物含有顆粒の使用があります。このような徐放性製剤は、製薬業界で大きな注目を集めており、既存および新規医薬品の患者体験を向上させる重要なツールであり続けると予想されます。また、企業や製剤開発者にとっては、市場の標準的な即時放出型製品と差別化を図る魅力的な機会でもあります。
主要市場トレンドと洞察
* 経口投与経路が世界の徐放性賦形剤市場で大きな市場シェアを占める
様々な薬物送達経路の中で、経口投与経路が最も好まれています。従来の剤形にはいくつかの限界がありましたが、徐放性および制御放出型薬物送達システムは、血漿中の薬物濃度を一定に保ち、薬物の放出速度を遅らせることで、作用持続時間を延長するのに役立ちます。これらの薬剤の利点に加え、継続的な開発と発売がこのセグメントの成長を促進しています。例えば、2020年6月にはノバルティスの一部門であるサンド(Sandoz)が、1日1回投与型のジェネリックタクロリムスカプセル「Dailiport」を英国および他の欧州諸国で発売しました。2022年1月には、医薬品特許プール(MPP)が27のジェネリック製造企業と、経口COVID-19抗ウイルス薬モルヌピラビルを製造し、105の低・中所得国に供給するための契約を締結したと発表しました。また、2022年2月には、Oakrum Pharma LLCがANI Pharmaceuticalsとの提携により、米国食品医薬品局(FDA)がCystadane1(ベタイン無水経口溶液)粉末180gボトルのジェネリック版の簡易新薬申請(ANDA)を承認し、180日間の競争的ジェネリック治療(CGT)独占権を付与したと発表しました。2021年10月には、メルク・アンド・カンパニーが国連が支援する医薬品特許プール(MPP)とライセンス契約を締結し、より多くの企業が同社の実験的経口抗ウイルスCOVID-19治療薬のジェネリック版を製造できるようにしました。これらの発売や提携は、ジェネリック経口製品の販売と製造を増加させ、セグメントの成長を促進すると予想されます。
* 北米が世界の徐放性賦形剤市場を支配
北米は予測期間中、徐放性賦形剤市場で主要なシェアを占めると予想されます。米国の徐放性賦形剤産業は、新しい活性医薬品成分の開発や新規薬物送達システムなどの新技術の採用に伴い、製薬産業の進歩とともに大きく発展すると見込まれています。例えば、米国疾病対策予防センター(2021年1月)によると、米国の成人10人中6人が慢性疾患を抱え、10人中4人が2つ以上の慢性疾患を抱えています。これらの疾患は、毎年約3.8兆米ドルの医療費を国の医療システムにもたらしています。この傾向に従い、革新的な多機能賦形剤や特殊ブレンドが予測期間中に市場に登場すると予想されます。
米国では、マクロレベルで、医薬品の世界的な需要の高まりが医薬品生産の成長を促進し、結果として賦形剤の消費を増加させています。例えば、2022年3月には、インドを拠点とするNatco Pharmaが、マーケティングパートナーであるイスラエルの製薬会社Teva Pharmaceutical Industriesの関連会社であるArrow Internationalと共に、Celgeneのトップセラーがん治療薬Revlimid(レナリドミドカプセル)の初のジェネリック版を米国市場で発売すると発表しました。2021年9月には、Apotex Inc.が、多発性骨髄腫および骨髄異形成症候群の治療薬であるRevlimidカプセルのジェネリック版であるAPO-レナリドミドをカナダで発売しました。このようなジェネリック製品の発売は、ジェネリック医薬品が比較的費用対効果が高いため、エンドユーザーに好まれ、市場の成長を促進します。
競争環境
世界の徐放性賦形剤市場は競争が激しく、いくつかの主要プレーヤーで構成されています。合併、買収、研究開発およびマーケティングのための提携、革新的な製品の開発は、競合他社が市場シェアを拡大するために採用している主要な戦略の一部です。Allergan PLC、AstraZeneca、GlaxoSmithKline PLC、Mayne Pharma Group Limited、Mylan NV、Novartis AG、Pfizer Inc.、Salix Pharmaceuticals、Sun Pharmaceutical Industries Ltdなどの企業が市場でかなりのシェアを占めています。
最近の業界動向
* 2022年9月:インドを拠点とするNutriventiaが、ストレス管理のための徐放性アシュワガンダ(Withania somnifera)「Prolanza」を発売しました。
* 2022年2月:Biohaven Pharmaceutical Holding Company LtdとPfizer Inc.が、CGRP受容体拮抗薬であるリメゲパント(経口溶解錠として利用可能な75mg用量)の販売承認について肯定的な意見を採択しました。
このレポートは、「持続放出性賦形剤市場」に関する包括的な分析を提供しています。持続放出性賦形剤とは、医薬品の有効成分(API)と共に配合される、薬理学的に不活性な成分を指します。これらは、薬物が体内で一定期間にわたって安定的に放出されるよう制御する役割を担っており、リポソームや薬物ポリマー複合体(例えばハイドロゲル)といった多様な製剤技術を通じて実現されます。本レポートでは、これらの賦形剤が医薬品開発において果たす重要な役割と、それを取り巻く市場の動向を詳細に調査しています。
市場の概要と主要な動向:
持続放出性賦形剤市場は、予測期間である2025年から2030年にかけて、年平均成長率(CAGR)7.1%という堅調な成長を遂げると予測されています。
市場の成長を牽引する主な要因としては、従来の剤形と比較して、患者の服薬遵守率の向上や副作用の軽減など、持続放出製剤がもたらす多大な利点が挙げられます。また、世界的な抗生物質耐性の問題が深刻化する中で、効果的な薬物送達システムの需要が高まっていることも、市場拡大の重要な推進力となっています。
一方で、市場の成長を抑制する要因も存在します。例えば、ドーズダンピング(薬物が意図せず急速に放出される現象)による薬物毒性のリスクや、有効成分(API)を高用量で配合する必要がある場合の技術的課題が挙げられます。
さらに、本レポートではポーターのファイブフォース分析を用いて、新規参入企業の脅威、買い手および消費者の交渉力、供給者の交渉力、代替製品の脅威、そして業界内の競争の激しさといった多角的な視点から、市場の競争環境を深く掘り下げて分析しています。
詳細な市場セグメンテーション:
持続放出性賦形剤市場は、以下の主要なセグメントに細分化されており、それぞれの市場規模が米ドル(USD)で評価されています。
1. 製品タイプ別: ゼラチン、ポリマー、ミネラル、糖類、およびその他の製品タイプが含まれます。これらの素材は、放出特性や製剤の安定性に影響を与えるため、重要な分類基準となっています。
2. 投与経路別: 経口、筋肉内、皮下、経皮、静脈内、およびその他の投与経路に分けられます。各経路に適した賦形剤の選択が、薬物の効果的な送達に不可欠です。
3. 技術別: 標的送達、マイクロカプセル化、ウースター法、およびその他の技術が分析対象です。これらの技術は、薬物の放出速度や部位を精密に制御するために用いられます。
4. 地域別: 北米(米国、カナダ、メキシコ)、欧州(ドイツ、英国、フランス、イタリア、スペイン、その他欧州)、アジア太平洋(中国、日本、インド、オーストラリア、韓国、その他アジア太平洋)、中東・アフリカ(GCC、南アフリカ、その他中東・アフリカ)、南米(ブラジル、アルゼンチン、その他南米)といった主要地域に加え、合計17カ国の詳細な市場規模とトレンドが網羅されており、地域ごとの特性が明らかにされています。
地理的インサイトと主要プレーヤー:
地域別の分析では、2025年において北米が持続放出性賦形剤市場で最大の市場シェアを占めると予測されています。これは、先進的な医療インフラと研究開発への投資が活発であることに起因すると考えられます。一方、アジア太平洋地域は、予測期間(2025年から2030年)において最も高い年平均成長率(CAGR)で成長する地域と見込まれており、新興市場の拡大と医療アクセスの改善がその背景にあります。
市場における主要なプレーヤーとしては、Mylan N.V.、Pfizer Inc.、Sun Pharmaceutical Industries Ltd.、Salix Pharmaceuticals、Novartis AGなどが挙げられます。これらの企業のプロファイルもレポートに詳細に記載されており、市場の競争状況を理解する上で重要な情報を提供しています。
市場の機会と将来のトレンド:
本レポートでは、持続放出性賦形剤市場における新たなビジネス機会や、今後の技術革新、規制動向などの将来のトレンドについても深く考察しています。これにより、市場参加者は戦略的な意思決定を行うための洞察を得ることができます。
このレポートは、2019年から2024年までの過去の市場規模データと、2025年から2030年までの市場規模予測を提供することで、持続放出性賦形剤市場の現状と将来の展望を包括的に把握するための貴重な情報源となっています。
1. はじめに
- 1.1 調査の前提条件と市場の定義
- 1.2 調査範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場の動向
- 4.1 市場概要
-
4.2 市場の推進要因
- 4.2.1 従来の剤形に対する利点の増加
- 4.2.2 抗生物質耐性
-
4.3 市場の阻害要因
- 4.3.1 用量ダンピングによる薬物毒性
- 4.3.2 高用量のAPIの必要性
-
4.4 ポーターの5つの力分析
- 4.4.1 新規参入者の脅威
- 4.4.2 買い手/消費者の交渉力
- 4.4.3 供給者の交渉力
- 4.4.4 代替品の脅威
- 4.4.5 競争の激しさ
5. 市場セグメンテーション (金額別市場規模 – USD百万)
-
5.1 製品タイプ別
- 5.1.1 ゼラチン
- 5.1.2 ポリマー
- 5.1.3 ミネラル
- 5.1.4 糖類
- 5.1.5 その他の製品タイプ
-
5.2 投与経路別
- 5.2.1 経口
- 5.2.2 筋肉内
- 5.2.3 皮下
- 5.2.4 経皮
- 5.2.5 静脈内
- 5.2.6 その他の投与経路
-
5.3 技術別
- 5.3.1 標的送達
- 5.3.2 マイクロカプセル化
- 5.3.3 ウースター法
- 5.3.4 その他の技術
-
5.4 地域別
- 5.4.1 北米
- 5.4.1.1 米国
- 5.4.1.2 カナダ
- 5.4.1.3 メキシコ
- 5.4.2 ヨーロッパ
- 5.4.2.1 ドイツ
- 5.4.2.2 イギリス
- 5.4.2.3 フランス
- 5.4.2.4 イタリア
- 5.4.2.5 スペイン
- 5.4.2.6 その他のヨーロッパ
- 5.4.3 アジア太平洋
- 5.4.3.1 中国
- 5.4.3.2 日本
- 5.4.3.3 インド
- 5.4.3.4 オーストラリア
- 5.4.3.5 韓国
- 5.4.3.6 その他のアジア太平洋
- 5.4.4 中東およびアフリカ
- 5.4.4.1 GCC
- 5.4.4.2 南アフリカ
- 5.4.4.3 その他の中東およびアフリカ
- 5.4.5 南米
- 5.4.5.1 ブラジル
- 5.4.5.2 アルゼンチン
- 5.4.5.3 その他の南米
6. 競争環境
-
6.1 企業プロフィール
- 6.1.1 アラガンPLC
- 6.1.2 アストラゼネカ
- 6.1.3 グラクソ・スミスクラインPLC
- 6.1.4 メインファーマグループリミテッド
- 6.1.5 マイランNV
- 6.1.6 ノバルティスAG
- 6.1.7 ファイザー株式会社
- 6.1.8 サリックス・ファーマシューティカルズ
- 6.1.9 サン・ファーマシューティカル・インダストリーズ株式会社
- *リストは網羅的ではありません
7. 市場機会と将来のトレンド
*** 本調査レポートに関するお問い合わせ ***

徐放性賦形剤は、医薬品の有効成分が体内で一定期間にわたって徐々に放出されるように設計された製剤において、その放出速度を制御する目的で使用される添加剤の総称でございます。従来の即放性製剤が服用後速やかに薬物を放出するのに対し、徐放性製剤は薬物の血中濃度を長時間にわたり治療域内で安定的に維持することを可能にします。これにより、薬効の持続、副作用の軽減、そして患者様の服薬コンプライアンスの向上といった多岐にわたるメリットが期待されます。
徐放性賦形剤の主な種類は、その薬物放出メカニズムによって大きく分類されます。一つ目は「マトリックス型」で、薬物が賦形剤中に均一に分散または溶解しており、賦形剤の膨潤、ゲル化、浸食、あるいは不溶性骨格からの拡散によって薬物が放出されます。親水性高分子(ヒドロキシプロピルメチルセルロース(HPMC)、カルボキシメチルセルロースナトリウム(CMC-Na)、カルボポールなど)を用いたゲルマトリックス型では、水分を吸収してゲル層を形成し、そのゲル層を介した薬物の拡散が放出を制御します。一方、不溶性高分子(エチルセルロース、アクリル酸エステル共重合体など)やワックス類(カルナウバロウ、ステアリルアルコールなど)を用いた不溶性骨格型では、賦形剤が消化管内で崩壊せず、形成された細孔やチャネルを通じて薬物が徐々に溶出します。
二つ目は「コーティング型」で、薬物を含有する核錠や顆粒の表面を、放出制御能を持つ高分子膜で被覆するものです。この高分子膜の厚さや組成、透過性によって薬物の放出速度が調整されます。水不溶性高分子(エチルセルロース、アクリル酸エステル共重合体など)が一般的に用いられ、膜の孔径や膜厚を制御することで、放出プロファイルを精密に設計できます。また、pH依存性高分子(例えば、Eudragit LやSシリーズ)を使用することで、胃では溶けずに腸で溶ける「腸溶性製剤」や、さらに下部の結腸で薬物を放出する「結腸送達製剤」など、特定の消化管部位での放出を可能にする製剤も開発されています。
三つ目は「浸透圧ポンプ型」で、半透膜で覆われた製剤内部に薬物と浸透圧活性物質を封入し、外部からの水分が半透膜を透過して内部の浸透圧を高めることで、製剤に設けられた放出孔から薬物を押し出すメカニズムです。この方式は、薬物の放出速度が消化管内の環境に左右されにくく、非常に安定したゼロ次放出(一定速度での放出)を実現できるという特徴があります。
四つ目は「イオン交換樹脂型」で、薬物がイオン交換樹脂と結合し、消化管内のイオン強度やpHの変化に応じて薬物が樹脂から解離・放出されるものです。その他にも、薬物を微小な粒子に封入する「マイクロスフェア」や「マイクロカプセル」、脂質二重層で薬物を包み込む「リポソーム」、あるいは体内に埋め込む「インプラント型製剤」など、様々な徐放性賦形剤や製剤技術が開発されています。
徐放性賦形剤の用途は非常に広範です。慢性疾患の治療薬、例えば高血圧症治療薬、糖尿病治療薬、喘息治療薬などでは、一日一回または二回程度の服用で安定した薬効を長時間維持できるため、患者様の負担を軽減し、治療効果の向上に寄与します。また、血中濃度が急激に上昇することによる副作用(例えば、非ステロイド性抗炎症薬(NSAIDs)による胃腸障害や、一部の抗がん剤の毒性)を抑制する目的でも利用されます。さらに、薬物の安定性が低い場合、胃酸からの保護や特定の消化管部位への送達を可能にすることで、薬物の有効性を高めることもできます。
関連技術としては、まず製剤技術が挙げられます。徐放性製剤の製造には、直接打錠法、湿式造粒法、乾式造粒法といった一般的な錠剤製造技術に加え、コーティング技術(パンコーティング、流動層コーティングなど)、押出成形、射出成形といった特殊な技術が用いられます。これらの技術を駆使して、賦形剤と薬物の最適な組み合わせや構造を設計します。また、製剤の品質を評価するためには、日本薬局方で定められた溶出試験法が不可欠であり、in vitro(試験管内)での溶出挙動とin vivo(生体内)での薬物動態との相関(IVIVC: In Vitro-In Vivo Correlation)を評価する技術も重要です。これらは、薬物送達システム(DDS: Drug Delivery System)の一環として、薬物の効果を最大限に引き出すための重要な要素となっています。
市場背景としては、世界的な高齢化社会の進展に伴い、慢性疾患患者が増加していることが挙げられます。これにより、長期にわたる服薬が必要な患者様の服薬アドヒアランス(服薬遵守)の向上が喫緊の課題となっており、服用回数を減らせる徐放性製剤の需要が高まっています。また、新薬開発の難易度が上昇する中で、既存薬に徐放性という付加価値を与えることで、製品のライフサイクルを延長し、市場競争力を維持・強化する戦略(ライフサイクルマネジメント)としても注目されています。ジェネリック医薬品市場においても、徐放性ジェネリック医薬品の開発・承認が増加しており、患者様の選択肢を広げています。患者中心の医療が推進される中で、QOL(生活の質)向上に貢献する徐放性製剤の役割はますます重要になっています。
将来展望としては、個別化医療への対応が期待されます。患者様の病態や遺伝的背景に応じて、薬物の放出プロファイルをより精密に制御できる徐放性製剤の開発が進むでしょう。また、外部からの刺激(pH、温度、光、超音波、酵素など)に応答して薬物を放出する「スマートドラッグデリバリーシステム」の研究も活発に行われています。これにより、必要な時に必要な量の薬物を放出するといった、より高度な薬物制御が可能になります。バイオ医薬品(ペプチド、タンパク質、核酸医薬など)は、生体内での安定性が低く、分解されやすいという課題がありますが、徐放性賦形剤との組み合わせにより、その安定性を向上させ、効果的な送達を実現する研究も進められています。さらに、3Dプリンティング技術の進展は、複雑な内部構造を持つ徐放性製剤の製造を可能にし、個々の患者に合わせたオーダーメイド製剤の実現に貢献すると期待されています。ナノテクノロジーとの融合により、ナノ粒子やナノカプセルを用いた、より精密な薬物放出制御も可能になるでしょう。デジタルヘルス技術との連携により、服薬状況のモニタリングと連動した製剤設計や、患者様の状態に応じた放出調整が可能な製剤の開発も視野に入っています。これらの技術革新により、徐放性賦形剤は、医薬品の有効性、安全性、利便性をさらに高め、未来の医療に不可欠な存在として進化し続けることでしょう。