T細胞急性リンパ性白血病治療市場 規模・シェア分析 – 成長トレンドと予測 (2025-2030年)
グローバルT細胞急性リンパ性白血病治療市場は、治療法(化学療法、放射線療法、幹細胞移植、その他)、エンドユーザー(病院、がん・放射線治療センター、その他)、および地域(北米、欧州、アジア太平洋、中東・アフリカ、南米)によってセグメント化されています。本レポートは、上記セグメントの市場規模を(百万米ドル単位で)提供します。

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
T細胞急性リンパ性白血病治療市場の概要
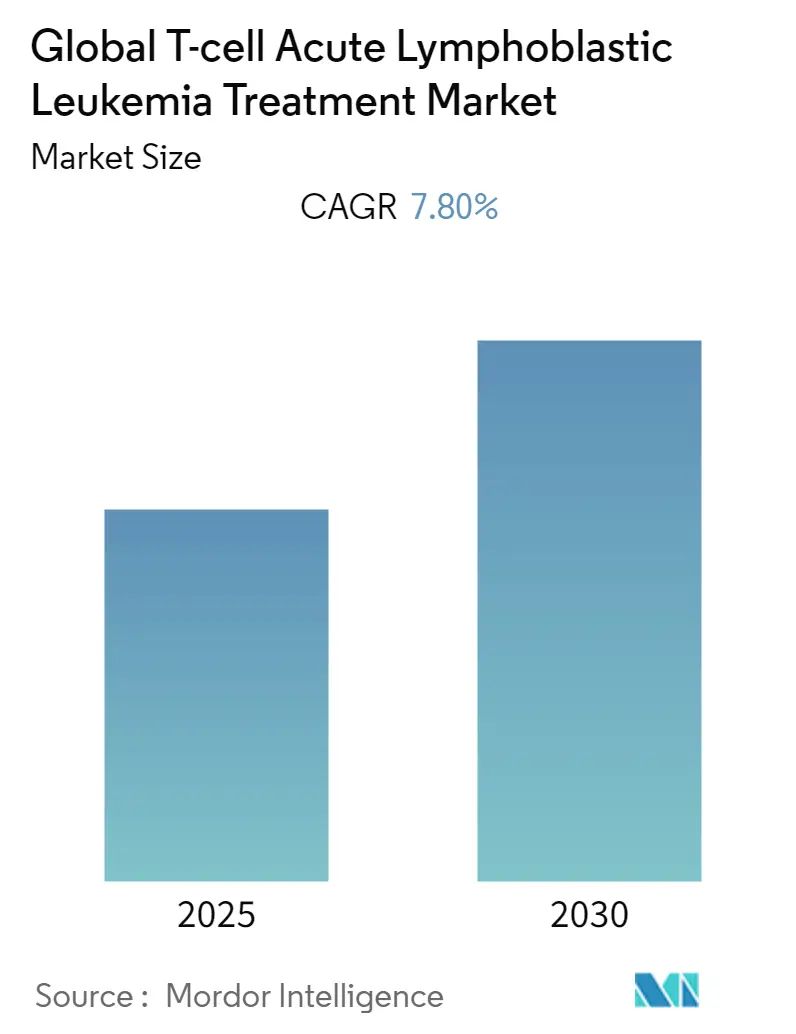
「T細胞急性リンパ性白血病治療市場」は、予測期間(2025年~2030年)において年平均成長率(CAGR)7.8%を記録すると予測されています。
市場のセグメンテーションと主要指標
この市場は、治療タイプ(化学療法、放射線療法、幹細胞移植、その他)、エンドユーザー(病院、がん・放射線治療センター、その他)、および地域(北米、ヨーロッパ、アジア太平洋、中東・アフリカ、南米)によってセグメント化されています。市場集中度は低いと評価されており、最も成長が速い市場は北米、最大の市場はアジア太平洋地域です。
COVID-19パンデミックの影響
新型コロナウイルス感染症(COVID-19)のパンデミックは、この市場に大きな影響を与えました。化学療法などの癌治療は患者の免疫システムを損なうため、T細胞急性リンパ性白血病(T-ALL)患者はCOVID-19感染のリスクが高まりました。2021年10月に発表された記事によると、急性リンパ性白血病の成人患者におけるCOVID-19感染の頻度と死亡率は高く、これによりT-ALL治療薬や治療法の需要が高まり、市場の成長を後押ししたと考えられます。
市場成長の推進要因
市場成長を牽引する主な要因は、T細胞急性リンパ性白血病の罹患率の増加と、癌治療薬に対する研究開発費の増加です。
例えば、2021年8月の記事によれば、T-ALLは成人ALL症例の25%、小児ALL症例の15%を占めています。この高い罹患率が市場成長を促進すると予想されます。
また、2021年10月の記事では、再発・難治性T細胞急性リンパ性白血病(r/r T-ALL)患者20名に対し、ドナー由来の抗CD7 CAR T細胞を単回注入した臨床試験において、CD7 CAR T細胞が効果的な増殖を示し、管理可能な安全性プロファイルで高い完全寛解率を達成したことが報告されています。このように、T-ALL患者の治療薬の有効性を評価する臨床研究の増加は、治療薬の利用可能性を高め、市場成長を促進すると期待されています。
市場成長の阻害要因
一方で、医薬品開発における厳格な規制シナリオと、治療に関連する高コストが、予測期間中の市場成長を阻害する可能性があります。
主要な市場トレンド:化学療法セグメント
治療タイプ別では、化学療法セグメントが予測期間中にT細胞急性リンパ性白血病治療市場において顕著な成長を遂げると予想されています。これは、T細胞リンパ性白血病の罹患率の上昇と、治療における化学療法薬の使用増加によるものです。
2021年5月の記事によると、新たに診断されたT-ALL患者は現在、集中的な化学療法で治療されており、場合によっては頭蓋放射線療法(CRT)が補完的に用いられています。さらに、2020年8月の記事では、新たに診断されたT-ALLの小児および若年成人において、強化されたベルリン・フランクフルト・ミュンスター(ABFM)療法にネララビンを追加することで、毒性を増加させることなく無病生存率(DFS)が向上したことが示されています。これらの要因が、予測期間中の市場成長に良い影響を与えると見られています。
地域別分析:北米市場の優位性
地域別では、北米が予測期間中に成長を遂げ、市場を牽引すると予想されています。特に米国は、高い医療費支出、活発な研究開発活動、T細胞急性リンパ性白血病の罹患率上昇により、この地域の市場をリードしています。
例えば、米国癌協会の2022年の統計によると、2022年には米国で約6,660件の新たなALL症例が診断され、約1,560件のALLによる死亡が報告されると予測されています。ALL症例の増加は、T細胞急性リンパ性白血病を発症するリスクを高め、結果としてT-ALL患者向けの安全で効果的な治療薬や治療法の需要を増加させると考えられます。
また、経済協力開発機構(OECD)によると、2021年の米国の医療費支出はGDPの17.8%を占め、メキシコは2020年にGDPの6.2%でした。メディケア・メディケイドサービスセンターによると、米国の国民医療費は2019年から2028年にかけて年平均5.4%で成長し、2028年には6.2兆米ドルに達すると予測されています。国民医療費がGDPよりも速いペースで成長するため、経済に占める医療費の割合は2028年には19.7%に上昇すると見込まれています。これらの要因が、北米市場の成長を大きく後押しすると考えられます。
競争環境と主要プレーヤー
現在、多くの民間企業が新規治療法の開発と導入に注力しています。また、ほとんどの市場参加者、政府機関、学術研究機関によって広範な研究開発活動が開始されています。
主要な市場プレーヤーには、Bristol Myer Squibb Company、Genmab A/S、Novartis AG、Pfizer Inc.、Kyowa Kirin Co., Ltd.などが挙げられます。
最近の業界動向
最近の業界動向としては、以下の点が注目されます。
* 2017年:スペイン国立がん研究センター(CNIO)の研究者らが、小児の最も一般的な癌の一つであるT細胞急性リンパ性白血病の少なくとも10%の症例に直接関与する、Capicuaという特定の遺伝子の不活性化という遺伝子変異を発見しました。
* 2022年7月:欧州医薬品庁(EMA)の医薬品委員会(CHMP)は、再発・難治性(r/r)B細胞前駆体急性リンパ性白血病(ALL)の26歳以上の成人患者の治療薬として、Kite社のTecartus(ブレクスカブタゲン・オートロイセル)に対し肯定的な意見を表明しました。
* 2021年10月:米国食品医薬品局(FDA)は、治療に反応しない(難治性)または治療後に再発した(再発性)B細胞前駆体ALLの成人向けに、CAR T細胞療法ブレクスカブタゲン・オートロイセル(Tecartus)の使用を承認しました。これにより、ブレクスカブタゲンは成人ALL向けに承認された初のCAR T細胞療法となりました。
本レポートは、T細胞急性リンパ性白血病(T-ALL)治療市場に関する包括的な分析を提供しています。T-ALLは、急性リンパ性白血病(ALL)の特定のタイプであり、一部のリンパ腫と類似した特徴を持つことが定義されています。この疾患は、リンパ球を産生する幹細胞、特にTリンパ球と呼ばれる白血球の一種に影響を及ぼします。一般的なALLがBリンパ球に影響を与えるのに対し、T-ALLはTリンパ球に特異的である点が特徴です。
市場の概要と予測
世界のT細胞急性リンパ性白血病治療市場は、予測期間である2025年から2030年にかけて、年平均成長率(CAGR)7.8%で着実に成長すると予測されています。本レポートでは、2019年から2024年までの過去の市場規模データに加え、2025年から2030年までの詳細な市場規模予測が提供されており、市場の動向を深く理解するための基盤となります。
市場のダイナミクス
市場の成長を推進する主要な要因としては、T細胞急性リンパ性白血病の罹患率の増加が挙げられます。これは、診断技術の進歩や人口高齢化なども背景にあると考えられます。また、がん治療薬に対する研究開発費の継続的な拡大も、新たな治療法の開発と市場投入を促進し、市場成長の重要なドライバーとなっています。
一方で、市場の成長を抑制する要因も存在します。医薬品の承認プロセスにおける厳格な規制シナリオは、新薬の市場投入に時間とコストを要するため、市場拡大の障壁となる可能性があります。さらに、T-ALL治療に伴う高額な費用も、患者や医療システムにとって大きな負担となり、市場の成長を制限する要因として指摘されています。
本レポートでは、ポーターのファイブフォース分析(新規参入の脅威、買い手/消費者の交渉力、供給者の交渉力、代替品の脅威、競争の激しさ)を通じて、市場の競争環境と構造が詳細に評価されており、市場参加者にとって戦略的な洞察を提供しています。
市場のセグメンテーション
T細胞急性リンパ性白血病治療市場は、複数の重要なセグメントに分類され、それぞれの市場規模が米ドル(USD)で提供されています。
1. 治療タイプ別: 化学療法、放射線療法、幹細胞移植、その他。
2. エンドユーザー別: 病院、がん・放射線治療センター、その他。
3. 地域別: 北米(米国、カナダ、メキシコ)、ヨーロッパ(ドイツ、英国、フランス、イタリア、スペイン、その他ヨーロッパ)、アジア太平洋(中国、日本、インド、オーストラリア、韓国、その他アジア太平洋)、中東・アフリカ(GCC諸国、南アフリカ、その他中東・アフリカ)、南米(ブラジル、アルゼンチン、その他南米)。
本レポートでは、これらの主要地域にわたる17カ国の市場規模とトレンドが詳細に推定されており、地域ごとの特性と成長機会が分析されています。
競争環境
市場における主要なプレーヤーとしては、Bristol Myer Squibb Company、Gilead Sciences (Kite Pharma)、Kyowa Kirin Co., Ltd.、Erytech Pharma、F. Hoffmann-La Roche Ltd、Genmab AS、GlaxoSmithKline、Novartis AG、Pfizer Inc.、Spectrum Pharmaceuticalsなどが挙げられます。これらの企業は、T-ALL治療薬の研究開発、製造、販売において重要な役割を担っています。競争環境のセクションでは、各企業の事業概要、財務状況、主要製品と戦略、および最近の事業展開が詳細に分析されており、市場における各社のポジショニングと競争優位性が評価されています。
主要な調査結果とハイライト
地域別の分析では、北米地域が予測期間(2025年から2030年)において最も高い年平均成長率(CAGR)で成長すると推定されています。これは、同地域における高度な医療技術、充実した研究開発活動、およびT-ALLに対する意識の高さが背景にあると考えられます。一方、2025年時点では、アジア太平洋地域が世界のT細胞急性リンパ性白血病治療市場において最大の市場シェアを占めると予測されており、その広大な人口と医療市場の拡大が寄与していると見られます。
レポートの範囲と調査方法
本レポートは、研究の仮定と市場定義、調査範囲、詳細な調査方法論、エグゼクティブサマリー、市場の機会と将来のトレンドなど、多岐にわたる内容を網羅しています。これにより、読者はT細胞急性リンパ性白血病治療市場に関する深い洞察と、将来の戦略策定に役立つ情報を得ることができます。最終更新日は2025年5月8日です。
1. はじめに
- 1.1 調査の前提条件と市場の定義
- 1.2 調査範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場の動向
- 4.1 市場概要
- 4.2 市場の推進要因
- 4.2.1 T細胞急性リンパ性白血病市場の有病率の増加
- 4.2.2 がん治療薬の研究開発費の増加
- 4.3 市場の阻害要因
- 4.3.1 医薬品承認に関する厳格な規制状況
- 4.3.2 治療に伴う高コスト
- 4.4 ポーターの5つの力分析
- 4.4.1 新規参入者の脅威
- 4.4.2 買い手/消費者の交渉力
- 4.4.3 供給者の交渉力
- 4.4.4 代替品の脅威
- 4.4.5 競争の激しさ
5. 市場セグメンテーション(金額別市場規模 – 100万米ドル)
- 5.1 治療の種類別
- 5.1.1 化学療法
- 5.1.2 放射線療法
- 5.1.3 幹細胞移植
- 5.1.4 その他
- 5.2 エンドユーザー別
- 5.2.1 病院
- 5.2.2 がん・放射線治療センター
- 5.2.3 その他
- 5.3 地域別
- 5.3.1 北米
- 5.3.1.1 米国
- 5.3.1.2 カナダ
- 5.3.1.3 メキシコ
- 5.3.2 欧州
- 5.3.2.1 ドイツ
- 5.3.2.2 英国
- 5.3.2.3 フランス
- 5.3.2.4 イタリア
- 5.3.2.5 スペイン
- 5.3.2.6 その他の欧州
- 5.3.3 アジア太平洋
- 5.3.3.1 中国
- 5.3.3.2 日本
- 5.3.3.3 インド
- 5.3.3.4 オーストラリア
- 5.3.3.5 韓国
- 5.3.3.6 その他のアジア太平洋
- 5.3.4 中東・アフリカ
- 5.3.4.1 GCC
- 5.3.4.2 南アフリカ
- 5.3.4.3 その他の中東・アフリカ
- 5.3.5 南米
- 5.3.5.1 ブラジル
- 5.3.5.2 アルゼンチン
- 5.3.5.3 その他の南米
6. 競争環境
- 6.1 企業プロファイル
- 6.1.1 Bristol Myer Squibb Company
- 6.1.2 Gilead Sciences (Kite Pharma)
- 6.1.3 Kyowa Kirin Co., Ltd.
- 6.1.4 Erytech Pharma
- 6.1.5 F. Hoffmann-La Roche Ltd
- 6.1.6 Genmab AS
- 6.1.7 GlaxoSmithKline
- 6.1.8 Novartis AG
- 6.1.9 Pfizer Inc.
- 6.1.10 Spectrum Pharmaceuticals
- *リストは網羅的ではありません
7. 市場機会と将来のトレンド
*** 本調査レポートに関するお問い合わせ ***

T細胞急性リンパ性白血病(T-ALL)治療は、造血器腫瘍の中でも特に進行が速く、複雑な病態を示す疾患に対する医療介入を指します。T-ALLは、骨髄中の未熟なTリンパ球(Tリンパ芽球)が異常に増殖し、正常な血液細胞の産生を妨げる悪性腫瘍です。小児の急性リンパ性白血病の約15%、成人の約25%を占めるとされており、B細胞性ALLと比較して予後が不良なケースも少なくありません。胸腺やリンパ節への浸潤、中枢神経系への転移リスクが高いことも特徴であり、これらの特性を踏まえた集学的治療が不可欠となります。治療の目標は、白血病細胞を完全に排除し、長期的な寛解を達成することにあります。
T細胞急性リンパ性白血病の治療は、主に多剤併用化学療法が中心となります。これは、寛解導入療法、地固め療法、維持療法という段階を経て行われます。寛解導入療法では、ステロイド、ビンクリスチン、L-アスパラギナーゼ、アントラサイクリン系薬剤などを組み合わせ、迅速に白血病細胞を減少させ、骨髄中の芽球割合を5%未満にすることを目指します。地固め療法では、高用量のメトトレキサートやシタラビンなどを用いて、残存する白血病細胞を徹底的に排除し、再発を防ぎます。維持療法では、経口の化学療法薬を数年間にわたり継続し、微小残存病変(MRD)の増殖を抑制します。また、T-ALLは中枢神経系への浸潤リスクが高いため、治療の初期段階から髄腔内への抗がん剤投与や頭蓋放射線照射などによる中枢神経系予防・治療が重要視されます。高リスク群や再発・難治例に対しては、同種造血幹細胞移植が有効な治療選択肢として考慮されます。これは、患者さんの病態やドナーの適合性に基づいて慎重に判断されます。
近年では、T-ALLの病態解明が進み、分子標的薬や免疫療法といった新たな治療アプローチの開発が進められています。T-ALLではNOTCH1遺伝子変異が高頻度に見られることが知られており、この経路を標的とする薬剤の開発が期待されています。また、JAK/STAT経路やPI3K/AKT/mTOR経路の異常も報告されており、これらの経路を阻害する薬剤(例:JAK阻害剤ルキソリチニブ、BCL-2阻害剤ベネトクラクスなど)が、特定の遺伝子変異を持つ患者さんに対して有効性を示す可能性が示唆されています。免疫療法としては、CAR-T細胞療法が注目されています。B細胞性ALLではCD19を標的としたCAR-T細胞療法が成功を収めていますが、T-ALLではT細胞自身が標的となるため、正常T細胞の枯渇(T細胞低形成)という課題があります。この課題を克服するため、CD7などのT細胞特異的抗原を標的としつつ、CAR-T細胞自身が標的抗原を発現しないように遺伝子改変を行うなどの工夫が凝らされたCAR-T細胞療法の開発が進められています。さらに、二重特異性抗体や免疫チェックポイント阻害剤なども、T-ALL治療への応用が模索されています。
関連技術としては、まず正確な診断と病態把握のための技術が挙げられます。フローサイトメトリーによる免疫表現型解析は、T-ALLの診断と分類に不可欠です。次世代シーケンサー(NGS)を用いた遺伝子解析は、NOTCH1、JAK1/2、PTEN、FBXW7、RAS経路などの遺伝子変異を特定し、治療戦略の個別化に貢献します。また、治療効果の評価と再発予測において、微小残存病変(MRD)の検出技術が極めて重要です。フローサイトメトリーやPCR法を用いたMRD測定は、治療の強度を調整したり、造血幹細胞移植の適応を判断したりする上で重要な指標となります。これらの診断・モニタリング技術の進歩が、T-ALL治療成績の向上に大きく寄与しています。治療を支える支持療法も重要であり、感染症予防・治療、輸血療法、栄養管理、副作用管理などが含まれます。
T細胞急性リンパ性白血病は比較的稀な疾患であり、その治療薬市場はアンメットメディカルニーズが高い分野とされています。既存の多剤併用化学療法は一定の効果を示すものの、強力な副作用を伴い、特に再発・難治例に対する有効な治療選択肢が限られていることが課題です。このため、製薬企業やバイオベンチャー、アカデミアが連携し、新たな分子標的薬や免疫療法の開発に注力しています。小児と成人ではT-ALLの生物学的特性や治療プロトコル、予後が異なる場合があり、それぞれの年齢層に特化した治療法の開発も進められています。新規治療薬の登場は患者さんにとって大きな希望となる一方で、高額な薬剤費が医療経済に与える影響も考慮すべき重要な側面です。国際的な共同研究も活発に行われ、より良い治療法の確立を目指しています。
将来展望として、T細胞急性リンパ性白血病治療は、個別化医療のさらなる進展が期待されます。患者さん一人ひとりの遺伝子プロファイリングに基づき、最適な分子標的薬や免疫療法を選択する時代が到来するでしょう。NOTCH1阻害剤やJAK阻害剤、BCL-2阻害剤などの新規分子標的薬の臨床応用が進み、多剤併用化学療法との組み合わせによる相乗効果の追求も重要な研究課題です。CAR-T細胞療法においては、T細胞低形成のリスクを克服するための技術革新が進み、T-ALLに対する有効性と安全性が確立されることが期待されます。また、微小残存病変(MRD)に基づいた治療強度の調整(de-escalation/escalation)がより精密に行われることで、治療成績の向上と副作用の軽減が両立される可能性があります。患者さんのQOL(生活の質)向上も重要な目標であり、副作用の少ない効果的な治療法の開発が継続的に求められています。国際的な協力体制のもと、基礎研究から臨床応用までの一連の研究が加速し、T-ALL患者さんの予後が飛躍的に改善される未来が展望されます。