組織切片作製市場規模・シェア分析 – 成長動向と予測(2025年~2030年)
組織切片作製市場レポートは、製品(機器、付属品および消耗品)、技術(自動、半自動、手動)、エンドユーザー(学術・研究機関など)、用途(疾患診断、橋渡し研究および前臨床研究)、および地域(北米、欧州、アジア太平洋、中東・アフリカ、南米)別に分類されます。市場予測は、金額(米ドル)で提供されます。

※本ページの内容は、英文レポートの概要および目次を日本語に自動翻訳したものです。最終レポートの内容と異なる場合があります。英文レポートの詳細および購入方法につきましては、お問い合わせください。
*** 本調査レポートに関するお問い合わせ ***
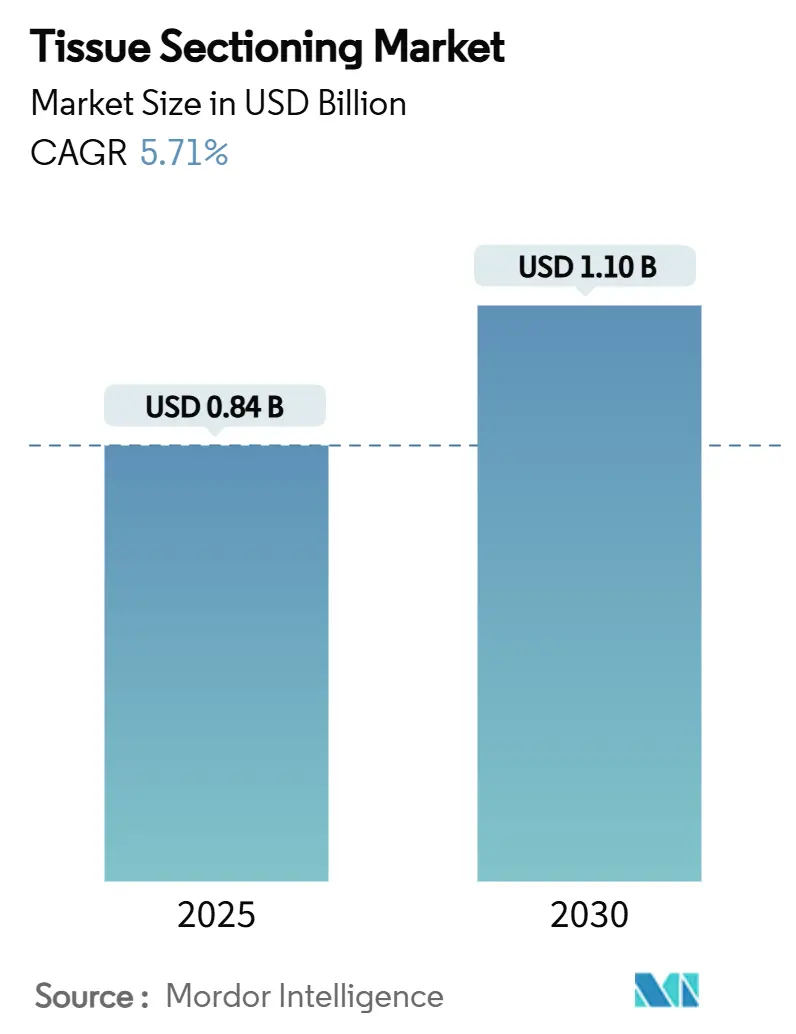
組織切片作成市場は、2025年から2030年の予測期間において、年平均成長率(CAGR)5.71%で成長し、2025年の8億4,000万米ドルから2030年には11億米ドルに拡大すると予測されています。この市場の堅調な成長は、主に腫瘍学におけるハイスループットでAI対応の組織学への移行、自動ミクロトミーの普及拡大、デジタル病理学の採用を加速させる規制の明確化によって牽引されています。
がんの発生率の増加は、市場の主要な推進力の一つです。2022年には約2,000万件の新規がん症例が報告され、2050年までに3,500万件に達すると予測されており、これによりスライド処理量の要件が大幅に増加し、自動切片作成プラットフォームへの長期的な設備投資が促進されています。また、2024年には組織技術者の欠員率が8.37%に達するなど、労働力不足も市場成長の構造的な要因となっており、検査室はロボット工学、予測保守、および「ダークラボ」コンセプトへと移行し、運用コストの削減と品質向上を目指しています。精密医療やコンパニオン診断が主流となる中で、空間生物学やAI分析を直接切片作成ハードウェアに統合できるベンダーは、競争優位性を確立しています。
地域別に見ると、北米は、高度な医療インフラ、主要企業の存在、およびデジタル病理学の早期導入により、市場で最も大きなシェアを占めています。欧州もまた、がん研究への投資増加と医療技術の進歩により、堅調な成長が期待されています。アジア太平洋地域は、医療費の増加、医療インフラの改善、およびデジタル病理学ソリューションへの関心の高まりにより、最も急速に成長する市場となるでしょう。特に中国やインドなどの新興国では、膨大な人口と医療アクセスの改善が市場拡大を後押ししています。
本レポートは、生物学的組織から薄い切片を作成し、顕微鏡検査を通じて組織構造、組成、病理を細胞レベルで分析する「組織切片作成市場」に関する詳細な分析を提供しています。このプロセスは、病理学、生物医学研究、医薬品開発など、多岐にわたる分野で重要な役割を果たしています。
市場は、製品(機器、アクセサリー・消耗品)、技術(自動、半自動、手動)、エンドユーザー(学術・研究機関、臨床検査室、病院検査室、製薬・バイオテクノロジー企業、受託研究機関(CRO)、外来手術センター(ASC))、および用途(疾患診断、トランスレーショナル・前臨床研究)に基づいてセグメント化されています。また、北米、欧州、アジア太平洋、中東・アフリカ、南米といった地域別の分析も含まれています。
市場規模と成長予測:
組織切片作成市場は、2025年に0.84億米ドルの規模に達し、2030年までに年平均成長率(CAGR)5.71%で成長し、1.10億米ドルに達すると予測されています。
市場の推進要因:
市場成長を牽引する主な要因としては、世界的ながん発生率の上昇、精密医療とコンパニオン診断の採用拡大、組織切片作成およびデジタル病理システムにおける技術進歩が挙げられます。さらに、医療費の増加と検査室自動化への投資、新興経済国における診断インフラの拡大、組織病理サービスに対する政府資金と償還支援も市場を後押ししています。
市場の阻害要因:
一方で、市場の成長を抑制する要因も存在します。高度な組織切片作成装置とメンテナンスの高コスト、熟練した組織技術者および病理医の不足、厳格な規制および品質コンプライアンス要件、そして代替の非侵襲的診断モダリティの普及が課題となっています。
主要セグメントの動向:
* 製品別: 機器セグメントが市場を牽引しており、2024年の収益の61.23%を占めています。特にロータリーミクロトームとクリオスタットミクロトームが主要な製品です。
* 技術別: 自動システムは、人員不足に対応するための検査室の自動化が進むにつれて、年平均成長率7.89%で最も急速に成長しているセグメントです。
* エンドユーザー別: 受託研究機関(CRO)は、製薬企業が医薬品開発期間を短縮するために専門的な組織分析を外部委託する傾向が強まっていることから、年平均成長率8.54%で注目すべき成長を遂げています。
* 地域別: アジア太平洋地域は、医療インフラの拡大と腫瘍発生率の上昇を背景に、年平均成長率6.54%で最も急速に成長している地域です。
規制環境の影響:
規制面では、米国食品医薬品局(FDA)がデジタル病理ソフトウェアをクラスII医療機器に分類したことで、承認プロセスが簡素化されました。これにより、AIやスライドスキャナーの日常的なワークフローへの統合が促進されています。
競争環境:
レポートでは、市場集中度、市場シェア分析、およびAGD Biomedicals、Danaher Corporation、Sakura Finetek Japan Co. Ltd、Thermo Fisher Scientific Inc.などを含む主要企業のプロファイルが詳細に分析されています。
市場機会と将来展望:
本レポートは、市場における未開拓の領域や満たされていないニーズの評価も行っており、将来の市場機会と展望についても言及しています。

1. はじめに
- 1.1 調査の前提と市場の定義
- 1.2 調査範囲
2. 調査方法
3. エグゼクティブサマリー
4. 市場概況
- 4.1 市場概要
-
4.2 市場の推進要因
- 4.2.1 世界的ながん発生率の上昇
- 4.2.2 精密医療とコンパニオン診断の採用拡大
- 4.2.3 組織切片作成およびデジタル病理システムにおける技術進歩
- 4.2.4 医療費の増加と検査室自動化への投資
- 4.2.5 新興経済国における診断インフラの拡大
- 4.2.6 組織病理サービスに対する政府資金と償還支援
-
4.3 市場の阻害要因
- 4.3.1 高度な組織切片作成装置とメンテナンスの高コスト
- 4.3.2 熟練した組織技術者および病理医の不足
- 4.3.3 厳格な規制および品質コンプライアンス要件
- 4.3.4 代替の非侵襲的診断モダリティの普及
- 4.4 規制環境
-
4.5 ポーターの5つの力分析
- 4.5.1 新規参入の脅威
- 4.5.2 買い手/消費者の交渉力
- 4.5.3 供給業者の交渉力
- 4.5.4 代替品の脅威
- 4.5.5 競争の激しさ
5. 市場規模と成長予測(金額、米ドル)
-
5.1 製品別
- 5.1.1 機器
- 5.1.1.1 クライオスタットミクロトーム
- 5.1.1.2 ロータリーミクロトーム
- 5.1.1.3 スライディングミクロトーム
- 5.1.1.4 超ミクロトーム
- 5.1.1.5 振動ミクロトーム
- 5.1.1.6 組織処理装置
- 5.1.1.7 その他の機器(パラフィンディスペンサー、スライドウォーマー、組織バス)
- 5.1.2 付属品 & 消耗品
-
5.2 技術別
- 5.2.1 自動
- 5.2.2 半自動
- 5.2.3 手動
-
5.3 エンドユーザー別
- 5.3.1 学術 & 研究機関
- 5.3.2 臨床検査室
- 5.3.3 病院検査室
- 5.3.4 製薬 & バイオテクノロジー企業
- 5.3.5 受託研究機関(CRO)
- 5.3.6 外来手術センター(ASC)
-
5.4 用途別
- 5.4.1 疾患診断
- 5.4.2 橋渡し研究 & 前臨床研究
-
5.5 地域
- 5.5.1 北米
- 5.5.1.1 米国
- 5.5.1.2 カナダ
- 5.5.1.3 メキシコ
- 5.5.2 ヨーロッパ
- 5.5.2.1 ドイツ
- 5.5.2.2 英国
- 5.5.2.3 フランス
- 5.5.2.4 イタリア
- 5.5.2.5 スペイン
- 5.5.2.6 その他のヨーロッパ
- 5.5.3 アジア太平洋
- 5.5.3.1 中国
- 5.5.3.2 日本
- 5.5.3.3 インド
- 5.5.3.4 オーストラリア
- 5.5.3.5 韓国
- 5.5.3.6 その他のアジア太平洋
- 5.5.4 中東 & アフリカ
- 5.5.4.1 GCC
- 5.5.4.2 南アフリカ
- 5.5.4.3 その他の中東 & アフリカ
- 5.5.5 南米
- 5.5.5.1 ブラジル
- 5.5.5.2 アルゼンチン
- 5.5.5.3 その他の南米
6. 競合情勢
- 6.1 市場集中度
- 6.2 市場シェア分析
-
6.3 企業プロファイル(グローバル概要、市場概要、主要セグメント、利用可能な財務情報、戦略情報、市場ランク/シェア、製品・サービス、最近の動向を含む)
- 6.3.1 AGD Biomedicals (P) Ltd
- 6.3.2 Amos Scientific Pty Ltd
- 6.3.3 Boeckeler Instruments Inc.
- 6.3.4 Danaher Corporation
- 6.3.5 Diapath S.p.A.
- 6.3.6 LLS ROWIAK LaserLabSolutions GmbH
- 6.3.7 Sakura Finetek Japan Co. Ltd
- 6.3.8 SLEE Medical GmbH
- 6.3.9 SM Scientific Instruments Pvt. Ltd
- 6.3.10 Thermo Fisher Scientific Inc.
- 6.3.11 Milestone Medical Srl
- 6.3.12 Bioevopeak Co. Ltd
- 6.3.13 MEDIMEAS Instruments
- 6.3.14 Histo-Line Laboratories
- 6.3.15 Micros Productions GmbH
- 6.3.16 CellPath Ltd
- 6.3.17 Cardinal Health Inc.
- 6.3.18 Epredia (PHC Group)
- 6.3.19 Merck KGaA (Sigma-Aldrich)
- 6.3.20 StatLab Medical Products
7. 市場機会と将来展望
*** 本調査レポートに関するお問い合わせ ***

組織切片作製は、生体から採取された組織や培養された細胞塊などを、顕微鏡で観察可能な厚さに薄くスライスし、適切な処理を施して標本を作製する一連の技術を指します。この技術は、細胞の形態、組織の構造、特定の分子の発現パターンなどを詳細に解析することを目的としており、病理診断、基礎医学研究、創薬研究、獣医学、農学、法医学など、多岐にわたる分野で不可欠な前処理工程として位置づけられています。正確な診断や科学的発見の基盤となるため、その品質は極めて重要であります。
組織切片作製には、主に以下の方法があります。最も広く用いられているのは、パラフィン包埋切片作製法です。この方法では、まず採取された組織をホルマリンなどの固定液で処理し、組織の自己融解を防ぎ、形態を安定させます。次に、アルコール系列を用いて組織内の水分を段階的に除去する脱水処理を行い、キシレンなどの透明化剤でアルコールを置換します。その後、溶融したパラフィンに組織を浸透させ、冷却して固化させることで、組織をパラフィンブロックとして包埋します。このパラフィンブロックをミクロトームと呼ばれる専用の装置で3〜5マイクロメートル程度の薄さに切断し、ガラススライドに貼り付けて乾燥させ、染色に供します。パラフィン包埋切片は、組織構造の保持が良好で、長期保存が可能であるため、形態学的解析、免疫組織化学染色、in situハイブリダイゼーションなど、幅広い用途に利用されます。しかし、作製に数日を要することや、熱や化学処理によって一部の抗原性が失われる可能性がある点が課題であります。
次に、凍結切片作製法があります。この方法は、組織を急速に凍結させ、クリオスタットと呼ばれる低温環境下のミクロトームで切断するものです。凍結切片は、特に手術中の迅速診断(術中迅速診断)に利用され、約15〜30分という短時間で診断結果を得ることが可能です。また、固定や脱水処理を行わないため、熱に弱い酵素や抗原の活性、核酸の完全性が比較的良好に保たれるという利点があります。そのため、酵素組織化学染色や、特定の抗原を検出する免疫組織化学染色、あるいはRNAの検出などにも適しています。一方で、組織構造の保持はパラフィン切片に比べて劣る場合があり、長期保存には不向きなケースが多いです。
さらに、電子顕微鏡観察に用いられる超薄切片作製法があります。この方法では、組織をグルタルアルデヒドなどで固定した後、エポキシ樹脂などの硬質樹脂に包埋します。その後、ウルトラミクロトームと呼ばれる装置で、数十ナノメートルという極めて薄い切片を作製します。超薄切片は、細胞内小器官の詳細な構造や、ウイルス粒子、タンパク質複合体などを高倍率で観察するために不可欠な技術であります。これらの主要な方法の他にも、細胞診で用いられる塗抹標本や、特定の研究目的で組織をそのまま観察する全組織標本、多数の組織サンプルを一つのブロックに集約して効率的な解析を可能にする組織アレイ(Tissue Microarray, TMA)など、様々な作製法が存在します。
組織切片作製技術は、その多様な特性から幅広い分野で活用されています。最も重要な用途の一つは、病理診断です。採取された生検組織や手術検体から作製された切片を病理医が顕微鏡で観察し、細胞の異型性、組織構造の変化、炎症の有無などを評価することで、癌の確定診断、良性・悪性の鑑別、疾患の進行度、治療効果の予測などを行います。これは患者さんの治療方針を決定する上で極めて重要な情報となります。基礎医学研究においては、疾患の発症メカニズムの解明、薬剤の作用機序の解析、発生生物学における組織形成プロセスの追跡、再生医療における組織再生の評価など、多岐にわたる研究に利用されます。創薬研究では、新規薬剤候補の薬効評価や毒性試験において、薬剤投与後の組織変化を詳細に観察するために用いられます。その他、獣医学分野では動物の疾病診断や研究、農学分野では植物の病理診断や品種改良、法医学分野では死因究明や外傷の評価など、生命科学に関わるあらゆる領域でその重要性が認識されています。
組織切片作製は単独で行われるものではなく、多くの関連技術と組み合わせてその価値を発揮します。まず、組織固定は、組織の自己融解や腐敗を防ぎ、生体に近い状態を維持するために不可欠な前処理です。切片作製後には、様々な染色技術が適用されます。最も基本的なのはヘマトキシリン・エオジン(H&E)染色で、組織全体の形態を把握するために用いられます。特定の成分を検出するためには、PAS染色(糖質)、マッソントリクローム染色(コラーゲン線維)などの特殊染色が用いられます。さらに、特定のタンパク質の発現部位や量を検出するためには、免疫組織化学染色(IHC)が広く利用されます。また、特定の核酸(DNAやRNA)の存在部位を検出するin situハイブリダイゼーション(ISH)も重要な関連技術です。作製された切片は、光学顕微鏡、蛍光顕微鏡、共焦点レーザー顕微鏡、電子顕微鏡など、目的に応じた様々な顕微鏡で観察されます。近年では、スライドスキャナーを用いて切片全体をデジタル画像化するデジタル病理技術が普及し、遠隔診断やAIを用いた画像解析の基盤となっています。また、近年注目されている技術として、組織透明化技術があります。これは、組織を透明化することで、切片化せずに厚い組織や臓器全体を3次元的に観察することを可能にするもので、従来の切片作製技術とは異なるアプローチで組織構造を解析します。
組織切片作製に関連する市場は、病理診断、基礎研究、創薬開発といった分野の安定した需要に支えられ、堅調に推移しています。主要な市場プレイヤーとしては、組織処理装置、ミクロトーム、クリオスタット、自動染色装置、スライドスキャナーなどの機器を提供するメーカーや、固定液、包埋剤、染色試薬、抗体などの消耗品を提供するメーカーが挙げられます。近年の市場トレンドとしては、まず自動化・標準化の進展が挙げられます。人為的なエラーを削減し、作業効率を向上させるために、組織処理から切片作製、染色、封入までの一連の工程を自動化するシステムが導入されています。次に、デジタル病理への移行が加速しています。スライドスキャナーでデジタル化された病理画像は、遠隔地からの診断を可能にし、病理医の負担軽減や診断の迅速化に貢献しています。また、AI(人工知能)を用いた画像解析技術との組み合わせにより、診断支援、病変の自動検出、定量的な評価などが可能になりつつあります。さらに、個別化医療や精密医療の進展に伴い、特定のバイオマーカーを検出するための免疫組織化学染色やin situハイブリダイゼーションの需要が増加しており、これらの技術に対応した高感度かつ高精度な試薬や装置の開発が進んでいます。一方で、熟練した技術者の育成、標準化されたプロトコルの徹底、そして高機能な機器や試薬の導入コストなどが、市場における課題として認識されています。
組織切片作製技術は、今後も生命科学研究と医療診断の最前線で進化を続けると予想されます。最も大きな変化の一つは、AI(人工知能)と機械学習のさらなる活用です。デジタル化された病理画像に対してAIが病変を自動検出したり、診断の補助を行ったりするだけでなく、切片作製プロセスの品質管理や最適化にもAIが導入される可能性があります。これにより、診断の精度と効率が飛躍的に向上することが期待されます。また、空間オミクス技術との融合が注目されています。これは、組織切片上で遺伝子発現やタンパク質分布を空間情報と共に解析する技術であり、従来の均一化された組織解析では得られなかった細胞間の相互作用や微小環境の情報を明らかにします。組織切片作製技術は、これらの空間オミクス解析の基盤として、その重要性を増していくでしょう。自動化・ロボット化は、今後もさらに進展し、組織処理から切片作製、染色、封入、スキャン、解析までの一連のワークフローが完全に自動化される「スマートラボ」の実現が視野に入っています。これにより、人手不足の解消、作業の標準化、ハイスループット化が促進されます。さらに、非侵襲的・低侵襲的診断技術の進展も、組織切片作製に影響を与える可能性があります。例えば、リキッドバイオプシーが普及する一方で、確定診断や詳細な病態解析には依然として組織切片が不可欠であり、より微小な生検組織からの高品質な切片作製技術が求められるようになるでしょう。3D組織培養モデルであるオルガノイドやスフェロイドの解析も重要な分野です。これらの生体に近いモデルから高品質な切片を作製し、詳細な解析を行うことで、疾患メカニズムの解明や薬剤スクリーニングの精度向上が期待されます。最終的には、これらの技術革新を通じて、より迅速で正確な診断、個別化された治療法の開発、そして生命現象のより深い理解へと貢献していくことが、組織切片作製技術の未来像と言えるでしょう。